
- •Атомно-молекулярное учение
- •2.10.1. Расчет относительных и абсолютных масс атомов и молекул
- •4) Строение атома
- •6.3. Атом водорода. Линейчатые спектры
- •Экспериментальное подтверждение гипотезы де Бройля. Опыт Дэвиссона и Джермера.
- •Дифракция электронов на двух щелях
- •Содержание
- •Распределение электронов по орбиталям в водородоподобных и многоэлектронных атомах[править | править исходный текст]
- •Взаимодействие ионов
- •Ионные радиусы
- •Энергия ионной связи
- •Ковалентная химическая связь
- •Виды гибридизации[править | править исходный текст]
- •Межмолекулярная и внутримолекулярная водородная связь
- •Межмолекулярная и внутримолекулярная водородная связь
- •Силы межмолекулярного взаимодействия
- •Недостатки существующей классификации термодинамических систем
- •Внутренняя энергия и энтальпия
- •Закон Гесса[править | править исходный текст]
- •4. Энергия Гиббса. (g).
- •5. Химический потенциал ().
- •Второй закон термодинамики. Направление химических процессов.
- •[ Лед ] ↔ {вода} ↔ (пар)
- •Первый закон Рауля
- •Отклонения от закона Рауля
- •Второй закон Рауля
- •Понижение температуры кристаллизации растворов
- •Повышение температуры кипения растворов
- •Криоскопическая и эбулиоскопическая константы
- •Растворы электролитов
- •Свойства разбавленных растворов неэлектролитов
- •Понижение давления пара над раствором
- •Температура кипения и замерзания
- •Значения криоскопических и эбуллиоскопических постоянных некоторых растворителей
- •Основные положения теории Аррениуса.
- •Диссоциация солей, кислот и оснований
- •Классификация
- •2.Сильные и слабые электролиты. Константа диссоциации.
- •3.Закон разбавления Оствальда.
- •Изображение реакций ионного обмена
- •Правила написания реакций ионного обмена
- •Окислительно-восстановительные реакции подразделяют на межмолекулярные, внутримолекулярные, диспропорционирования (или самоокисления-самовосстановления), конпропорционирования.
- •Измерение потенциалов
- •Способы устранения омической составляющей при измерении
- •Основные факторы, влияющие на потенциал
- •Вывод уравнения Нернста
- •Применение электролиза в технике
- •Формулировка законов
- •Математический вид
- •Электрохимическая коррозия
- •Коррозия оцинкованного и луженого железа при местном повреждении
Повышение температуры кипения растворов
Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (то есть давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Tb всегда выше, чем температура кипения чистого растворителя при том же давлении T°b.
Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора
![]()
Криоскопическая и эбулиоскопическая константы
Коэффициенты пропорциональности К и Е в приведённых выше уравнениях — соответственно криоскопическая и эбулиоскопическая постоянные растворителя, имеющие физический смысл понижения температуры кристаллизации и повышения температуры кипения раствора с концентрацией 1 моль/кг. Для воды они равны 1.86 и 0.52 K·моль−1·кг соответственно. Поскольку одномоляльный раствор не является бесконечно разбавленным, второй закон Рауля для него в общем случае не выполняется, и величины этих констант получают экстраполяцией зависимости из области малых концентраций до m = 1 моль/кг.
Для водных растворов в уравнениях второго закона Рауля моляльную концентрацию иногда заменяют молярной. В общем случае такая замена неправомерна, и для растворов, плотность которых отличается от 1 г/см³, может привести к существенным ошибкам.
Второй закон Рауля даёт возможность экспериментально определять молекулярные массы соединений, неспособных к диссоциации в данном растворителе; его можно использовать также для определения степени диссоциации электролитов.
Растворы электролитов
Законы Рауля не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток — растворов электролитов. Для учёта этих отклонений Вант-Гофф внёс в приведённые выше уравнения поправку — изотонический коэффициент i, неявно учитывающий диссоциацию молекул растворённого вещества:
![]() ;
; ![]()
Неподчинение растворов электролитов законам Рауля и принципу Вант-Гоффа послужили отправной точкой для создания С. А. Аррениусом теории электролитической диссоциации.
Криоскопия (от греч. κρύο — холод и греч. σκοπέω смотрю) — метод исследования растворов, в основе которого лежит измерение понижения температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя. Был предложен Ф. Раулем в 1882 году.
Давление пара над раствором нелетучего вещества практически полностью определяется давлением пара растворителя и может быть выражено уравнением (согласно закону Рауля):
![]()
где
![]() —
мольная доля растворителя.
—
мольная доля растворителя.
Видно, что оно ниже, чем давление пара над чистым растворителем, и снижается с ростом концентрации растворенного вещества.
В то же время при замерзании раствора давление пара над твердой фазой должно быть равно давлению пара над жидкостью. Если при замерзании раствора выделяется чистый растворитель, то давление пара над жидким раствором должно быть равно давлению пара над твердым чистым растворителем. Как было показано выше, давление пара над раствором ниже давления пара над чистым жидким растворителем, а следовательно, и соответствующее температуре замерзания равновесие для раствора будет устанавливаться при меньших температурах, чем для чистого растворителя. Это явление имеет важное значение в природе и технике.
Из
приведенного выше выражения (закона
Рауля), с учетом уравнения
Клапейрона — Клаузиуса
можно показать[1],
что изменение температуры замерзания
![]() для
разбавленных растворов может быть
рассчитано по формуле:
для
разбавленных растворов может быть
рассчитано по формуле:
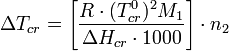
где
![]() —
энтальпия замерзания (кристаллизации);
—
энтальпия замерзания (кристаллизации);
![]() —
молярная масса
растворителя;
—
молярная масса
растворителя;
![]() —
моляльная
концентрация
растворенного вещества.
—
моляльная
концентрация
растворенного вещества.
Здесь выражение в квадратных скобках зависит только от природы растворителя — это так называемая криоскопическая постоянная растворителя k:
![]()
Для воды k = 1,84 K, для железа 110 K[1].
Измеряя , можно определить молярную массу растворенного вещества, в соответствии с выражением:
![]()
где a — число граммов растворенного вещества, приходящееся на 1000 граммов растворителя.
Криоскопия может быть использована для определения активности растворителя, в соответствии с соотношением[2]:
![]()
Кроме того, с помощью криоскопии можно определять степень диссоциации слабых электролитов, чистоту вещества, изучать комплексообразование в растворах и пр.
Эбулиоскопия (от лат. ebulio — вскипаю и греч. σκοπέω — смотрю) — метод исследования растворов, основанный на измерении повышения их температуры кипения по сравнению с чистым растворителем. Используется для определения молекулярной массы растворенного вещества, активности растворителя, степени диссоциации (или изотонического коэффициента).
Температура кипения жидкости — такая температура, при которой давление пара над жидкостью равно внешнему давлению. В то же время давление пара над раствором нелетучего вещества практически полностью определяется давлением пара растворителя и, в соответствии с законом Рауля, может быть выражено уравнением:
где — мольная доля растворителя.
Видно, что при повышении концентрации растворенного вещества давление пара над раствором будет снижаться, а следовательно, при неизменном внешнем давлении, будет расти температура кипения.
С
учетом уравнения
Клапейрона — Клаузиуса
можно показать[1],
что изменение температуры кипения
раствора (![]() )
может быть рассчитано по формуле:
)
может быть рассчитано по формуле:
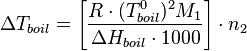
где
![]() —
энтальпия испарения;
—
энтальпия испарения;
— молярная масса растворителя;
— моляльная концентрация растворенного вещества.
Дробь
в квадратных скобках в этом выражении
зависит только от свойств растворителя —
это так называемая эбулиоскопическая
константа
растворителя
![]() .
Она равна повышению температуры кипения
одномоляльного раствора.
.
Она равна повышению температуры кипения
одномоляльного раствора.
Если известны изменение температуры кипения и концентрация раствора, можно определить молярную массу растворенного вещества:
![]()
где a — число грамм растворенного вещества на 1000 г растворителя. Этот метод применим для разбавленных растворов нелетучих веществ и неэлектролитов.
Эбулиоскопический метод позволяет судить о состоянии вещества в растворах электролитов, так как для последних:
![]() ;
;
где i — изотонический коэффициент.
С помощью эбулиоскопии можно определить и активность растворителя, в соответствии с формулой[2]:
![]()
