
- •Термодинамическая система : открытая, закрытая. Виды термодинамических процессов в термодинамической системе.
- •2. Параметры состояния вещества и теплофизические функции, их еденицы измерения.
- •3.Классическая модель идеального газа. Уравнение Клапейрона-Менделеева.
- •Основное уравнения модели идеального газа
- •5. Фазовый переход на p-V диагремме согласно уравнению Ван-дель-Ваальса. Метастабильное состояние
- •7.Агрегатное состояние вещества. Поведение молекул в разных агрегатных состояниях. Энергия одной молекулы газа
- •8. Энергия
- •9.Энтальпия
- •10.Энтропия
- •11. 1 Закон
- •Адиабатный
- •Работа, затрачиваемая на сжатие воздуха в компрессоре, есть техническая работа, определяемая выражением
- •Закон о суммарном давлении смеси газов[править | править исходный текст]
- •Закон о растворимости компонентов газовой смеси[править | править исходный текст]
- •Процессы
- •Применение[править | править исходный текст]
- •Обратный цикл Ренкина[править | править исходный текст]
- •Процесс получения водяного пара из воды
5. Фазовый переход на p-V диагремме согласно уравнению Ван-дель-Ваальса. Метастабильное состояние
Метастабильное состояние (от греч. μετα «через» и лат. stabilis «устойчивый») — состояние квазиустойчивого равновесияфизической системы, в котором система может находиться длительное время.
На PV – диаграмме (рис.6.1) показаны изотермы построенные по уравнению Ван-дер-Ваальса. Из кривых видно, что при сравнительно низких температурах имеются волнообразные участки. Чем выше температура, тем короче эти части кривых. Эти волнообразные кривые указывают на непрерывный переход от жидкого состояния в парообразное при данной температуре. Точка А соответствует состояниижидкости, точка В относится парообразному состоянии вещества.
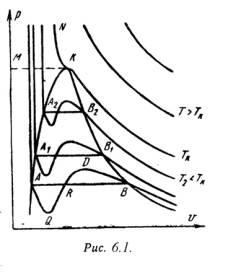 В
действительности переход из жидкого
состояния в парообразное всегда
происходит через двухфазное
состояние вещества.
При этом при данной температуре процесс
перехода происходит также и при
постоянном давлении.
Этот действительный переход из жидкого
состояния в парообразное изображается
прямой линией АВ.
Практически
для особо
чистых веществ возможно
осуществление участков волнообразной
кривой AQ и DB. В первом случае имеют место
неустойчивые состояния перегретой жидкости,
а во втором – переохлажденного пара.
При
определенной температуре изотерма уравнения
Ван-дер-Ваальса не
будет иметь волнообразного участка
(точка К). Этутемпературу называют критической. Если
соединить точки А1,
А2,
А3 …
и В1,
В2,
В3 ...
получим кривую похожую на параболу.
Кривая АК называется нижней
пограничной кривой и
соответствует в состоянии кипения жидкости.
Кривая КВ называется верхней
пограничной кривой и
соответствует состояния сухого
насыщенного пара.
Таким
образом, для реального вещества PV
– диаграмму можно разбить на 3 области:
1
- область жидкого состояния, расположена
левее нижней пограничной кривой;
2
- область двухфазных состояний
(влажный пар),
расположена между нижней и верхней
пограничной кривой);
3 – область
перегретого пара,
расположена правее верхней пограничной
кривой и выше критической точки. Условно
область жидкостиограничивают
сверху линией КМ – критическая изобара.
Критическую
температуру Д.И.Менделеев
называл абсолютной температурой кипения,
при которой поверхностное
натяжение вжидкости становится
равным нулю, т.е. исчезает различие
между жидкостью и
парообразным
состоянием вещества (насыщеннымпаром).
Связь
между критическими параметрами и
постоянными уравнения
Ван-дер-Ваальса:
В
действительности переход из жидкого
состояния в парообразное всегда
происходит через двухфазное
состояние вещества.
При этом при данной температуре процесс
перехода происходит также и при
постоянном давлении.
Этот действительный переход из жидкого
состояния в парообразное изображается
прямой линией АВ.
Практически
для особо
чистых веществ возможно
осуществление участков волнообразной
кривой AQ и DB. В первом случае имеют место
неустойчивые состояния перегретой жидкости,
а во втором – переохлажденного пара.
При
определенной температуре изотерма уравнения
Ван-дер-Ваальса не
будет иметь волнообразного участка
(точка К). Этутемпературу называют критической. Если
соединить точки А1,
А2,
А3 …
и В1,
В2,
В3 ...
получим кривую похожую на параболу.
Кривая АК называется нижней
пограничной кривой и
соответствует в состоянии кипения жидкости.
Кривая КВ называется верхней
пограничной кривой и
соответствует состояния сухого
насыщенного пара.
Таким
образом, для реального вещества PV
– диаграмму можно разбить на 3 области:
1
- область жидкого состояния, расположена
левее нижней пограничной кривой;
2
- область двухфазных состояний
(влажный пар),
расположена между нижней и верхней
пограничной кривой);
3 – область
перегретого пара,
расположена правее верхней пограничной
кривой и выше критической точки. Условно
область жидкостиограничивают
сверху линией КМ – критическая изобара.
Критическую
температуру Д.И.Менделеев
называл абсолютной температурой кипения,
при которой поверхностное
натяжение вжидкости становится
равным нулю, т.е. исчезает различие
между жидкостью и
парообразным
состоянием вещества (насыщеннымпаром).
Связь
между критическими параметрами и
постоянными уравнения
Ван-дер-Ваальса:
Тк = 8·а/(27·R·b) ; Pк = a/(27·b2) ; (6.4) а = (27· R2 ·Т2к)/(64 ·Pк) ; b = (27· R ·Тк)/(8 ·Pк). (6.5)
Уравнение Ван-дер-Ваальса при больших плотностях газа дает значительные ошибки. Кроме этого экспериментальным путем доказана, что коэффициенты а, b зависят от температуры и давления, причем эта зависимость очень сложная. М.П.Вукалович и И.И.Новиков в 1939 г. предложили новое универсальное уравнение состояния реальных газов с учетом ассоциации идиссоциации их молекул, который имеет следующий вид:
(P + a/2)·( – b) = R·T (1 – С/( ·Т(3+2m)/2), (6.6)
Где a, b – постоянные уравнения Ван-дер-Ваальса; С, m – постоянные, определяемые на основании опытных данных.
6.

Фа́зовая диагра́мма (диаграмма состоя́ния) — графическое отображение равновесного состояния бесконечной физико-химической системы при условиях, отвечающих координатам рассматриваемой точки на диаграмме (носит название фигуративной точки).
Обычными координатами для построения фазовой диаграммы являются термодинамические параметры — температура и давление — и состав системы (в мольных или массовых процентах).
В общем случае количество координат превышает число компонентов системы на единицу (диаграмма однокомпонентной системы двумерна, двухкомпонентной — трёхмерна и т. п.) Для конденсированных систем зачастую не учитывают изменение фазовых равновесий за счёт давления, в этом случае число измерений диаграммы равно числу компонентов (диаграмма конденсированной двухкомпонентной системы двумерна, трёхкомпонентной — трёхмерна и т. п.) Сложные фазовые диаграммы в печатных изданиях изображают в виде сечений или проекций.
Согласно правилу фаз, на двумерной диаграмме однофазная область описывается полем, двухфазная — линией (на p-T диаграммах) или набором параллельных линийконод, для которых фиксированы составы равновесных фаз (на диаграммах с участием состава), трёхфазная — точкой (на p-T диаграммах) или горизонталью (на T-x или p-x диаграммах).
На фазовых диаграммах однокомпонентных систем поля, по правилу фаз, соответствуют однофазным состояниям, линии, разграничивающие их — двухфазным, точки пересечения линий — трёхфазным (эти точки называют тройными точками).
Двухфазные линии, как правило, либо соединяют две тройные точки, либо тройную точку с точкой на оси ординат, отвечающую нулевому давлению. Исключение составляет линия жидкость-газ, заканчивающаяся в критической точке. При температурах выше критической различие между жидкостью и паром исчезает.
Тройна́я то́чка — точка на фазовой диаграмме, где сходятся три линии фазовых переходов. Тройная точка — это одна из характеристик вещества. Обычно тройная точка определяется значением температуры и давления, при котором вещество может равновесно находиться в трёх (отсюда и название) агрегатных состояниях: твёрдом, жидком и газообразном. В этой точке сходятся линии плавления, кипения и возгонки.
В более общем случае могут рассматриваться и другие фазы вещества, не соответствующие различным агрегатным состояниям. На достаточно богатых фазовых диаграммах может быть несколько тройных точек. Вещество в тройной точке в состоянии термодинамического равновесия может частично находиться во всех трёх фазах. На многомерных фазовых диаграммах (то есть если кроме температуры и давления присутствуют иные интенсивные величины) могут существовать четверные и т. д. точки.
Критическая
точка —
сочетание значений температуры ![]() и
давления
и
давления ![]() (или,
что эквивалентно, молярного
объёма
(или,
что эквивалентно, молярного
объёма ![]() ),
при которых исчезает различие в свойствах
жидкой и газообразной фаз вещества.
),
при которых исчезает различие в свойствах
жидкой и газообразной фаз вещества.
