
- •4. Бинарные соединения водорода. Приведите примеры кислотных, основных и амфотерных гидридов. Продемонстрируйте их свойства на примере реакций с водой.
- •6. Соединения галогенов с металлами (ионные и ковалентные) и неметаллами, в частности, с углеродом (пвх. Фотопласты)
- •7. Хлор. Строение атома, получение и применение хлора. Химические свойства хлора. Хлороводород, хлориды. Хлориды в природе.
- •8. Общая характеристика элементов via группы. Положение в Периодической системе, строение и
- •9. Кислород. Нахождение в природе, получение и применение. Озон. Озоновый щит.
- •10. Оксиды неметаллов. Классификация. Получение и применение.
- •11. Оксиды металлов. Кислотно-основные свойства. Получение и применение.
- •12. Физические (агрегатное состояние) и химические свойства высших оксидов элементов 2 периода и 3 периода.
- •13. Пероксиды. Кислотные и редокс свойства, получение и применение пероксида водорода. Взаимодействие пероксидов н надпероксидов с углекислым газом.
- •14. Сера. Получение, свойства и применение серы. Природные источники. Сероводород. Кислотно-основные и окислительно-восстановительные свойства сероводорода. Сера в природе. Получение Серы.
- •15.Сульфиды металлов. Распространение в природе. Получение сульфидов. Растворимость в воде и кислотах на примере сульфидов натрия и меди II.
- •16. Кислотные и окислительно-восстановительные свойства, получение и применение серной и сернистой кислот и их солей (по 1 примеру). «Кислотные дожди»
- •18. Строение молекулы, физические и химические свойства, получение и применение аммиака. Свойства гидроксида и солей аммония.
- •19. Оксиды азота. Получение и свойства, образование в атмосфере и экологическая роль оксидов азота (II) и (IV)
- •21. Нитраты. Нахождение в и роль нитратов в природе. Получение, свойства, термическая устойчивость.
- •22. Фосфаты в природе. Получение и свойства фосфорной кислоты.
- •23. Общая характеристика элементов ivа группы, положение в Периодической системе, строение и
- •24. Углерод в природе. Аллотропия. Окислительно-восстановительные характеристики. Получение и применение разных аллотропных модификаций.
- •26. Углеводороды.
- •27. Карбонаты. Получение и применение оксида углерода (IV). Сода. Карбонатная буферная система. «Парниковый эффект».
- •28. Кремний.
19. Оксиды азота. Получение и свойства, образование в атмосфере и экологическая роль оксидов азота (II) и (IV)
Оксиды азота. Азот образует с кислородом ряд оксидов; Все они могут быть получены из азотной кислоты или её солей.
Оксид азота(I) (оксид диазота, закись азота, веселящий газ, лат. Nitrogenium оxуdulatum) — соединение с химической формулой N2O. При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом. Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта.
Закись азота получают нагреванием сухого нитрата аммония. Разложение начинается при 170 град по Цельсию и сопровождается выделением тепла. Поэтому чтобы не дать протекать ему слишком бурно, следует вовремя прекратить нагревание, при температурах более 300 °C разлагается со взрывом:
NH4NO3 → N2O↑ + 2H2O.
Впервые был получен Гемфри Дэви. Бесцветный газ, тяжелее воздуха (относительная плотность 1,527), с характерным сладковатым запахом. Растворим в воде (0,6 объёма N2O в 1 объёме воды при 25 °C). При 0 °C и давлении 30 атм, а также при обычной температуре и давлении 40 атм сгущается в бесцветную жидкость. Из 1 кг жидкой закиси азота образуется 500 л газа. Не воспламеняется, но поддерживает горение. Смеси с эфиром, циклопропаном, хлорэтилом в определённых концентрациях взрывоопасны.
Химические свойства:
Относится к несолеобразующим оксидам. В нормальных условиях N2O химически инертен, при нагревании проявляет свойства окислителя:
N2O + H2 → N2↑ + H2O;
N2O + C → N2↑ + CO↑.
При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя:
5N2О + 8KMnO4 + 7H2SO4 → 5Mn(NO3)2 + 3MnSO4 + 4K2SO4 + 7H2O.
При нагревании N2O разлагается:
2N2O → 2N2↑ + O2↑.
Применение:
Используется в основном как средство для ингаляционного наркоза, в основном в сочетании с другими препаратами (из-за недостаточно сильного обезболивающего действия). В то же время это соединение можно назвать самым безопасным средством для наркоза, так как после его применения почти не бывает осложнений. Также иногда используется для улучшения технических характеристик двигателей внутреннего сгорания.
Окси́д азо́та (II) NO (моноксид азота) — несолеобразующий оксид азота. Он представляет собой безцветный газ, плохо растворимый в воде. Температура кипения −151,8 °C, температура плавления −163,7 °C. Сжижается он с трудом; в жидком и твёрдом виде имеет голубой цвет. Известно, что в твёрдом виде он состоит из слабосвязанных N2O2
Оксид азота(II) — единственный из оксидов азота, который можно получить непосредственно из свободных элементов соединением азота с кислородом при высоких температурах (1200—1300 °C) или в электрическом разряде. В природе он образуется в атмосфере при грозовых разрядах:
N2 + O2 → 2NO — 180,9 кДж
и тотчас же реагирует с кислородом:
2NO + O2 → 2NO2
При понижении температуры оксид азота(II) разлагается на азот и кислород, но если температура падает резко, то не успевший разложиться оксид существует достаточно долго: при низкой температуре скорость распада невелика. Такое резкое охлаждение называется «закалкой» и используется при одном из способов получения азотной кислоты.
В лаборатории его обычно получают взаимодействием 30%-ной HNO3 с некоторыми металлами, например, с медью:
3Cu + 8HNO3 (30 %) → 3Cu(NO3)2 + 2NO↑ + 4H2O
NO трудно отдаёт свой кислород, поэтому реагирует лишь с очень активными веществами (фосфор, фтор, бром, хлор), сильными окислителями (например, перманганатом калия KMnO4) или сильными восстановителями.
По отношению к галогенам NO проявляет свойства восстановителя:
2NO + Cl2 → 2NOCl (нитрозилхлорид).
В присутствии более сильных восстановителей NO проявляет окислительные свойства:
2SO2 + 2NO → 2SO3 + N2↑
Окси́д азо́та(IV) (диоксид азота, бурый газ) NO2 — газ, красно-бурого цвета, с характерным острым запахом. Температура плавления −11,2 °C, температура кипения 21,15 °C.
В обычном состоянии NO2 существует в равновесии со своим димером N2O4. Склонность к его образованию объясняется наличием в молекуле NO2 неспаренного электрона. При температуре ниже −12 °C белые кристаллы состоят только из молекул N2O4, при температуре 140 °C диоксид азота состоит только из молекул NO2, он очень тёмного, почти чёрного цвета. В точке кипения NO2 представляет из себя красно-бурую жидкость, содержащую около 0,1 % NO2.
В лаборатории NO2 обычно получают воздействием концентрированной азотной кислотой на медь:
Cu + 4HNO3 (конц.) → Cu(NO3)2 + 2NO2↑ + 2H2O.
Также его можно получить термическим разложением нитрата свинца, однако при проведении реакции следует соблюдать осторожность:
2Pb(NO3)2 → 2PbO + 4NO2↑ + O2↑.
Кислотный оксид, ему соответствуют азотная и азотистая кислоты. NO2 отличается высокой химической активностью. Он взаимодействует с неметаллами (фосфор, сера и углерод горят в нём). В этих реакциях NO2 — окислитель:
2NO2 + 2C → 2CO2↑ + N2↑;
10NO2 + 8P → 4P2O5 + 5N2↑ (10NO2 + 2P4 → 2P4O10 + 5N2↑);
Окисляет SO2 в SO3 — на этой реакции основан нитрозный метод получения серной кислоты:
SO2 + NO2 → SO3 + NO↑.
При растворении оксида азота(IV) в воде образуются азотная и азотистая кислоты (реакция диспропорционирования):
2NO2 + H2O ↔ HNO3 + HNO2.
Поскольку азотистая кислота неустойчива, при растворении NO2 в тёплой воде образуются HNO3 и NO:
3NO2 + H2O → 2HNO3 + NO↑.
Если растворение проводить в избытке кислорода, образуется только азотная кислота (NO2 проявляет свойства восстановителя):
4NO2 + H2O + O2 ↔ 4HNO3.
При растворении NO2 в щелочах образуются как нитраты, так и нитриты:
2NO2 + 2KOH → KNO3 + KNO2 + H2O
Применяется в производстве серной и азотной кислот, в качестве окислителя в жидком ракетном топливе и смесевых взрывчатых веществах.
20. Азотная кислота.
Получение и применение. Взаимодействие
с металлами и неметаллами ( на примере
меди, железа и фосфора).Чистая
азотная кислота HNO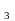 —бесцветная
жидкость плотностью 1,51 г/см
—бесцветная
жидкость плотностью 1,51 г/см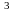 при - 42 °С застывающая в прозрачную
кристаллическую массу. На воздухе она,
подобно концентрированной соляной
кислоте, «дымит», так как пары ее образуют
с 'влагой воздуха мелкие капельки тумана,
при - 42 °С застывающая в прозрачную
кристаллическую массу. На воздухе она,
подобно концентрированной соляной
кислоте, «дымит», так как пары ее образуют
с 'влагой воздуха мелкие капельки тумана,
Азотная кислота не отличается прочностью, Уже под влиянием света она постепенно разлагается:
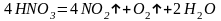
Чем выше температура и чем концентрированнее кислота, тем быстрее идет разложение. Выделяющийся диоксид азота растворяется в кислоте и придает ей бурую окраску.
Азотная кислота принадлежит к числу наиболее сильных кислот; в разбавленных растворах она полностью распадается на ионы Н+ и NO3ˉ.
2. Окислительные
свойства азотной кислоты.
Характерным свойством азотной кислоты
является ее ярко выраженная окислительная
способность. Азотная кислота—один из
энергичнейших окислителей. Многие
неметаллы легко окисляются ею, превращаясь
в соответствующие кислоты. Так, сера
при кипячении с азотной кислотой
постепенно окисляется в серную кислоту,
фосфор — в фосфорную. Тлеющий уголек,
погруженный в концентрированную HNO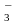 ,
ярко разгорается.
,
ярко разгорается.
Азотная кислота действует почти на все металлы (за исключением золота, платины, тантала, родия, иридия), превращая их в нитраты, а некоторые металлы—в оксиды.
Концентрированная HNO пассивирует некоторые металлы. Еще Ломоносов открыл, что железо, легко растворяющееся в разбавленной азотной кислоте, не растворяется в холодной концентрированной HNO . Позже было установлено, что аналогичное действие азотная кислота оказывает на хром и алюминий. Эти металлы переходят под действием концентрированной азотной кислоты в пассивное состояние.Степень окисленности азота в азотной кислоте равна 4-5. Выступая в качестве окислителя, НNО может восстанавливаться до различных продуктов:

Какое из этих
веществ образуется, т. е. насколько
глубоко восстанавливается азотная
кислота в том или ином случае, зависит
от природы восстановителя и от условий
реакции, прежде всего от концентрации
кислоты. Чем выше концентрации HNO
,
тем менее глубоко она восстанавливается.
При реакциях с концентрированной
кислотой чаще всего выделяется
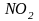 .
При взаимодействии разбавленной азотной
кислоты с малоактивными металлами,
например, с медью, выделяется NO.
В случае более активных металлов —
железа, цинка, — образуется
.
При взаимодействии разбавленной азотной
кислоты с малоактивными металлами,
например, с медью, выделяется NO.
В случае более активных металлов —
железа, цинка, — образуется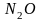 .
Сильно разбавленная азотная кислота
взаимодействует с активными
металлами—--цинком, магнием, алюминием
-— с образованием иона аммония, дающего
с кислотой нитрат аммония. Обычно
одновременно образуются несколько
продуктов.
.
Сильно разбавленная азотная кислота
взаимодействует с активными
металлами—--цинком, магнием, алюминием
-— с образованием иона аммония, дающего
с кислотой нитрат аммония. Обычно
одновременно образуются несколько
продуктов.
Для иллюстрации приведем схемы реакций окисления некоторых металлов азотной кислотой;
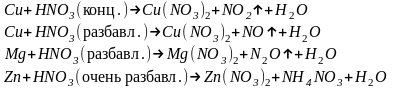
При действии азотной кислоты на металлы водород, как правило, не выделяется.
При окислении
неметаллов концентрированная азотная
кислота, как и в случае металлов,
восстанавливается до
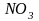 ,
например
,
например
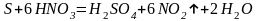
Более разбавленная кислота обычно восстанавливается до NO, например:
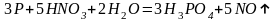
Приведенные схемы
иллюстрируют наиболее типичные случаи
взаимодействия азотной кислоты с
металлами и неметаллами. Вообще же,
окислительно-восстановительные реакции,
идущие с участием
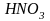 ,
протекают сложно.
,
протекают сложно.
Смесь, состоящая
из 1 объема азотной и 3—4 объемов
концентрированной соляной кислоты,
называется царской
водкой.
Царская водка растворяет некоторые
металлы, не взаимодействующие с азотной
кислотой, в том числе и «царя
металлов»—золото. Действие ее
объясняется тем, что азотная кислота
окисляет соляную с выделением свободного
хлора и образованием хлороксида
азота(III), или
хлорида
нитрозила,
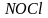 :
:
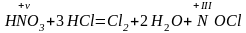
Хлорид нитрозила является промежуточным продуктом реакции и разлагается:
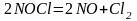
Хлор в момент выделения состоит из атомов, что и обусловливает высокую окислительную способность царской водки. Реакции окисления золота и платины протекают в основном согласно следующим уравнениям.
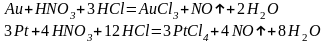
С избытком соляной
кислоты хлорид золота(III) и хлорид
платины (IV) образуют комплексные
соединения
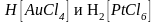
На многие органические вещества азотная кислота действует так, что один или несколько атомов водорода в молекуле органического соединения замещаются нитрогруппами . Этот процесс называется нитрованием и имеет большое значение в органической химии.
Азотная кислота — одно из важнейших соединений азота: в больших количествах она расходуется в производстве, азотных удобрений, взрывчатых веществ и органических красителей, служит окислителем во многих химических процессах, используется в производстве серной кислоты по нитрозному способу, применяется для изготовления целлюлозных лаков, кинопленки.
