
- •1.Химия как раздел естествознания. Предмет и задачи химии
- •2.Основные понятия и законы химии
- •3.Основы термодинамики.Закон гесса
- •4. Энтальпия, энтропия, изобарно-изотемический потенциал системы.
- •5. Эквивалент.Закон эквивалентов
- •7.Скорость хим.Реакции в гомогенных и гетерогенных средах
- •8. Зависимость скорости химической реакции от t (приближенное правило Вант-Гоффа)
- •9. Зависимость скорости хим.Реакции от концентрации (Закон действия масс)
- •10. Химическое равновесие
- •11.Константа равновесия
- •12. Принцип Ле-Шателье
- •14. Давление пара жидкости над раствором. 1 закон Рауля
- •15. Температура кипения и замерзания растворов. 2 закон Рауля
- •16. Осмос
- •17.Закон Генри
- •18. Понятие об электролитах
- •19. Теория электролитической диссоциации
- •20. Изотонический коэффициент
- •22. Константа диссоциации. Закон разбавления Оствальда
- •23. Ионное произведение воды. Шкалы pH и pOh
- •24. Реакции между электролитами (правило Бертолле)
- •25.Гидролиз солей
- •26. Модели строения атома (Томсона, Резерфорда, Бора с постулатами)
- •27.Современная теория строения атома
- •28.Волновая функция уравнения Шредингера
- •29 .Главное и орбитальное квантовые числа
- •30.Магнитное и спиновое квантовые числа
- •31.Характеристика и форма электронных орбиталей
- •37.Энергия ионизации.Сродство атома к электрону.Электроотрицательность
- •38.Ковалентная связь.
- •39.Ионная связь
- •40.Донорно-акцепторная связь
- •41.Металлическая связь
- •42.Водородная связь
- •43.Межмолекулярные взаимодействия
- •44. Окислительно-восстановительные процессы
- •50.Принцип работы гальванического элемента
- •51.Формула Нернста
- •53.Ряд напряжений металлов
- •54. Законы Фарадея
- •55.Понятие о коррозии металлов
- •56.Химическая коррозия металлов.
- •57.Электрохимическая коррозия металлов.
- •58. Характеристика методов защиты от коррозии.
- •59.Анодный и катодный характер защиты от коррозии.
- •60. Катодная защита
- •61.Протекторная защита
- •62.Химия воды
- •65.Жёсткость воды. Виды жёсткости воды.
- •66.Основные способы устранения жёсткости воды.
- •67.Вяжущие вещества
- •68.Неорганические вяжущие вещества
- •69.Воздушные вяжущие вещества
- •70.Гипсовые вяжущие вещества.
- •71.Коррозия цементного камня(три вида)
- •72.Методы борьбы с коррозией цементного камня
5. Эквивалент.Закон эквивалентов
Основные законы химии:1)Закон эквивалентов был открыт в 1793 Рихтаром.Все в-ва реагируют между собой строго определенных кол-ых соотношениях пропорциональных их эквивалентах.m1\m2=Э1\Э2;m1\m2=Mэ1\Мэ2
Эквивалент - количество в-ва которое соединяеться с одним молем атома водорода или замещает его в ходе хим. Реакции
7.Скорость хим.Реакции в гомогенных и гетерогенных средах
Гомогенные реакции протекают равномерно во всём объёме в однородной среде. Гетерогенные протекают на границе раздела фаз
![]()
Скорость гомогенной реакции измеряется изменением молярной концентрации (или изменением числа молей в единице объёма) одного из реагирующих веществ в единицу времени
Скорость гетерогенной реакции измеряется изменением числа молей одного из реагирующих веществ на единице площади соприкосновения в единицу времени.
8. Зависимость скорости химической реакции от t (приближенное правило Вант-Гоффа)
Правило Вант-Гоффа - при повышении температуры реаг-ей смеси на каждые 10° С скорость реакции увеличивается в 2-4 раза. Это правило является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакций, протекающих при температурах, близких к комнатной (энергия активации таких реакций 50-150 кДж/моль).
![]()
9. Зависимость скорости хим.Реакции от концентрации (Закон действия масс)
Закона действия масс состоит в том, что скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях соответствующих стехиометрических коэффициентов. Для реакции
nAA + nBB + ... → nCC + nDD + ...
закон действующих масс запишется следующим образом:
v
=![]() , где
, где
cA, cB, ... - концентрации реагирующих веществ A, B, ... ;
nA, nB, ... - порядки реакции по соответствующим реагентам (как правило, совпадают со стехиометрическими коэффициентами этих реагентов в уравнении реакции);
k - коэффициент пропорциональности, константа скорости реакции, зависящая от природы реагирующих веществ и от температуры;
v - скорость реакции.
Данное уравнение носит название кинетического уравнения реакции.
10. Химическое равновесие
Устойчивое динамическое равновесие - это состояние системы при котором для обратимого процесса скорость прямой реакции полностью соответствует скорости обратной реакции, т.е. за опред. промежуток времени образ-ся столько продукта реакции, сколько его распадается на исходные реагенты.
11.Константа равновесия
В состоянии термодинамического равновесия концентрации всех реагирующих веществ, согласно закону действующих масс, связаны соотношением (константа равновесия):
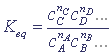
Кр зависит от природы реагентов, температуры, не зависит от концентрации и давления
12. Принцип Ле-Шателье
Принцип Ле-Шателье - внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в сторону противодействия произведённому воздействию.
1)Увеличение давления смещает равновесие в сторону реакции, ведущей к уменьшению объема.
2)Повышение температуры смещает равновесие в сторону эндотермической реакции.
3)Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещают равновесие в строну прямой реакции.
4)Катализаторы не влияют на положение равновесия.
