
- •Вторичные энзимопатии
- •Энзимопатии углеводного обмена
- •13. Регуляция активности ферментов осуществляется благодаря следующим механизмам:
- •А. Инициация репликации
- •В. Ориджины репликации
- •Метилирование днк
- •Д. Клеточный цикл и его регуляция
- •Депуринизация (апуринизация)
- •Дезаминирование
- •16. Первичная структура рнк - порядок чередования рибонуклеозидмонофосфатов (нмф) в полинуклеотидной
- •Сплайсинг первичных транскриптов мРнк
- •Альтернативный сплайсинг первичных транскриптов мРне
- •Посттранскрипционные модификации (процессинг) первичного транскрипта рРнк. Формирование рибосом
- •Генетический код и его свойства
- •Смысл кодонов
- •Специфичность
- •Линейность записи информации
- •Матричная рнк
- •Аминоацил –тРнк синтетазы
- •Рибосомы
- •А. Ингибиторы репликации - противоопухолевые препараты
- •Б. Ингибиторы транскрипции и трансляции - антибактериальные препараты
- •Токсины
- •Г. Интерфероны
10.В настоящее время получены неопровержимые экспериментальные доказательства белковой природы ферментов.О белковой природе ферментов свидетельствует факт инактивирования (потеря активности) ферментов брожения при кипячении, установленный еще Л. Пастером. При кипячении наступает необратимая денатурация белка-фермента. Фермент при этом теряет присущее ему свойство катализировать химическую реакцию. Точно так же белки при кипячении денатурируются и теряют свои биологические свойства(антигенные,гормональные,каталитические). Под влиянием различных физических и химических факторов(воздействие УФ- и рентгеновского излучения, ультразвука, осаждение минеральными кислотами, щелочами, алкалоидными реактивами, солями тяжелых металлов и др.) происходит денатурация ферментов, так же как и белков.Ферменты при гидролизе, как и белки, распадаются на аминокислоты, что, бесспорно, служит веским доказательством белковой природы ферментов.Интересные данные, указывающие на белковую природу ферментов, были получены в лаборатории И.П. Павлова. При определении переваривающей способности желудочного сока была обнаружена прямая зависимость между этой способностью и количеством белка в соке.Вескими доказательствами белковой природы фермента являются его получение в чистом виде и выделение в форме кристаллов белка. К настоящему времени получено более 1000 кристаллических ферментов.Ферменты, как и все белки, обладают рядом свойств, характерных для высокомолекулярных соединений: амфотерностью (могут существовать в растворе в виде анионов, катионов и амфионов);электрофоретической подвижностью благодаря наличию в них положительных и отрицательных зарядов, а в изоэлектрической точке не обнаруживают подвижности в электрическом поле. Ферменты неспособны к диализу через полупроницаемые мембраны. При помощи диализа их растворы можно освободить от низкомолекулярных примесей. Как и белки, они легко осаждаются из водных растворов при низких температурах методами высаливания или осторожным добавлением ацетона, этанола и других веществ и при этом не теряют своих каталитических свойств.Подобно белкам, ферменты имеют большую молекулярную массу – от десятков тысяч до нескольких миллионов.Ферменты оказывают высокоспецифическое действие, что также доказывает их белковую природу, поскольку белки в иммунологическом отношении отличаются крайне высокой специфичностью. Наконец, прямым доказательством белковой природы ферментов является лабораторный синтез первого фермента – рибонуклеазы, осуществленный в 1969 г. в лаборатории Б. Меррифилда в Нью-Йорке.В природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза, фосфатаза и др. Большинство природных ферментов относится к классу сложных белков, содержащих, помимо полипептидных цепей, какой-либо небелковый компонент (кофактор), присутствие которого является абсолютно необходимым для каталитической активности. Кофакторы могут иметь различную химическую природу и различаться по прочности связи с полипептидной цепью. Если константа диссоциации сложного фермента настолько мала, что в растворе все полипептидные цепи оказываются связанными со своими кофакторами и не разделяются при выделении и очистке, то такой фермент получает название холофермента (холоэнзим), а кофактор – простетической группы, рассматривающейся как интегральная часть молекулы фермента. Полипептидную часть фермента принято называть апоферментом.Типичными представителями коферментов являются витамины В1, В2, В6, РР, содержащие кофермменты. Известно также, что и простетические группы, и коферменты активно включаются в химические реакции, выполняя функции промежуточных переносчиков электронов, атомов водорода или различных функциональных групп (например, аминных, ацетильных, карбоксильных). В подобных случаях кофермент рассматривают в качестве второго субстрата, или косубстрата. Многие двухвалентные металлы (Mg2+, Мn2+, Са2+) также выполняют роль кофакторов, хотя они не относятся ни к коферментам, ни к простетическим группам. Известны примеры, когда ионы металлов прочно связаны с белковой молекулой, выполняя функции простетической группы. В частности, очищенный фермент, катализирующий окисление аскорбиновой кислоты (витамин С) в дезоксиаскорбиновую кислоту, содержит 8 атомов меди на одну молекулу; все они настолько прочно связаны с белковой молекулой, что даже не обмениваются с ионообменными смолами и не отделяются методом диализа.Интересно отметить, что свободные ионы меди также наделены каталитической активностью при окислении аскорбиновой кислоты, однако эта активность повышается во многие тысячи раз, если ионы меди соединяются с апофер-ментом в единый комплекс – холофермент.Изоферменты, или изоэнзимы,– это множественные формы фермента, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по физическим и химическим свойствам, в частности по сродству к субстрату, максимальной скорости катализируемой реакции (активности), электрофоретической подвижности или регуляторным свойствам.В живой природе имеются ферменты, молекулы которых состоят из двух и более субъединиц, обладающих одинаковой или разной первичной, вторичной или третичной структурой. Субъединицы нередко называют протомерами, а объединенную олигомерную молекулу – мультимером.Считают, что процесс олигомеризации придает субъединицам белков повышенную стабильность и устойчивость по отношению к действию денатурирующих агентов, включая нагревание, влияние протеиназ и др.Если генетически различимые субъединицы могут существовать более чем в одной форме, то соответственно и фермент, образованный из двух или нескольких типов субъединиц, сочетающихся в разных количественных пропорциях, может существовать в нескольких сходных, но не одинаковых формах. Подобные разновидности фермента получили название изоферментов (изоэнзимов или, реже, изозимов). В частности, если фермент состоит из 4 субъединиц двух разных типов – Н и М (сердечный и мышечный), то активный фермент может представлять собой одну из следующих комбинаций: НННН, НННМ, ННММ, НМММ, ММММ, или Н4, Н3М, Н2М2, НМ3, М4, соответствующую изоферментам ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4 и ЛДГ5. При этом синтез Н- и М-типов осуществляется различными генами и в разных органах экспрессируется по-разному.В одних случаях субъединицы имеют почти идентичную структуру и каждая содержит каталитически активный участок (например, ?-галакто-зидаза, состоящая из 4 субъединиц). В других случаях субъединицы оказываются неидентичными. Примером последних может служить трипто-фансинтаза, состоящая из 2 субъединиц, каждая из которых наделена собственной (но не основной) энзиматической активностью, однако, только будучи объединенными в макромолекулярную структуру, обе субъединицы проявляют триптофансинтазную активность.Термин «множественные формы фермента» применим к белкам, катализирующим одну и ту же реакцию и встречающимся в природе в организмах одного вида. Термин «изофермент» применим только к тем множественным формам ферментов, которые появляются вследствие генетически обусловленных различий в первичной структуре белка (но не к формам, образовавшимся в результате модификации одной первичной последовательности).Одним из наиболее изученных 4 ферментов, множественность форм которого детально изучена методом гель-электрофореза, является ЛДГ, катализирующая обратимое превращение пировиноградной кислоты в молочную. Пять изоферментов ЛДГ образуются из 4 субъединиц примерно одинакового размера, но двух разных типов. Поскольку Н-протомеры несут более выраженный отрицательный заряд при рН 7,0–9,0, чем М-про-томеры, изофермент, состоящий из 4 субъединиц Н-типа (Н4), при электрофорезе будет мигрировать с наибольшей скоростью в электрическом поле к положительному электроду (аноду). С наименьшей скоростью будет продвигаться к аноду изофермент М4, в то время как остальные изо-ферменты будут занимать промежуточные позиции. Следует подчеркнуть, что изоферменты ЛДГ, обладая почти одинаковой ферментативной активностью, различаются некоторыми физико-химическими свойствами: молекулярной массой, электрофоретической подвижностью, отношением к активаторам и ингибиторам и др., однако для каждой ткани в норме характерно свое соотношение форм (изоферментный спектр) ЛДГ. Например, в сердечной мышце преобладает Н4, т.е. ЛДГ1 , а в скелетных мышцах и печени – М4 (ЛДГ5). Эти обстоятельства широко используют в клинической практике, поскольку изучение появления изоферментов ЛДГ (и ряда других ферментов) в сыворотке крови может представлять интерес для дифференциальной диагностики органических и функциональных поражений органов и тканей. По изменению содержания изоферментов в сыворотке крови можно судить как о топографии патологического процесса, так и о степени поражения органа или ткани.Современные классификация и номенклатура ферментов были разработаны Комиссией по ферментам Международного биохимического союза и утверждены на V Международном биохимическом конгрессе в 1961 г. в Москве.До 1961 г. не было и единой классификации ферментов. Трудности заключались в том, что разные исследователи за основу классификации ферментов брали различные принципы. Комиссией были рассмотрены 3 принципа, которые могли служить основой для классификации ферментов и их обозначения. Первый принцип – химическая природа фермента, т.е. принадлежность к флавопротеинам, пиридоксальфосфатпротеинам, гемо-протеинам, металлопротеинам и т. д. Однако этот принцип не мог служить общей основой для классификации, так как только для небольшого числа ферментов известны простетические группы, доступные идентификации и прямому определению. Второй принцип – химическая природа субстрата, на который действует фермент. По этому принципу трудно классифицировать фермент, так как в качестве субстрата могут служить разнообразные соединения внутри определенного класса веществ (белки, углеводы, липиды, нуклеиновые кислоты) и бесчисленное множество промежуточных продуктов обмена. В основу принятой классификации положен третий принцип – тип катализируемой реакции , который является специфичным для действия любого фермента. Этот принцип логично использовать в качестве основы для классификации и номенклатуры ферментов.Таким образом, тип катализируемой химической реакции в сочетании с названием субстрата (субстратов) служит основой для систематического наименования ферментов. Согласно Международной классификации, ферменты делят на шесть главных классов, в каждом из которых несколько подклассов: 1) оксидоредуктазы; 2) трансферазы; 3) гидролазы; 4) лиазы; 5) изомеразы; 6) лигазы (синтетазы).Оксидоредуктазы. К классу оксидоредуктаз относят ферменты, катализирующие с участием двух субстратов окислительно-восстановительные реакции, лежащие в основе биологического окисления. Систематические названия их составляют по форме «донор: акцептор оксидоредуктаза». Например, лактат: НАД+ оксидоредуктаза для лактатдегидрогеназы (ЛДГ).Различают следующие основные оксидоредуктазы: аэробные дегидро-геназы или оксидазы, катализирующие перенос протонов (электронов) непосредственно на кислород; анаэробные дегидрогеназы, ускоряющие перенос протонов (электронов) на промежуточный субстрат, но не на кислород; цитохромы, катализирующие перенос только электронов. К этому классу относят также гемсодержащие ферменты каталазу и пероксидазу, катализирующие реакции с участием перекиси водорода.Трансферазы. К классу трансфераз относят ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов. Наименование их составляется по форме «донор: транспортируемая группа – трансфераза».Различают трансферазы, катализирующие перенос одноуглеродных остатков, ацильных, гликозильных, альдегидных или кетонных, нуклеотидныхостатков, азотистых групп, остатков фосфорной и серной кислот и др. Например: метил- и формилтрансферазы, ацетилтрансферазы, амино-трансферазы, фосфотрансферазы и др.Гидролазы. В класс гидролаз входит большая группа ферментов, катализирующих расщепление внутримолекулярных связей органических веществ при участии молекулы воды. Наименование их составляют по форме «субстрат-гидролаза». К ним относятся: зстеразы – ферменты, катализирующие реакции гидролиза и синтеза сложных эфиров; гликозидазы, ускоряющие разрыв гликозидных связей; фосфатазы и пептидгидролазы, катализирующие гидролиз фосфоангидридных и пептидных связей; ами-дазы, ускоряющие разрыв амидных связей, отличных от пептидных, и др.Лиазы. К классу лиаз относят ферменты, катализирующие разрыв связей С—О, С—С, С—N и других, а также обратимые реакции отщепления различных групп от субстратов не гидролитическим путем. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту разрыва двойной связи. Ферменты обозначают термином «субстрат-лиазы». Например, фумарат-гидратаза (систематическое название «L-малат-гидролаза») катализирует обратимое отщепление молекулы воды от яблочной кислоты с образованием фумаровой кислоты. В эту же группу входят декарбоксилазы (карбоксилиазы), амидинлиазы и др.Изомеразы. К классу изомераз относят ферменты, катализирующие взаимопревращения оптических и геометрических изомеров. Систематическое название их составляют с учетом типа реакции: «субстрат – цис-транс-изомераза». Если изомеризация включает внутримолекулярный перенос группы, фермент получает название «мутаза».К этому же классу относят рацемазы и эпимеразы, действующие на амино- и оксикислоты, углеводы и их производные; внутримолекулярные оксидоредуктазы, катализирующие взаимопревращения альдоз и кетоз; внутримолекулярные трансферазы, переносящие ацильные, фосфорильные и другие группы, и т.д.Лигазы (синтетазы). К классу лигаз относят ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии распада АТФ (или другого нуклеозидтрифосфата). Систематическое название их составляют по форме «X : Y лигаза», где X и Y обозначают исходные вещества. В качестве примера можно назвать L-глутамат: аммиак лигазу (рекомендуемое сокращенное название «глутаминсинтетаза»), при участии которой из глутаминовой кислоты и аммиака в присутствии АТФ синтезируется глутамин.
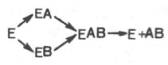
11.Структура и функции ферментов, а также механизм их действия почти ежегодно подробно обсуждаются на многих международных симпозиумах и конгрессах. Важное место отводится рассмотрению структуры всей молекулы фермента и ее активных центров, молекулярному механизму действия различных типов ферментов, общей теории энзиматического катализа. Тем не менее до сих пор нет полной ясности по двум кардинальным проблемам энзимологии: чем вызваны специфичность действия и высокая каталитическая эффективность ферментов?До установления химической природы ферментов гипотезы о механизме их действия опирались на исследования кинетики и модельные опыты химического гомогенного катализа. Повышение скорости химических реакций под действием ферментов объясняли следующим: а) активированием субстрата в результате образования адсорбционных или молекулярных, обратимо диссоциирующих фермент-субстратных комплексов; б) цепным механизмом реакций с участием радикалов или возбужденных молекул. Оказалось, что цепные механизмы реакции не играют существенной роли в биологическом катализе. После установления химической природы ферментов подтвердилось представление, выдвинутое более 80 лет назад В. Анри, Л. Михаэлисом и М. Ментен, о том, что при энзиматическом катализе фермент Е соединяется (в принципе обратимо) со своим субстратом S, образуя нестойкий промежуточный фермент-субстратный комплекс ES, который в конце реакции распадается с освобождением фермента и продуктов реакции Р. Благодаря высокому сродству связывания и образованию ES-комплекса резко возрастает число молекул субстрата, вступающих в реакции. Эти представления легли в основу теории «ключа-замка» Э. Фишера, которую иногда называют теорией «жесткой матрицы». Таким образом, жесткая структура активного центра оказывается комплементарной молекулярной структуре субстрата, обеспечивая тем самым высокую специфичность фермента. Л. Михаэлис не только постулировал образование промежуточного фермент-субстратного ES-комплекса, но и рассчитал влияние концентрации субстрата на скорость реакции. В процессе реакции различают несколько стадий: присоединение молекулы субстрата к ферменту, преобразование первичного промежуточного соединения в один или несколько последовательных (переходных) комплексов и протекающее в одну или несколько стадий отделение конечных продуктов реакции от фермента. Это можно схематически проиллюстрировать следующими примерами:
![]()
В реакциях анаболизма, например А + В —> АВ, фермент может соединяться как с одним, так и с другимсубстратом или обоими субстратами:
В реакциях катаболизма, например АВ —> А + В:
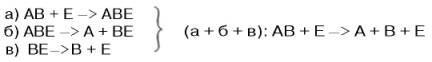
Прямые доказательства существования фермент-субстратного комплекса были получены в лабораториях Д. Кейлина и Б. Чанса. В настоящее время экспериментальные и математические методы кинетики, термодинамики и статической механики химических реакций позволяютпределить для ряда ферментативных реакций кинетические и термодинамические показатели, в частности константы диссоциации промежуточных фермент-субстратных комплексов, константы скорости и равновесия их образования.
В образовании фермент-субстратных комплексов участвуют водородные связи, электростатические и гидрофобные взаимодействия, а в ряде случаев также ковалентные, координационные связи. Информация о природе связей между субстратом и связывающим участком активного центра фермента может быть получена методами ЭПР и ЯМР, а также методами УФ- и ИК-спектроскопии. В каталитическом процессе существенное значение имеют точное соответствие между ферментом и субстратом, а также термодинамические и каталитические преимущества подобного соответствия. Гипотеза «индуцированного соответствия» предполагает существование между ферментоми субстратом не только пространственной или геометрической компле-ментарности, но и электростатического соответствия, обусловленного спариванием противоположно заряженных групп субстрата и активного центра фермента. Точное соответствие обеспечивает образование эффективного комплекса между субстратом и ферментом. Таким образом, в механизме ферментативного катализа ведущую роль играют промежуточные фермент-субстратные комплексы, образование которых определяется как тонкой трехмерной структурой активного центра, так и уникальной структурной организацией всей молекулы фермента, обеспечивающими высокую каталитическую активность и специфичность действия биокатализатора.
12.В основе многих заболеваний лежат нарушения функционирования ферментов в клетке - энзимопатии. Различают первичные (наследственные) и вторичные (приобретённые) энзимопатии. Первичные энзимопатии связаны с генетически обусловленной недостаточностью одного или нескольких ферментов. При этом дефектные ферменты наследуются, в основном, по аутосомно-рецессивному типу. Гетерозиготы, как правило, не имеют фенотипических отклонений. Первичные энзимопатии относят к метаболическим болезням, так как происходят нарушения определенных метаболических путей. При этом развитие заболевания может протекать по одному из трех ниже перечисленных вариантов. ^ Нарушение образования конечных продуктов. Недостаток конечного продукта определенного метаболического пути (при отсутствии других альтернативных путей синтеза) может приводить к развитию клинических симптомов, характерных для данного заболевания. В качестве примера можно рассмотреть альбинизм. При альбинизме нарушен синтез в меланоцитах пигментов-меланинов. Меланин содержится в коже, волосах, радужке, пигментном эпителии сетчатки глаза и определяет их окраску. При альбинизме наблюдается слабая пигментация кожи, волос, красноватый цвет радужки глаза из-за просвечивающихся капилляров. Возникновение альбинизма связано с недостаточностью фермента тирозиназы (тирозингидроксилазы) – одного из ферментов, участвующих в синтезе меланинов. ^ Накопление субстратов – предшественников. При недостаточности определенного фермента (Ех) будут накапливаться метаболиты, а также во многих случаях и предшествующие соединения, которые в цепи метаболических превращений образуются до уровня расположения поврежденного энзима Ех. Увеличение концентрации субстратов – предшественников дефектного фермента является ведущим звеном развития данных заболеваний. В качестве примера можно привести алкаптонурию. При этом заболевании нарушено окисление в тканях гомогентизиновой кислоты – промежуточного метаболита катаболизма тирозина. У таких больных наблюдается недостаточность фермента диоксигеназы гомогентизиновой кислоты. В результате этого увеличивается концентрация гомогентизиновой кислоты и её выведение с мочой. В присутствии кислорода гомогентизиновая кислота превращается в соединение черного цвета - алкаптон. Поэтому моча таких больных на воздухе окрашивается в черный цвет. Алкаптон образуется также в биологических жидкостях, накапливаясь в тканях, коже, сухожилиях, суставах. При значительных отложениях алкаптона в суставах нарушается их подвижность. ^ Нарушение образования конечных продуктов и накопление субстратов- предшественников. Отмечают заболевания, когда одновременно недостаток продукта и накопление исходного субстрата формируют клиническую картину. Их примером является болезнь Гирке (гликогеноз I типа), при которой наблюдается гипогликемия в перерывах между приемами пищи. Это связано с нарушением распада гликогена в печени и выходом из нее глюкозы вследствие дефекта фермента глюкозо-6-фосфатазы. Одновременно у таких пациентов увеличиваются размеры печени (гепатомегалия) вследствие накопления в ней гликогена.
К первичным энзимопатиям относится также заболевание фенилкетонурия. Эта болезнь характеризуется дефицитом печеночного фермента фенилаланин гидроксилазы (другое название которого фенилаланин-4-монооксигеназы). Этот фермент катализирует превращение аминокислоты фенилаланина ('Phe) на тирозин. При дефиците фенилаланин гидроксилазы, фенилаланин не расщепляется, а накапливается и превращается в фенилпировиноградную кислоту, которая, при этом заболевании обнаруживается в моче.
Гипераммониемия, обусловленная дефицитом N-ацетилглутаматсинтетазы — наследственное заболевание, связанное с дефектом указанного фермента и проявляющееся высоким содержанием ионов аммония в крови. Дефицит N-ацетилглутаматсинтетазы ведёт к недостаточности утилизации аммиака в форме карбамоилфосфата и нарушению образования мочевины. В патогенезе заболевания основную роль играет гипераммониемия. Избыток аммиака оказывает токсическое действие на ткани, в первую очередь головного мозга, миокарда и печени, а также ингибирует активность ряда ферментов, в частности ферментов глюконеогенеза.
Вторичные энзимопатии
Вторичные энзимопатии являются следствием тех или иных патологических процессов, сопровождающихся нарушением активности ферментов. Они наблюдаются при многих заболеваниях. Так например, причиной развития вторичной лактазной недостаточности могут являться: кишечные инфекции вирусной и бактериальной этиологии, паразитарные заболевания (лямблиоз и др.), синдром короткой кишки (пострезекционный), целиакия, токсическое и лекарственное поражения кишечника (на фоне лучевой и химиотерапии, антибиотикотерапии). Одним из вариантов вторичных энзимопатий являются алиментарные энзимопатии – патологические состояния, обусловленные стойкими нарушениями активности ферментов в связи с характером питания. Алиментарные энзимопатии могут быть обусловлены длительным дефицитом белка в питании (например при квашиоркоре), нарушением биосинтеза коферментов при витаминной недостаточности, угнетением синтеза металлоферментов при низком содержании в рационе соответствующих минеральных веществ. Кроме того, они могут возникать при несбалансированном питании в целом. К развитию алиментарных энзимопатий может приводить также нарушение поступления пищевых веществ из желудочно-кишечного тракта в кровь при длительных поносах, атрофии или поражении слизистой оболочки кишечника и др. К алиментарным энзимопатиям относят и так называемые токсические энзимопатии, связанные с угнетением активности или биосинтеза отдельных ферментов различными естественными компонентами пищевых продуктов (ингибиторы протеолитических ферментов, антивитамины и др.) или чужеродными веществами (например пестицидами), содержащимися в них. Клинические проявления приобретенных энзимопатий зависят от вида фермента, функция которого нарушена и характеризуется нарушениями того или иного вида обмена веществ. ^
Энзимопатии углеводного обмена
Галактоземия – возникает при нарушении обмена галактозы, обусловленном наследственным дефектом одного из трех ферментов, включающим галактозу в метаболизм глюкозы. Галактоземия, вызванная недостаточностью галактозо-1-фосфатуридилилтрансферазы (ГАЛТ) наиболее хорошо изучена. Это заболевание проявляется очень рано и особенно опасно для детей, так как основным источником углеводов для них служит материнское молоко, содержащее лактозу. Ранние симптомы дефекта ГАЛТ: рвота, диарея, дегидратация, уменьшение массы тела, желтуха, гепатомегалия, катаракта, задержка психического развития. Лабораторные исследования при этом выявляют галактоземию, галактозурию, галактозо-1-фосфатемию, тенденцию к гипогликемии. При дефекте фермента галактокиназы у пациентов отмечается галактоземия, галактозурия, катаракта. Гораздо реже причиной возникновения галактоземии является дефект уридилфосфат-4-эпимеразы, при котором не отмечается тяжелых клинических проявлений. При диагностике галактоземии исследуют мочу на содержание галактозы, собранную после нескольких кормлений молоком. При обнаружении у ребенка катаракты его обследуют на недостаточность галактокиназы и ГАЛТ. ^ Недостаточность дисахаридаз. Дисахаридазы локализованы в щеточной каемке клеток слизистой тонкого кишечника и участвуют в расщеплении дисахаридов на моносахариды, что является необходимым условияем их всасывания. Дисахаридазы подразделяются на α-гликозидазы (изомальтаза, сахараза, мальтаза) и β-гликозидазы (лактаза, β-галактозидаза). К этой группе нарушений относится отсутствие активности сахаразы и изомальтазы. Дисахариды не расщепляются и не могут быть утилизированы. Они осмотически активны, связывают воду в просвете кишечника и вызывают диарею после пероральной нагрузки дисахаридами. Кроме того, после такой нагрузки в крови не удается обнаружить повышение гликемии в интервале 30-90 минут, как это отмечается у здоровых людей. Непереносимость лактозы обусловлена дефектом лактазы и проявляется также, как и вышеперечисленные состояния. ^ Нарушения метаболизма мукополисахаридов (гликозаминогликанов). Важнейшей составной частью соединительной ткани являются протеогликаны, состоящие из агрегированных мономерных субъединиц, содержащих центрально расположенное «белковое ядро», с которым связаны гликозидные цепи различных гликозаминогликанов (ГАГ). Количество и соотношение различных протеогликанов зависит от типа соединительной ткани. Они образуются в специальных клетках этой ткани – фибробластах, в лизосомах этих же клеток они после эндоцитоза разрушаются. Функции ГАГ – поддержание структурной целостности соединительной ткани и организация межклеточного матрикса. ГАГ взаимодействуют с компонентами клеточных мембран в таких процессах, как рост клеток, межклеточные коммуникации, восприятие информации, взаимодействие некоторых плазменных белков с сосудистой стенкой. Разрушение ГАГ начинается с терминального моносахарида под влиянием специфических гликозидаз. Если какие-либо из этих лизосомальных ферментов отсутствуют или их активность нарушена в соединительной ткани начинается накопление неразрушенных или частично разрушенных ГАГ. Это приводит к возникновению ряда заболеваний, объединенных общим названием мукополисахаридозы. Мукополисахаридозы отличаются прогрессирующим течением с различной степенью тяжести. Общие признаки различных форм этих заболеваний: деформация черт лица, изменение скелета, деформация суставов, поражение печени, селезенки, сердца, кровеносных сосудов. Характерна также задержка психомоторного и умственного развития. Ниже приводится характеристика некоторых форм мукополисахаридозов. Синдром Гурлера – обусловлен дефицитом α-L-идуронидазы. Протекает тяжело – больные умирают в возрасте до 10 лет. У детей отмечается деформация позвоночника, суставов, отставание в росте, комбинированная проводниковая и нейросенсорная глухота, гепатоспленомегалия. С мочой экскретируются гепаран- и дерматан-сульфаты. ^ Синдром Моркио – вызван дефектом галактозо-6-сульфатазы, которая расщепляет связь, имеющуюся только в кератансульфате. Это ведет к накоплению последнего в составе хрящей межпозвоночных дисков и роговицы, что и определяет клинику заболевания. Поражается преимущественно скелет – выступают нижние ребра, наступает х-образное искривление ног, характерно выпирание грудины и очень короткая шея. С мочой выделяется кератансульфат. ^ Дефицит глюкуронидазы – дефект, проявляющийся огрублением черт лица, гепатоспленомегалией, изменениями скелета. Лабораторно выявляется: наличие дерматан- и гепаран-сульфатов в моче, метахроматические гранулы в гранулоцитах периферической крови, снижение активности фермента в лейкоцитах и сыворотке крови.
