- •1. Предмет органической химии
- •Классификация ферментов. Роль ферментов в жизнедеятельности микроорганизмов.
- •20. Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
- •2.Характеристика пептидной связи
- •1. Действие аммиака на соли галоидзамещенных кислот
- •21. Классификация органических соединений
- •22. Природные источники
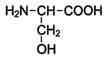
20. Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
Строение аминокислот.
В каждой молекуле аминокислоты присутствует атом углерода, связанный с четырьмя заместителями. Один из них — атом водорода, второй — карбоксильная группа — СООН. От карбоксильной группы легко отделяется ион водорода Н+, благодаря чему в названии аминокислот и присутствует слово «кислота». Третий заместитель — аминогруппа — NH2. Четвертый элемент аминокислоты — группа атомов, которую в общем случае обозначают R. У всех аминокислот R-группы разные, и каждая из них играет свою, очень важную роль. R-группа также называется боковая цепь.
Общую формулу аминокислоты в нейтральной среде (ph=7) можно записать как NH2+CHRCOO–
Что же касается группы — СООН, то химики-органики относятся к ней с большим почтением: всем другим атомам углерода в молекуле даются обозначения в зависимости от степени их удалённости от карбоксильной группы. Ближайший к ней атом именуют альфа-атомом, второй — бета-атомом, и т.д. Атом углерода в аминокислотах, который находится ближе всех к карбоксильной группе, т. е. альфа-атом, связан также с аминогруппой, поэтому природные аминокислоты, входящие в состав белка, называют альфа-аминокислотами.
В природе встречаются также аминокислоты, в которых NH2-группа связана с более отдалёнными от карбоксильной группы атомами углерода. Однако для построения белков природа выбрала именно альфа-аминокислоты. Это обусловлено прежде всего тем, что только альфа-аминокислоты, соединённые в длинные цепи, способны обеспечить достаточную прочность и устойчивость структуры больших белковых молекул.
Число альфа-аминокислот, различающихся R-группой, велико. Но чаще других в белках встречается всего 20 разных аминокислот. Их можно рассматривать как алфавит «языка» белковой молекулы. Химики называют эти главные аминокислоты стандартными, основными или нормальными. Условно основные аминокислоты делят на четыре класса.
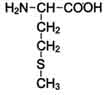
Первый класс аминокислот - аминокислоты с неполярными боковыми цепями.
Второй — аминокислоты, содержащие полярную группу.
Следующие два класса составляют аминокислоты с боковыми цепями, которые могут заряжаться положительно (они объединяются в третий класс) или отрицательно (четвёртый). Например, диссоциация карбоксильной группы даёт анион — СОО-, а протонирование атома азота — катион, например —NH3+. Боковые цепи аспарагиновой и глютаминовой кислот имеют ещё по одной карбоксильной группе —СООН, которая при значениях рН, характерных для живой клетки (рН = 7), расстаётся с ионом водорода (Н+) и приобретает отрицательный заряд. Боковые цепи аминокислот лизина, аргинина и гистидина заряжены положительно, поскольку у них есть атомы азота, которые, наоборот, могут ион водорода присоединять.
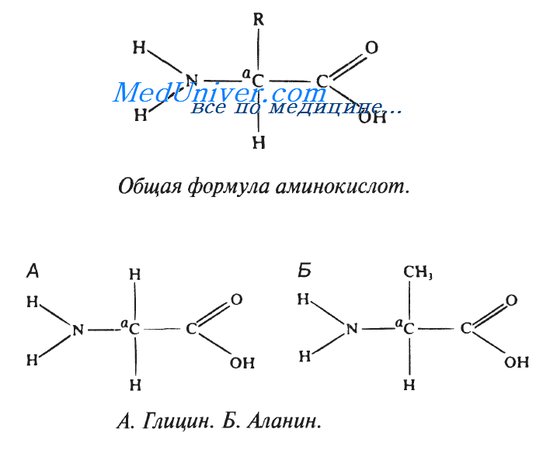
В организме человека найдено около 70 а.к., 20 из них входят в состав белков. К а.к используют как систематическую номенклатуру так и тривиальные названия.
Классификация аминокислот по химическому строению радикалов
По химическому строению аминокислоты можно разделить на алифатические, ароматические и гетероциклические .
В составе алифатических
радикалов могут находиться функциональные
группы, придающие им специфические
свойства: карбоксильная (-СООН), амино
(-NH2), тиольная (-SH), амидная
(-CO-NH2), гидроксильная (-ОН)
и гуанидиновая
![]() группы.
группы.
Названия аминокислот можно построить по заместительной номенклатуре, но обычно используют тривиальные названия
Таблица 1-1. Классификация основных аминокислот белков по их химическому строению
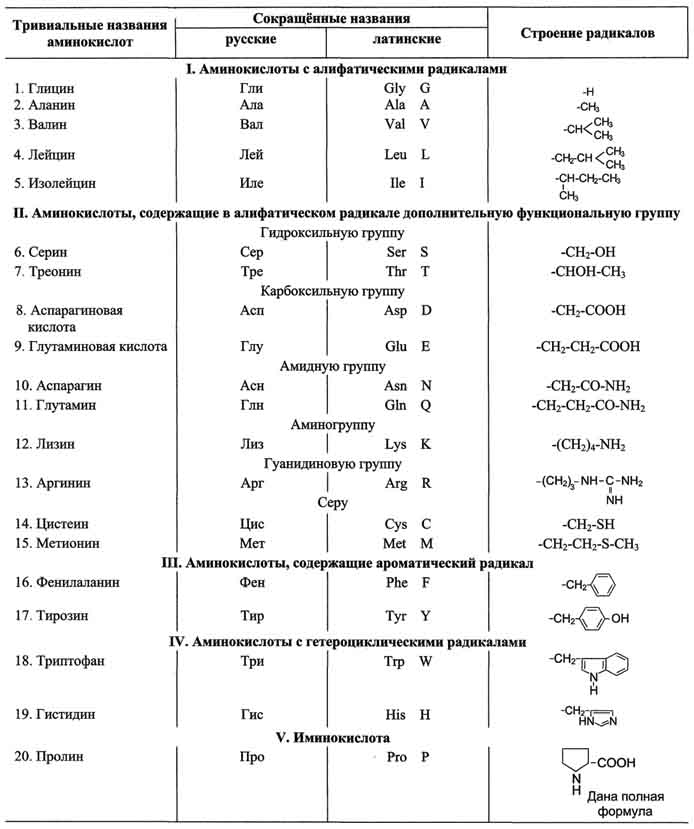
Таблица 1-2. Примеры названий аминокислот по заместительной номенклатуре и соответствующие тривиальные названия
Название аминокислоты по заместительной номенклатуре |
Формула аминокислоты |
Тривиальное название |
2-амино-З-гидроксипропановая кислота |
|
Серии |
2-амино-4-метилтиомасляная кислота |
|
Метионин |
Для записи аминокислотных остатков в молекулах пептидов и белков используют трёхбуквенные сокращения их тривиальных названий, а в некоторых случаях и однобуквенные символы (см. табл. 1-1).
Тривиальные названия часто происходят от названия источника, из которого они впервые были выделены, или от свойств данной аминокислоты. Так, серии впервые был выделен из фиброина шёлка (от лат. serieum - шелковистый), а глицин получил свое название из-за сладкого вкуса (от греч. glykos - сладкий).
Разделение аминокислот на заменимые и незаменимые.
Разделение аминокислот на заменимые и незаменимые производится по их возможности синтезироваться в организме. Для разных организмов список заменимых/незаменимых аминокислот различен. Ниже приведено разделение аминокислот характерное для человека.
Незаменимые аминокислоты. изолейцин; лейцин; лизин; метионин; фенлаланин; треонин; триптофан; валин.
Незаменимые аминокислоты не могут синтезированы, в организме человека, из других аминокислот. Эти аминокислоты обязательно должны поступать с пищей.
Условнонезаменимые аминокислоты. аргинин; гистидин; цистин; тирозин.
Условно-незаменимые аминокислоты синтезируются или нет в организме при определенных условиях. Например, синтезирование аргинина в организме после 30 лет значительно снижается.
Заменимые аминокислоты. аланин аспарагин аспарагиновая кислота глютамин глютаминовая кислота глицин.
Заменимые аминокислоты могут синтезироваться в организме (из других аминокислот, в реакциях переаминирования)
Физические свойства По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления. Эти свойства отчётливо указывают на солеобразный характер этих соединений. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной. α-Аминокислоты являются амфотерными электролитами.
Общие химические свойства
Все аминокислоты амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей.
NH2 —CH2COOH
![]() N+H3 —CH2COO-
N+H3 —CH2COO-
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
HOOC —CH2 —NH —H + HOOC —CH2 —NH2 → HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
ПЕПТИДЫ, природные или синтетич. соед., молекулы к-рых построены из остатков a-аминокислот, соединенных между собой пептидными (амидными) связями C(O) NH. Могут содержать в молекуле также неаминокислотную компоненту (напр., остаток углевода). По числу аминокислотных остатков, входящих в молекулы пептидов, различают ди-пептиды, трипептиды, тетрапептиды и т.д. Пептиды, содержащие до 10 аминокислотных остатков, наз. олигопептидами, содержащие более 10 аминокислотных остатков полипепти-дами Прир полипептиды с мол. м. более 6 тыс. наз. белками.
Мономеры аминокислот, входящих в состав белков, называют "аминокислотные остатки". Аминокислотный остаток, имеющий свободную аминогруппу, называется N-концевым и пишется слева, а имеющий свободную ?-карбоксильную группу - С-концевым и пишется справа. Пептиды пишутся и читаются с N-конца. Цепь повторяющихся атомов в полипептидной цепи -NH-CH-CO-носит название "пептидный остов" (см. схему Б).
При названии полипептида к сокращённому названию аминокислотных остатков добавляют суффикс -ил, за исключением С-концевой аминокислоты. Например, тетрапептид Сер-Гли-Про-Ала читается как серилглицилпролилаланин.
Пептидная связь, образуемая иминогруппой пролина, отличается от других пептидных связей, так как атом азота пептидной группы связан не с водородом, а с радикалом.
Пептиды различаются по аминокислотному составу, количеству и порядку соединения аминокислот.

Серилглицилпролилаланин

Схема А. Образование дипептида