- •Система отсчета. Траектория материальной точки. Скорость, как производная радиус-вектора по времени.
- •Угловая скорость и угловое ускорение, их связь с линейными величинами.
- •Закон инерции. Инерциальная система отсчета. Масса, сила, второй закон Ньютона.
- •Третий закон Ньютона. Механическая система. Внешние и внутренние силы.
- •Импульс материальной точки и системы материальных точек. Закон сохранения импульса.
- •Энергия, как мера различных форм движения и взаимодействия материи. Работа силы и ее выражение через криволинейный интеграл.
- •Кинетическая энергия материальной точки и системы материальных точек и ее связь с работой внешних сил.
- •Поле, как форма материи, осуществляющая силовые взаимодействия. Консервативные и неконсервативные силы.
- •Потенциальная энергия материальной точки во внешнем силовом поле и ее связь с силой. Понятие о градиенте скалярной функции.
- •Закон сохранения механической энергии.
- •Удар абсолютно упругих тел.
- •Удар абсолютно неупругих тел.
- •Момент инерции материальной точки и твердого тела. Теорема Штейнера. Кинетическая энергия вращения.
- •Момент силы. Уравнение динамики вращательного движения твёрдого тела.
- •Момент импульса твердого тела. Закон сохранения момента импульса.
- •Инерциальные системы отсчета. Преобразования Галилея. Механический принцип относительности.
- •Гармонические колебания и их характеристики. Дифференциальное уравнение гармонических колебаний.
- •Пружинный, физический и математический маятники.
- •Энергия гармонических колебаний.
- •Сложение гармонических колебаний с одинаковой амплитудой и близкими частотами (биения).
- •Волны в упругой среде. Поперечные и продольные волны. Уравнение бегущей волны.
- •Образование стоячих волн. Уравнение стоячей волны.
- •Законы идеального газа. Уравнение Клапейрона-Менделеева.
- •Основное уравнение молекулярно-кинетической теории идеальных газов.
- •Барометрическая формула. Закон Больцмана для распределения частиц во внешнем потенциальном поле.
- •Явление переноса. Опытные законы диффузии, теплопроводности и внутреннего трения.
- •Внутренняя энергия системы. Число степеней свободы молекулы. Законы равномерного распределения энергии по степеням свободы молекул.
- •Первое начало термодинамики. Работа газа при изменении его объема.
- •Теплоемкость. Уравнение Майера.
- •Применение первого начала термодинамики к изопроцессам.
- •Адиабатический процесс.
- •Круговой процесс или цикл. Обратимые и необратимые процессы.
- •Тепловые двигатели и холодильные машины. Второе начало термодинамики.
- •Цикл Карно и его кпд для идеального газа.
- •Силы и потенциальная энергия межмолекулярного взаимодействия. Особенности жидкого и твердого состояния.
- •Агрегатное и фазовое состояние вещества. Фазовые переходы I и II рода.
- •Отступление от законов идеального газа. Реальные газы. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса. Внутренняя энергия реального газа.
- •Электрический заряд. Электростатическое поле. Закон Кулона.
- •Напряженность электростатического поля. Силовые линии электростатического поля. Принцип суперпозиции электростатического поля.
- •Поток вектора напряженности. Теорема Остроградского-Гаусса для электростатического поля в вакууме и ее применение к расчету полей.
- •Равномерно заряженная бесконечная плоскость
- •Бесконечная равномерно заряженная нить
- •Работа электростатического поля по перемещению в нем заряда. Циркуляция вектора напряженности электростатического поля.
- •Потенциал электростатического поля.
- •Связь напряженности и потенциала электростатического поля. Эквипотенциальные поверхности.
- •Типы диэлектриков. Поляризация диэлектриков.
- •Поляризация диэлектриков
- •Вектор поляризации. Напряженность поля в диэлектрике.
- •Вектор электрического смещения. Теорема Остроградского-Гаусса для электростатического поля в диэлектриках.
- •Проводники в электростатическом поле. Распределение зарядов в проводниках. Поле внутри проводника и на его поверхности.
- •Напряженность электрического поля внутри проводника должна быть равной нулю:
- •Электроемкость уединенного проводника и конденсатора. Конденсаторы. Электроемкость плоского конденсатора. Соединения конденсаторов.
- •Энергия системы неподвижных точечных зарядов, заряженного проводника, конденсатора. Энергия электростатического поля. Объемная плотность энергии.
Отступление от законов идеального газа. Реальные газы. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса. Внутренняя энергия реального газа.
Модель идеального газа, используемая в молекулярно-кинетической теории газов, позволяющая описывать поведение разрежённых реальных газов при достаточно высоких температурах и низких давлениях. При выводе уравнения состояния идеального газа размерами молекул и их взаимодействием друг с другом пренебрегают. Повышение давления приводит к уменьшению среднего расстояния между молекулами, поэтому необходимо учитывать объём молекул и взаимодействие между ними. При высоких давлениях и низких температурах указанная модель идеального газа непригодна.
При рассмотрении реальных газов – газов, свойства которых зависят от взаимодействия молекул, надо учитывать силы межмолекулярного взаимодействия. Они проявляются на расстояниях ≤10-9 м. и быстро убывают при увеличении расстояния между молекулами. Такие силы называются короткодействующими.
В ХХ в., по мере развития и представлений о строении атома и квантовой механики, было выяснено, что между молекулами вещества одновременно действуют силы притяжения и силы отталкивания. Силы отталкивания считаются положительными, а силы взаимного притяжения – отрицательными.
Уравнение Ван-дер-Ваальса для моля газа (уравнение состояния реальных газов):
![]()
Для произвольного количества вещества v газа (v=m/M) с учетом того, что V=vVm, уравнение Ван-дер-Ваальса примет вид
![]()
где поправки а и b — постоянные для каждого газа величины, определяемые опытным путем (записываются уравнения Ван-дер-Ваальса для двух известных из опыта состояний газа и решаются относительно а и b).
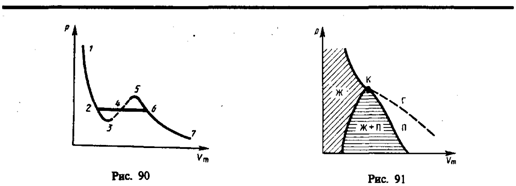
Изотермы Ван-дер-Ваальса — кривые зависимости р от Vm при заданных Т, определяемые уравнением Ван-дер-Ваальса для моля газа. Эти кривые имеют довольно своеобразный характер. При высоких температурах (T > Tк) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре Tк на изотерме имеется лишь одна точка перегиба К.
|
Эта изотерма называется критической, соответствующая ей температура Tк — критической температурой; точка перегиба К называется критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем Vк, и давление рк называются также критическими. Состояние с критическими параметрами (pк, Vк, Tк) называетсякритическим состоянием. При низких температурах (Т < Tк ) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь. |
Рассматривая различные участки изотермы при T<Тк, видим, что на участках 1—3 и 5—7 при уменьшении объема Vm давление р возрастает, что естественно. На участке 3—5 сжатие вещества приводит к уменьшению давления; практика же показывает, что такие состояния в природе не осуществляются. Наличие участка 3—5 означает, что при постепенном изменении объема вещество не может оставаться все время в виде однородной среды; в некоторый момент должно наступить скачкообразное изменение состояния и распад вещества на две фазы. Таким образом, истинная изотерма будет иметь вид ломаной линии 7—6—2—1. Часть 6–7 отвечает газообразному состоянию, а часть 2–1 — жидкому. В состояниях, соответствующих горизонтальному участку изотермы 6—2, наблюдается равновесие жидкой и газообразной фаз вещества. Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
внутренняя энергия 1 моль реального газа,
![]()
внутренняя энергия v моль определяется по формуле

Внутренняя энергия реального газа зависит как от температуры, так от объема.