
Глава 32 Семейство Togaviridae
§ 1. Характеристика семейства.
Название семейства происходит от латинских слов toga – плащ и virus – вирус, поскольку все представители семейства имеют суперкапсид. Семейство включает 27 видов вирусов, патогенных для животных и человека.
Классификация. Семейство Togaviridae состоит из 2 родов: Alphavirus и Rubivirus. Род Alphavirus объединяет 26 видов вирусов, патогенных для животных и человека и передаваемых насекомыми. Род Rubivirus включает 1 вид вируса – вирус краснухи, патогенный только для человека.
С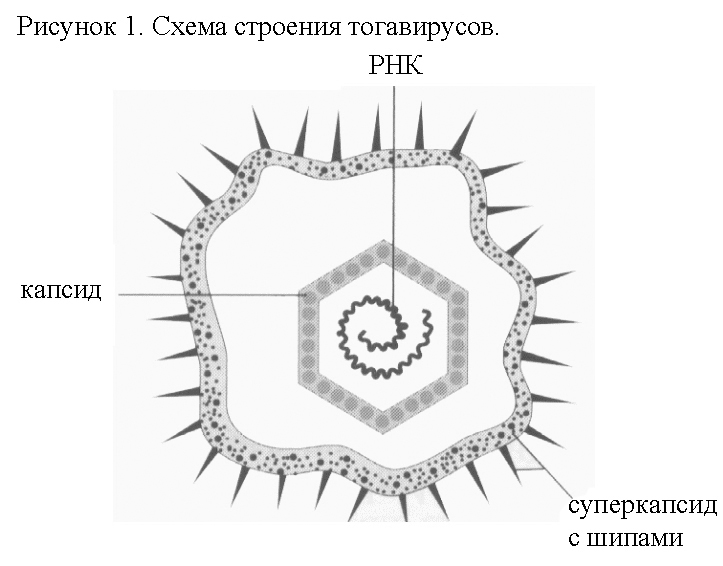 троение
вириона тогавирусов.
Вирионы сферической формы, диаметром
60-125 нм (рис. 1). Суперкапсид двухслойный,
липидный, имеет шипы. В суперкапсиде
присутствуют 2 типа гликопротеинов –
Е1 и Е2. Гликопротеин Е1 обладает антигенными
и агглютинирующими свойствами. Капсид
икосаэдрического типа симметрии,
диаметром от 30 до 40 нм, состоит из С-белка.
Геном представлен однониточной линейной
несегментированной «+»-РНК длиной
9-12*103
нуклеотидов. РНК имеет 2 неперекрывающиеся
рамки считывания, кодирующие 3 структурных
(Е1, Е2, С) и 4 неструктурных (Р1-4) белка.
троение
вириона тогавирусов.
Вирионы сферической формы, диаметром
60-125 нм (рис. 1). Суперкапсид двухслойный,
липидный, имеет шипы. В суперкапсиде
присутствуют 2 типа гликопротеинов –
Е1 и Е2. Гликопротеин Е1 обладает антигенными
и агглютинирующими свойствами. Капсид
икосаэдрического типа симметрии,
диаметром от 30 до 40 нм, состоит из С-белка.
Геном представлен однониточной линейной
несегментированной «+»-РНК длиной
9-12*103
нуклеотидов. РНК имеет 2 неперекрывающиеся
рамки считывания, кодирующие 3 структурных
(Е1, Е2, С) и 4 неструктурных (Р1-4) белка.
Репродукция тогавирусов. Вирионы проникают в чувствительные клетки путем рецепторного эндоцитоза. Дезинтеграция вириона происходит в клеточной эндосоме, откуда вирусная РНК выходит в цитозоль. Репродукция тогавирусов происходит в цитоплазме клетки. На ранней стадии репродукции осуществляется частичная транскрипция и трансляция геномной РНК, продуктом которой является полипротеин, состоящий из 4 неструктурных белков (Р1-4). После их протеолитического расщепления образуется РНК-зависимая РНК-полимераза, которая инициирует репликацию геномной вирусной РНК. Репликация тогавирусов включает образование на матрице «+»-РНК полноразмерной копии «-»-РНК. Последняя, в свою очередь, служит матрицей для образования геномных «+»-РНК. На матрице полноразмерных «-»-РНК синтезируются короткие «+»-РНК, транслирующиеся в большой полипротеид, подвергающийся последовательному расщеплению и процессингу. Малые «+»-РНК кодируют белки суперкапсида и капсида. Белки суперкапсида гликозилируются, расщепляются и встраиваются в клеточную мембрану. Сборка зрелого вириона происходит в цитоплазме путем присоединения капсидных белков к геномной РНК. Образовавшиеся нуклеокапсиды фиксируются к Е1- и Е2-гликопротеинам, локализованным в цитоплазматической мембране клетки. Нуклеокапсиды тогавирусов выходят из клетки путем почкования, при этом липидный бислой, содержащий гликопротеины Е1 и Е2, образует суперкапсид вирионов.
§ 2. Род Rubivirus.
Название рода происходит от латинского слова rubrum – красный, что связано с названием заболевания – краснуха – которое вызывают рубивирусы. Единственным членом рода является вирус краснухи. Особенность репродукции рубивируса состоит в том, что неструктурная протеаза расщепляет неструктурный ранний полипротеид на 4 белка.
Вирус краснухи
История открытия. Вирус краснухи был впервые изолирован в 1938 г. Хиро и Тасакой и получен в культуре тканей в 1962 г. Веллером, Невой и Паркманом. Способность вирусов краснухи вызывать эмбриопатии была установлена в 1941 г. австралийским окулистом Н. Греггом.
Особенности вирусов. Вирион сферической формы, диаметром 60-70 нм, имеет суперкапсид с 2 типами гликопротеинов – Е1 и Е2, образующих шипы. Е1 содержит гемагглютинин и рецепторный участок, является иммунодоминантным антигеном. Капсид с недоказанным икосаэдрическим типом симметрии, диаметром 30 нм, состоит из С-белка. Геном состоит из однониточной линейной несегментированной «+»-РНК длиной 9,7-9,75*103 нуклеотидов. Содержание Г+Ц в РНК наибольшее среди всех РНК-вирусов. РНК содержит 2 длинных неперекрывающихся рамки считывания. Геном стабилен, уровень мутаций – 0,1 % в год.
Антигенная структура. Вирус краснухи имеет 3 антигена: Е1, Е2 и С, которые составляют 1 серовар. Вирус антигенно отличается от альфавирусов и не имеет существенной гомологии на нуклеотидном или аминокислотном уровнях.
Резистентность. Стабилен при физиологических значениях рН (5,8-8,1), не погибает при замораживании и оттаивании (при -20˚С и ниже сохраняется годами), при действии ультразвука. Чувствителен к трипсину и жирорастворителям. При 56˚С время полужизни – 5-20 минут, при 37˚С – 1-2 ч, при 4˚С – более недели.
Культивирование. К вирусу краснухи чувствительны многие лабораторные животные, в том числе приматы. Вирусы культивируются в большом количестве клеточных культур без ЦПД. «Золотым стандартом» для первичной изоляции вируса из клинических образцов является первичная культура клеток почек зеленой африканской мартышки.
Эпидемиология. Единственным резервуаром вирусов краснухи и источником инфекции является больной человек и вирусоноситель. Механизм передачи инфекции – аэрогенный, реализуемый воздушно-капельным и реже – воздушно-пылевым путями. Вирусы краснухи эндемичны в зонах с умеренным климатом. Сезонность весенняя. До использования вакцинации эпидемии краснухи случались с 5-9-летним интервалом.
Патогенез. Клеточные рецепторы для вируса краснухи неизвестны. Вирус проникает в клетку путем рецепторного эндоцитоза. Время проникновения удлинено, составляет 8 ч. При слиянии суперкапсида с везикулой эндосомы капсид высвобождается в цитоплазму клетки. Механизм выхода РНК из капсида неизвестен. Транскрипция и трансляция вируса краснухи происходит в цитоплазме. Вирионы выходят из клетки через комплекс Гольджи.
Вирусы краснухи инфицируют эпителий слизистой оболочки полости рта (преимущественно клетки щек). Затем происходит колонизация эпителия верхних дыхательных путей и носоглоточной лимфоидной ткани, которая служит входными воротами вирусов в организм. Вирусы лимфогенно попадают в лимфатические узлы, где идет их дальнейшая репродукция. После инкубационного периода в 7-9 дней вирус проникает в кровь. Места вторичной репликации вирусов неизвестны, однако имеет место инфицирование мононуклеаров. Вирусемия заканчивается при появлении в крови специфических антител и сыпи на теле больного (2-3 недели после инфицирования). При повторной вирусемии вирусы краснухи попадают в носоглотку, откуда они выделяются с аэрозолем в окружающую среду. Больные наиболее заразны в периоде высыпания. Вирусы обычно исчезают из носоглоточных выделений в течение 4 дней после появления сыпи. Имеет место реинфицирование вирусами краснухи, что более часто встречается у вакцинированных людей, чем у переболевших, из-за более низкого уровня антител. Реинфекция обычно протекает без вирусемии и клинических проявлений болезни. При реинфекции беременных женщин вирусы даже при наличии к ним иммунитета могут проникать через плаценту в плод, у которого могут поражать любой орган. Тяжелые поражения плода наступают преимущественно в первом триместре беременности.
Клиника. Инкубационный период длится 11-22 дня. В 50 % случаев заболевание клинически не проявляется. У остальных инфицированных развивается умеренная лихорадка, лимфаденопатия, макуло-папулезная сыпь, конъюнктивит, ангина, артралгии. Сыпь появляется в конце инкубационного периода. Высыпание этапное: в первый день сыпи – на лице, во второй день – на туловище и верхних конечностях, в третий день – на нижних конечностях. Элементы сыпи преимущественно локализованы на наружных поверхностях конечностей. Характерным является увеличение заднешейных и подзатылочных лимфатических узлов. Заболевание длится несколько дней. Осложнения – тромбоцитопения, постинфекционный энцефалит; у женщин – острая полиартралгия и артрит (поражение суставов длится от 1 до нескольких недель, может переходить в хронический артрит).
Врожденная краснушная инфекция проявляется тромбоцитопенической пурпурой, врожденными пороками сердца (стеноз клапанов), задержкой внутриутробного роста и психомоторного развития, катарактой, глаукомой, ретинопатией, потерей слуха (80 % детей), гепато- и (или) спленомегалией. Реже встречаются аденопатия, дефекты костей, гепатиты и гемолитическая анемия. В отдаленном будущем у лиц с врожденной краснухой развиваются сахарный диабет (40 % случаев), патология щитовидной железы и краснушный панэнцефалит.
Иммунитет стойкий, пожизненный, обусловленный гуморальными и клеточными факторами. Установлено, что титр антител в РТГА выше 1:32 ведет к развитию эмбриопатий (диагр. 1).
Л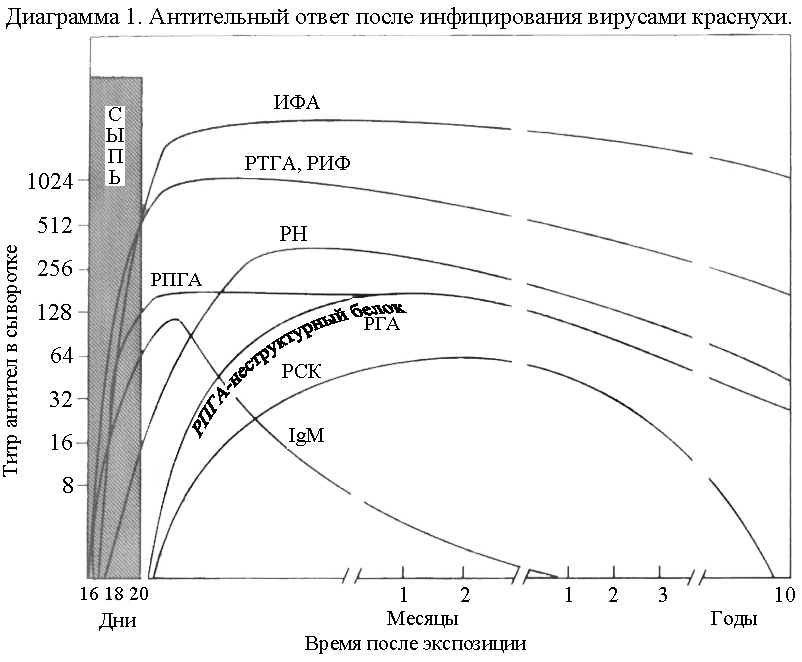 абораторная
диагностика. Материалом
для исследования являются: мазки из
зева и полости носа, смыв с носовой части
глотки, отделяемое конъюнктивы, моча,
кровь, спинномозговая жидкость, ткани
плода, хрусталик глаза. При диагностике
краснухи используются вирусоскопический,
вирусологический, серологический и
молекулярно-генетический методы.
Экспресс-диагностика краснухи проводится
в реакции агглютинации с латексом, в
ИФА и РИФ с использованием люминесцентной
микроскопии.
абораторная
диагностика. Материалом
для исследования являются: мазки из
зева и полости носа, смыв с носовой части
глотки, отделяемое конъюнктивы, моча,
кровь, спинномозговая жидкость, ткани
плода, хрусталик глаза. При диагностике
краснухи используются вирусоскопический,
вирусологический, серологический и
молекулярно-генетический методы.
Экспресс-диагностика краснухи проводится
в реакции агглютинации с латексом, в
ИФА и РИФ с использованием люминесцентной
микроскопии.
Вирусологический метод включает выделение вируса в первичных (клетки почек зеленых мартышек, эмбрионов кролика и др.) и в перевиваемых (Vero, ВНК и др.) культурах клеток с последующей индикацией вирусов по ЦПД и интерференции с вирусами ЕСНО-11. ЦПД развивается медленно (до 21 дня) и характеризуется повышением светопреломления пораженных клеток, их округлением и отделением от базального слоя. Суть индикации вирусов краснухи методом интерференции состоит в том, что пораженные вирусами краснухи клетки не заражаются другими вирусами, например, ЕСНО-11, вирусами везикулярного стоматита и др., тогда как в контроле данные вирусы ЦПД на клетки культуры оказывают. Индикация вирусов краснухи проводится в РТГА, РН и РИФ.
В связи с трудоемкостью вирусологического метода для диагностики краснухи используют преимущественно серологический метод исследования. Выявление антител к антигенам вирусов краснухи в сыворотке крови проводят в РТГА, РН, РСК, ИФА. Вируснейтрализующие и гемагглютинирующие антитела появляются через 4-7 дней от момента высыпания, комплементсвязывающие антитела – через 14-20 дней. Для диагностики у детей врожденной краснухи используют ИФА, РН, РТГА, РИФ, реже – РСК (диагр. 2).
За рубежом для диагностики краснухи широко используется молекулярно-генетический метод – ПЦР.
Л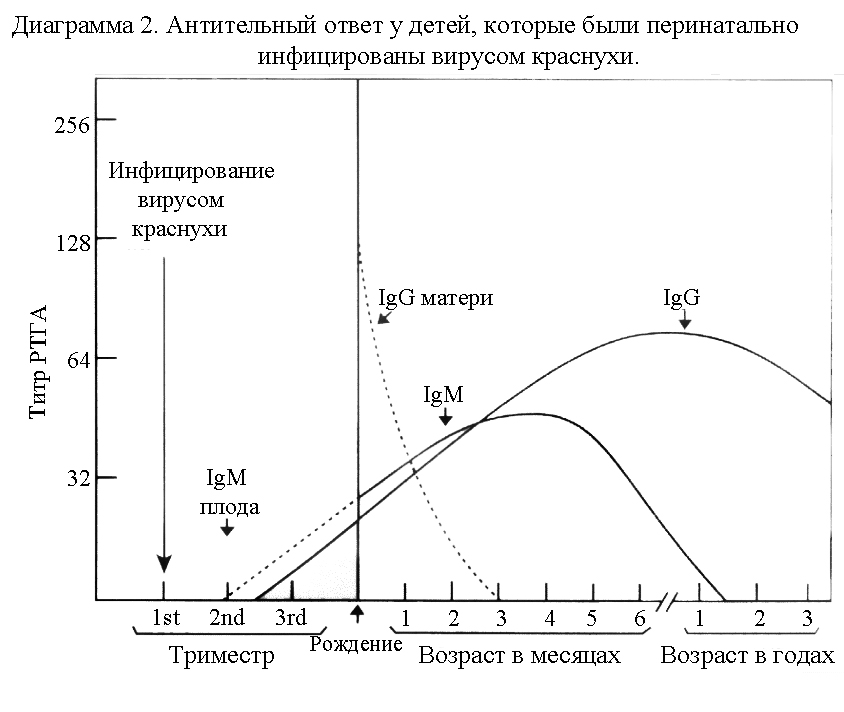 ечение
симптоматическое. Показаны интерфероны
и их индукторы.
ечение
симптоматическое. Показаны интерфероны
и их индукторы.
Профилактика. Разработаны живые аттенуированные и инактивированные краснушные вакцины. Живая краснушная вакцина создана путем множественных пассажей вирусного изолята из эксплантированной культуры клеток почки эмбриона человека в диплоидные клетки легких плода человека. Вакцинный штамм RA27/3. Вакцина эффективна у более чем 95 % реципиентов. Вакцинируются дети в 12 месяцев жизни; ревакцинация в 15-16 лет проводится только девочкам. Вакцинация во время беременности живыми вакцинами противопоказана, поскольку вакцинный штамм может проникать через плаценту и инфицировать плод. Вакцинация может быть проведена за 3 месяца до беременности. Разработаны комбинированные вакцины, включающие вакцины против кори, эпидемического паротита, ветряной оспы и краснухи. Вакцинация в США привела к ликвидации краснухи на 99 %.
§ 3. Род Alphavirus.
Р од
включает 23 вида альфавирусов, из которых
12 патогенны для человека (рис. 2). Системные
лихорадки у людей вызывают вирусы
Синдбис, Гета, Чикунгунья, Оньонг-Ньонг,
Игбо Ора, Росс Ривер, Майаро, Барма
Форест, Семлики Форест. К вирусам,
вызывающим у человека энцефалиты,
относятся вирусы восточного энцефалита
лошадей, западного энцефалита лошадей,
венесуэльского энцефалита лошадей. На
территории СНГ циркулируют вирусы
Синдбис, Гета и Семлики Форест. Почти
все альфавирусы экологически связаны
с комарами. Особенность репликации
альфавирусов состоит в том, что ранний
неструктурный полипротеин нарезается
протеазой на 2 белка.
од
включает 23 вида альфавирусов, из которых
12 патогенны для человека (рис. 2). Системные
лихорадки у людей вызывают вирусы
Синдбис, Гета, Чикунгунья, Оньонг-Ньонг,
Игбо Ора, Росс Ривер, Майаро, Барма
Форест, Семлики Форест. К вирусам,
вызывающим у человека энцефалиты,
относятся вирусы восточного энцефалита
лошадей, западного энцефалита лошадей,
венесуэльского энцефалита лошадей. На
территории СНГ циркулируют вирусы
Синдбис, Гета и Семлики Форест. Почти
все альфавирусы экологически связаны
с комарами. Особенность репликации
альфавирусов состоит в том, что ранний
неструктурный полипротеин нарезается
протеазой на 2 белка.
Вирус Чикунгунья
Название вируса происходит от выражения, которое на языке одного из племен Танзании (Африка) означает «тот, который сгибает».
История открытия. Вирусы Чинкунгунья выделены в 1956 г. Россом из крови больных, комаров Aedes, Culex, постельных клопов и в слюнных железах летучих мышей (Танзания, Африка).
Особенности вирусов. Вирионы неправильной сферической формы, диаметром 60-80 нм. Суперкапсид бислойный липидный, толщиной 10 нм, содержит шипы длиной 8-10 нм. Капсид икосаэдрического типа симметрии, диаметром 33-40 нм. Геном представлен однониточной линейной несегментированной «+»-РНК длиной 12*103 нуклеотидов. Геном кодирует 4 структурных и 4 неструктурных белка, в том числе трансферазу, протеазу, РНК-полимеразу. Мутации редки, возможны рекомбинации. Вирус Чикунгунья обладает гемагглютинирующими свойствами.
Антигенная структура. По степени антигенного родства вирус Чикунгунья входит в четвертый комплекс, объединяющий вирусы Семлики Форест, Майаро, Оньонг-Ньонг.
Резистентность. Вирусы чувствительны к протеазам и липазам, мочевине, ацетону, эфиру, ультрафиолетовому облучению; термолабильны. Интактные вирионы устойчивы к действию РНКазы. Инфекционность вируса сохраняется в зоне от рН от 6,5 до 9,0.
К ультивирование.
Вирус патогенен для новорожденных мышей
до 12-дневного возраста при заражении в
мозг. Морские свинки и кролики
невосприимчивы. Размножается с ЦПД на
культуре клеток HeLa,
почек
уток и обезьян (рис. 3). Возможно
культивирование в куриных эмбрионах.
ультивирование.
Вирус патогенен для новорожденных мышей
до 12-дневного возраста при заражении в
мозг. Морские свинки и кролики
невосприимчивы. Размножается с ЦПД на
культуре клеток HeLa,
почек
уток и обезьян (рис. 3). Возможно
культивирование в куриных эмбрионах.
Эпидемиология. Ареал вирусов Чикунгунья – Африка (Заир, Замбия, ЮАР, Ангола) и Азия (Филиппины, Тайланд, Вьетнам, Бирма, Малайзия, Сингапур, Индонезия, Индия, Шри-Ланка, Полинезия). Резервуаром вирусов Чикунгунья являются приматы, и, возможно, летучие мыши. Источник инфекции – приматы и больные люди. Механизм передачи – трансмиссивный, переносчики – комары родов Aedes и Culex. В лабораторных условиях возможно аэрогенное заражение.
Патогенез. Вирус Чикунгунья проникает в организм человека при укусе комара. Размножение вирусов происходит в регионарных лимфатических узлах и эндотелии сосудов. Во время вирусемии возбудители попадают в мышцы, печень, костный мозг, соединительную ткань. Вирусинфицированные клетки подвергаются цитолизу. Ключевую роль в патогенезе заболевания играют аутоиммунные реакции при участии системы комплемента.
Клиника. Заболевание характеризуется высокой лихорадкой, сильными болями в суставах и мышцах, геморрагическими проявлениями, лейкопенией. Исход заболевания благоприятный. Летальность составляет от 0,5 до 3 %.
Иммунитет. После перенесенного заболевания формируется клеточный и гуморальный иммунитет. Вируснейтрализующие антитела в крови переболевших сохраняются до 4 лет.
Лабораторная диагностика. Материалом для исследования являются кровь, спинномозговая жидкость, ткани мозга, печени, селезенки, лимфатических узлов. Применяются вирусоскопический, вирусологический и серологический методы диагностики. Экспресс-диагностика проводится с использованием РИФ, РНГА, ИФА, РИА. Вирусологическое исследование включает выделение вирусов на животных, в культурах клеток или в куриных эмбрионах. Индикация вирусов проводится по ЦПД, бляшкообразованию под агаровым покрытием, гибели экспериментальных животных и куриных эмбрионов. Идентификацию вирусов Чикунгунья проводят в РТГА, РСК, РН (на мышах, на культурах клеток и в куриных эмбрионах), ИФА, РИА, РИФ. Для серологической диагностики применяются РТГА, РСК, РН, РПГА, ИФА, РИФ и РИА.
Лечение. Этиотропная терапия не разработана. Показаны интерфероны, их индукторы, ремантадин.
Профилактика. Разработана живая аттенуированная вакцина, вызывающая непродолжительный иммунитет, в связи с чем практического значения не имеет. Неспецифическая профилактика включает борьбу с комарами. Больных следует изолировать в комнатах, защищенных от проникновения комаров, на срок не менее 5 суток после начала лихорадки. Дезинфекция и карантин не проводятся.
Вирус Синдбис
История открытия. Вирус впервые изолирован в 1952 г. Тейлором и соавторами из комаров рода Culex, пойманных в районе Синдбис (Египет).
Особенности вирусов. Размеры вириона – 70-80 нм. Обладают гемагглютинирующими свойствами. РНК длиной 12*103 нуклеотидов кодирует метилтрансферазу, геликазу, РНК-полимеразу.
Антигенная структура. Вирусы высоко иммуногенны. По антигенной структуре близки к вирусам западного энцефалита лошадей. Обнаруживают перекрестные реакции с вирусами Чикунгунья и Гета. Вирус Синдбис имеет антигенные варианты.
Резистентность. Относительно устойчивы к эфиру, хорошо переносят высушивание, повторяющиеся замораживания и оттаивания. При температуре 4˚С стабильны; при 56˚С быстро теряют свою инфекционность. Вирусы Синдбис чувствительны к органическим растворителям, детергентам; изолированная РНК чувствительна к РНКазам.
К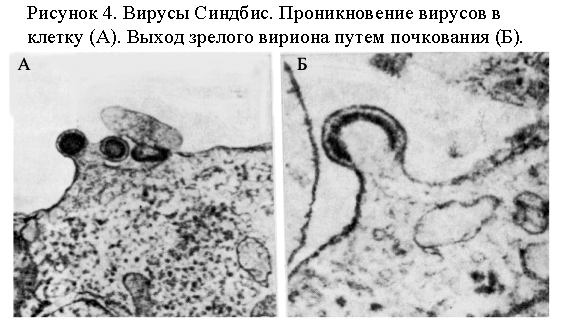 ультивирование.
Вирусы Синдбис размножаются в мозге
1-5-дневных мышей, в организме макак
резус, цыплят, цапель, серых ворон,
голубей (рис. 4). В куриных эмбрионах
вирусы культивируют в желточном мешке
в течение 24-72 ч.
ультивирование.
Вирусы Синдбис размножаются в мозге
1-5-дневных мышей, в организме макак
резус, цыплят, цапель, серых ворон,
голубей (рис. 4). В куриных эмбрионах
вирусы культивируют в желточном мешке
в течение 24-72 ч.
Эпидемиология. Вирусы Синдбис эндемичны в дельте Нила. Существует 2 географические подгруппы вирусов Синдбис: 1) европейско-азиатская, 2) азиатско-австралийская. Вирусы Синдбис встречаются на Ближнем Востоке, в Африке, Юго-Восточной Азии, Индии, Борнео, Австралии, СНГ, Чехии, Словакии, Скандинавии, Новой Зеландии, Бразилии, Аргентине. Резервуаром вирусов являются мигрирующие птицы, что способствует глобальному распространению вирусов Синдбис. Основными переносчиками вирусов являются комары родов Culex и Monsonia, возможными дополнительными переносчиками - клещи. Механизм передачи инфекции к человеку – трансмиссивный.
Патогенез. Клетками-мишенями для вирусов Синдбис являются эпидермальные, синовиальные клетки и клетки ретикулоэндотелиальной системы.
Клиника. Заболевание характеризуется лихорадкой, артралгиями, сыпью.
Иммунитет преимущественно гуморального типа с высоким титром вируснейтрализующих антител.
Лабораторная диагностика аналогична таковой для вирусов Чикунгунья.
Лечение симптоматическое и патогенетическое. Показаны интерфероны и их индукторы.
Профилактика неспецифическая. Вакцины не разработаны.
Вирус Семлики Форест
Название вируса происходит от названия леса Семлики (от английского слова forest – лес).
История открытия. Вирусы впервые были выделены в 1942 г. Смитберном и Хэддоу от комаров Aedes, пойманных в Уганде.
Особенности вирусов. Вирионы диаметром 70-80 нм, содержат суперкапсид, обладающий гемагглютинирующими свойствами. Диаметр капсида – 30 нм. РНК имеет длину 12*103 нуклеотидов.
Антигенная структура. Вирусы высоко иммуногенны. Содержат перекрестные антигены с вирусами Чикунгунья, Синдбис и Майаро.
Резистентность. Вирусы Семлики Форест термоустойчивы, инактивируются при 60 ˚ С в течение 1 часа.
Культивирование. Размножаются в организме белых мышей, морских свинок, хомяков, кроликов, обезьян; в куриных эмбрионах. Культивируются с ЦПД в куриных фибробластах, в почках уток и обезьян (рис. 5).
Э пидемиология.
Ареал вирусов Семлики Форест – Африка,
Австралия, Южная Америка, Япония,
Малайзия, СНГ. Резервуаром и источником
инфекции являются позвоночные (лошади
и другие копытные). Механизм передачи
инфекции человеку – трансмиссивный.
Переносчики – комары рода Aedes.
пидемиология.
Ареал вирусов Семлики Форест – Африка,
Австралия, Южная Америка, Япония,
Малайзия, СНГ. Резервуаром и источником
инфекции являются позвоночные (лошади
и другие копытные). Механизм передачи
инфекции человеку – трансмиссивный.
Переносчики – комары рода Aedes.
Патогенез изучен недостаточно. Отмечается тропность вирусов Семлики Форест к эпидермальным, синовиальным клеткам и клеткам ретикулоэндотелиальной системы. У части инфицированных вирусемия не развивается.
Клиника. Заболеванием характеризуется лихорадкой, артралгиями, артритами, сыпью.
Иммунитет. После перенесенного заболевания развивается гуморальный иммунитет с образованием высоких титров нейтрализующих антител.
Лабораторная диагностика. Материалом для исследования является кровь, спинномозговая жидкость, ткани органов. Основной метод диагностики – серологический (РТГА, РСК, РН, ИФА).
Лечение патогенетическое и симптоматическое.
Профилактика неспецифическая. Вакцин нет.
Вирус восточного энцефалита лошадей
История открытия. Вирусы впервые были выделены от больных лошадей во время эпизоотии Тен Броеком и Меррилом в 1933 г. в Нью-Джерси (США).
Особенности вирусов. Вирионы диаметром 54-125 нм (в среднем – 60-65 нм), имеют суперкапсид, содержащий гликопротеины Е1 и Е2. Капсид образован белком С. РНК инфекционна.
Резистентность. Вирусы мало устойчивы к нагреванию (быстро инактивируются при температуре 56˚С и выше. Хорошо сохраняются при –70˚С и выше в 50 % глицерине. Вирусы чувствительны к детергентам, эфиру, ультрафиолетовые лучи подавляют вирус в течение 15 минут.
Культивирование. К вирусам чувствительны мыши, крысы, морские свинки, кролики, обезьяны, цыплята. У мышей инкубационный период составляет 2-3 дня, после чего возникают поражения центральной нервной системы с проявлением энцефалита. Вирусы высоко патогенны для куриных эмбрионов, вызывая у них смертельную инфекцию в течение 24-48 ч. Размножаются с ЦПД в культурах клеток куриных фибробластов, HeLa, почек уток, обезьян и многих других животных.
Эпидемиология. Вирусы восточного энцефалита лошадей распространены вдоль восточного побережья американских континентов от США до Аргентины. Вирусы выделены в Таиланде, на Филиппинах, в Чехии, Словакии, Польше, СНГ (Сибирь, Казахстан). Резервуаром вирусов и источником инфекции являются лошади и птицы. Переносчики – комары и блохи. Механизм передачи инфекции к человеку – трансмиссивный. Эпизоотии у лошадей предшествуют возникновению заболеваний у человека на 1-2 недели. Заболевают, главным образом, дети младшего возраста и взрослые старше 55 лет. В возрасте от 15 до 54 лет болезнь часто протекает бессимптомно.
Патогенез. Вирусы проникают в кровь при укусе комаров. В процессе вирусемии поражаются нейроны базальных ганглиев и продолговатого мозга, коры больших полушарий, гиппокампа. Процесс может переходить на белое вещество головного мозга. Наблюдается деструкция нейронов, нейронофагия, сателлитоз, периваскулярный отек с ранним появлением лейкоцитов, васкулит, закупорка сосудов головного мозга. Развиваются глиальные узелки и демиелинизация аксонов.
Клиника. Инкубационный период – 5-15 дней. Заболевание развивается остро, характеризуется высокой лихорадкой и сильными головными болями. Через 1-2 дня наступает значительное улучшение общего состояния больного, длящееся 2-3 дня. Затем вновь повышается температура тела. Нарушается сознание, развиваются судороги, парезы и параличи. При поражении ствола головного мозга развиваются расстройства дыхания. Длительность заболевания – 1-3 недели. Летальность – от 20 до 70 % и выше.
Иммунитет стойкий пожизненный, клеточного и гуморального типов.
Лабораторная диагностика. Материалом для исследования является кровь, спинномозговая жидкость. Основной метод диагностики – серологический (РСК, РТГА, РН, ИФА). Диагностическим считается нарастание титров антител в 4 и более раза.
Лечение патогенетическое. В остром периоде болезни вводят противоэнцефалитический лошадиный иммуноглобулин. Ни один из антивирусных препаратов не оказался эффективным при лечении восточного энцефалита лошадей.
Профилактика. Разработаны и используются вакцины как для людей, так и для лошадей. Наиболее часто применяется инактивированная формалином вакцина. При использовании живой аттенуированной вакцины (ТС-83) отмечаются побочные эффекты.
