
Глава 23 Семейство Rhabdoviridae
§ 1. Характеристика семейства.
Название семейства происходит от греческого слова rhabdos – прут и virus – вирус. Семейство включает РНК-вирусы, имеющие вытянутую пулевидную или палочковидную форму вириона. В состав семейства входит более 60 видов вирусов.
Классификация. Семейство входит в порядок Mononegavirales, и состоит из 6 родов: Lyssavirus, Vesiculovirus, Ephemerovirus и Novirhabdovirus (поражают позвоночных и беспозвоночных), а так же Cytorhabdovirus и Nucleorhabdovirus (поражают растения). Патогенные для человека рабдовирусы относятся к родам Lyssavirus и Vesiculovirus.
С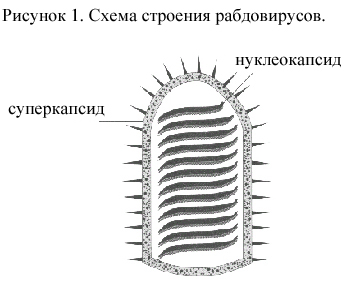 троение
вириона рабдовирусов.
Рабдовирусы позвоночных имеют вытянутую
пулевидную форму (закругленные на одном
конце и плоские на другом), рабдовирусы
растений - палочковидную форму (закруглены
на обоих концах) (рис. 1). Диаметр вирионов
от 50 до 95 нм, длина 130-380 нм (длина
рабдовирусов животных – 180 нм). Вирионы
имеют суперкапсид, нуклеокапсид и
ферменты. Суперкапсид состоит из
липидного бислоя, покрытого снаружи
гликопротеиновыми шипами и выстланного
изнутри матриксным белком (М-белок).
Шипы обладают антигенными и
гемагглютинирующими свойствами,
выполняют функцию рецепторов. Мембранный
белок скрепляет суперкапсид с
нуклеокапсидом. Нуклеокапсид - это РНК,
окруженная по всей своей длине единственным
главным структурным белком (N-белок).
Нуклеокапсид представляет собой спираль,
обусловливающую форму вириона. С
нуклеокапсидом соединены L- и NS-белки в
совокупности функционирующие как
РНК-зависимая РНК-полимераза. Суперкапсид
не является необходимым для заражения,
но повышает инфекционность рабдовирусов
в 3-5 раз. Геном рабдовирусов представлен
однониточной линейной нефрагментированной
«-»-РНК длиной 11,2-12,0*103
нуклеотидов. РНК имеет 4-5 открытых рамки
считывания, каждая из которых кодирует
1 полипептид, в том числе и РНК-зависимую
РНК-полимеразу. Изолированная РНК не
инфекционна. Геномная РНК может
претерпевать делеции, что ведет к
образованию дефектных частиц с
уменьшенными размерами вириона и
неспособности реплицироваться без
помощи полноценного рабдовируса.
троение
вириона рабдовирусов.
Рабдовирусы позвоночных имеют вытянутую
пулевидную форму (закругленные на одном
конце и плоские на другом), рабдовирусы
растений - палочковидную форму (закруглены
на обоих концах) (рис. 1). Диаметр вирионов
от 50 до 95 нм, длина 130-380 нм (длина
рабдовирусов животных – 180 нм). Вирионы
имеют суперкапсид, нуклеокапсид и
ферменты. Суперкапсид состоит из
липидного бислоя, покрытого снаружи
гликопротеиновыми шипами и выстланного
изнутри матриксным белком (М-белок).
Шипы обладают антигенными и
гемагглютинирующими свойствами,
выполняют функцию рецепторов. Мембранный
белок скрепляет суперкапсид с
нуклеокапсидом. Нуклеокапсид - это РНК,
окруженная по всей своей длине единственным
главным структурным белком (N-белок).
Нуклеокапсид представляет собой спираль,
обусловливающую форму вириона. С
нуклеокапсидом соединены L- и NS-белки в
совокупности функционирующие как
РНК-зависимая РНК-полимераза. Суперкапсид
не является необходимым для заражения,
но повышает инфекционность рабдовирусов
в 3-5 раз. Геном рабдовирусов представлен
однониточной линейной нефрагментированной
«-»-РНК длиной 11,2-12,0*103
нуклеотидов. РНК имеет 4-5 открытых рамки
считывания, каждая из которых кодирует
1 полипептид, в том числе и РНК-зависимую
РНК-полимеразу. Изолированная РНК не
инфекционна. Геномная РНК может
претерпевать делеции, что ведет к
образованию дефектных частиц с
уменьшенными размерами вириона и
неспособности реплицироваться без
помощи полноценного рабдовируса.
Репродукция рабдовирусов. Рабдовирусы животных могут размножаться в клетках позвоночных и насекомых. Рабдовирусы животных проникают в клетку путем рецепторного эндоцитоза. В кислой среде происходит слияние суперкапсида с мембраной эндосомы, что сопровождается выходом нуклеокапсида в цитоплазму клетки. Транскрипция и репликация рабдовирусов происходят в цитоплазме. Транскрипцию осуществляет вирусная РНК-зависимая РНК-полимераза. Продуктом транскрипции являются 4-6 моноцистронных иРНК. РНК-полимераза начинает транскрипцию с 3-конца и транслирует каждый ген в увеличивающихся количествах по мере своего продвижения от начала. Гены, локализованные ближе к 3-концу, транскрибируются более часто. В результате транскрипции образуется 47-нуклеотидная ведущая РНК, которая является копией 3'-конца генома. За ней следует нетранскрибируемая соединяющая последовательность ААА. Ведущий транскрипт, который не кэпируется и не полиаденилируется, транспортируется в ядро, где он ингибирует транскрипцию клетки-хозяина. Ведущий транскрипт сопровождается N-матричной РНК, которая кэпируется во время синтеза полимеразным комплексом вириона. После трансляции вирусных протеинов начинается синтез полноразмерных «+»-РНК. Репликация рабдовирусов происходит в 2 фазы: вначале образуются полноразмерные «+»-РНК, являющиеся копиями «-»-РНК; затем на матрице «+»-РНК образуются геномные «-»-РНК. Сборка вирионов осуществляется в цитоплазме. Высвобождение зрелых вирионов происходит путем «взрыва» с разрушением клеток.
§ 2. Род Lyssavirus.
Название рода происходит от греческого слова lyssa – водобоязнь. В род входят вирус бешенства и бешенствоподобные вирусы. Лиссавирусы имеют 5 серотипов: 1-й серотип – вирус бешенства, 2-й серотип – вирус лагосских летучих мышей, 3-й серотип – вирус Мокола, 4-й серотип – вирус Дьювенхейдж, 5-й серотип – лиссавирус европейских летучих мышей (имеет 2 генотипа). Каждый серотип (кроме 5-го) составляет свой собственный генотип. Вирус бешенства считался единственным серотипом без родственных вирусов до 1969 г.
Вирус бешенства
История открытия. Отдельные свойства возбудителя бешенства впервые изучены в 1880 г. Л. Пастером. Внутриклеточные кристаллы вирусов бешенства обнаружены в 1892 г. В. Бабешем и в 1903 г. А. Негри. Первая инактивированная антирабическая вакцина была получена Л. Пастером и сотрудниками в 1885 г. методом аттенуации дикого штамма вируса в мозге восприимчивых животных.
О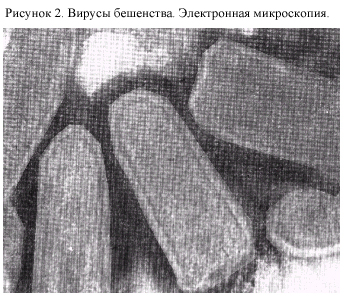 собенности
вируса. Вирион
вируса бешенства пулевидной формы,
длиной 80-180 нм и шириной 60-80 нм (рис. 2).
Суперкапсид липидный, с шипами длиной
7 нм, является производным клетки-хозяина.
G-гликопротеины
суперкапсида (гемагглютинины) являются
протективными антигенами. Геном
представлен однониточной линейной
несегментированной «-»-РНК. РНК кодирует
5 белков: неструктурный – NS,
матриксный
– М, гликопротеид – G,
РНК-зависимую РНК-полимеразу - L
и белок – N,
который образует белковые субъединицы
нуклеокапсида. Состав вирионов: белки
– 72 %, липиды – 22 %, углеводы – 3 %, РНК –
1 %.
собенности
вируса. Вирион
вируса бешенства пулевидной формы,
длиной 80-180 нм и шириной 60-80 нм (рис. 2).
Суперкапсид липидный, с шипами длиной
7 нм, является производным клетки-хозяина.
G-гликопротеины
суперкапсида (гемагглютинины) являются
протективными антигенами. Геном
представлен однониточной линейной
несегментированной «-»-РНК. РНК кодирует
5 белков: неструктурный – NS,
матриксный
– М, гликопротеид – G,
РНК-зависимую РНК-полимеразу - L
и белок – N,
который образует белковые субъединицы
нуклеокапсида. Состав вирионов: белки
– 72 %, липиды – 22 %, углеводы – 3 %, РНК –
1 %.
Культивирование. Для культивирования вирусов бешенства используют: 1) лабораторных животных (мыши, крысы, обезьяны, собаки, кролики, хомяки); 2) куриные эмбрионы; 3) культуры клеток (опухолевые, Vero, человеческие диплоидные, куриные и утиные эмбриональные клетки).
Резистентность. Вирусы бешенства инактивируются растворами формалина, лизола, фенола, хлорамина, калия перманганата, карболовой кислоты, а также эфиром, ацетоном, спиртом, трипсином, ультрафиолетовыми лучами. При температуре 100˚С вирусы погибают в течение 2 минут, при 60˚С – в течение 10-15 минут.
Эпидемиология. Бешенство – типичный зооноз; от человека к человеку бешенство не передаётся. Резервуаром и источником инфекции являются: 1) псовые (собаки, лисы, волки, енотовидные собаки, шакалы); 2) куньи (куницы, барсуки, ласки, хорьки, горностаи, скунсы, мангусты); 3) рукокрылые (насекомоядные и плотоядные летучие мыши); 4) копытные (коровы, лошади); 5) кошачьи (домашние кошки, дикие кошки, рыси и др.); 6) грызуны (мыши, крысы). Бешенством болеет человек. Механизм передачи инфекции от больного животного к человеку – перкутанный (при укусах животными, либо при ослюнении). Бешенство у собак увеличивается летом. Инкубационный период при бешенстве у животных – 10 дней. Бессимптомного вирусоносительства у животных не бывает.
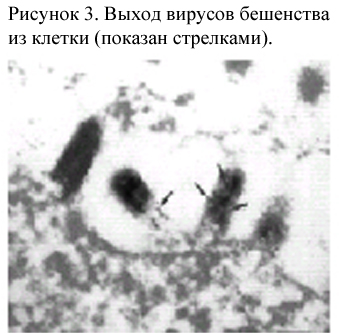 Патогенез.
У
животных вирусы бешенства инфицируют
головной мозг и слюнные железы. Со слюной
вирусы попадают в окружающую среду. В
1 мл слюны бешенного животного содержится
108
инфицирующих
доз. После укуса или ослюнения раны
вирусы бешенства остаются в очаге в
течение инкубационного периода,
длительность которого варьирует от 12
дней до более года. При связывании с
тканью вирус бешенства концентрируется
в нервно-мышечных контактах. Тканевым
рецептором для вируса бешенства являются
ацетилхолиновые и другие рецепторы.
Вирусы проникают в аксоны нейронов и
попадают в центральную нервную систему.
В цитоплазме нейронов гиппокампа,
продолговатого мозга, ядер черепно-мозговых
нервов, симпатических ганглиев и клетках
Пуркинье мозжечка происходит размножение
и накопление вирусов бешенства. В
пораженных клетках обнаруживаются
вирусоспецифические цитоплазматические
включения – тельца Бабеша-Негри. Вокруг
инфицированных нейронов наблюдаются
явления нейронофагии и сателлитоза.
Репродукция вирусов бешенства
сопровождается увеличением протеина
bax
и апоптозом нейронов. Поражение нейронов
ведет к усилению рефлекторной возбудимости
и возникновению судорог, особенно
глотательных и дыхательных мышц, к
увеличению слюно- и потоотделения.
Патогенез.
У
животных вирусы бешенства инфицируют
головной мозг и слюнные железы. Со слюной
вирусы попадают в окружающую среду. В
1 мл слюны бешенного животного содержится
108
инфицирующих
доз. После укуса или ослюнения раны
вирусы бешенства остаются в очаге в
течение инкубационного периода,
длительность которого варьирует от 12
дней до более года. При связывании с
тканью вирус бешенства концентрируется
в нервно-мышечных контактах. Тканевым
рецептором для вируса бешенства являются
ацетилхолиновые и другие рецепторы.
Вирусы проникают в аксоны нейронов и
попадают в центральную нервную систему.
В цитоплазме нейронов гиппокампа,
продолговатого мозга, ядер черепно-мозговых
нервов, симпатических ганглиев и клетках
Пуркинье мозжечка происходит размножение
и накопление вирусов бешенства. В
пораженных клетках обнаруживаются
вирусоспецифические цитоплазматические
включения – тельца Бабеша-Негри. Вокруг
инфицированных нейронов наблюдаются
явления нейронофагии и сателлитоза.
Репродукция вирусов бешенства
сопровождается увеличением протеина
bax
и апоптозом нейронов. Поражение нейронов
ведет к усилению рефлекторной возбудимости
и возникновению судорог, особенно
глотательных и дыхательных мышц, к
увеличению слюно- и потоотделения.
Иммунитет. Люди и животные, вакцинированные классическими вакцинами против бешенства, отвечают подъемом уровня нейтрализующих антител. Степень подъема определяется силой вакцины. Антитела направлены к G-гликопротеину (гемагглютинину). Сывороточные антитела у людей, больных бешенством, редко появляются до 8 дня болезни. В спинномозговой жидкости антитела появляются на 9-11-й дни. Клеточный иммунитет при бешенстве изучен недостаточно. Остается непонятным тот факт, что у 85 % людей, укушенных заведомо бешеным животным, бешенство не развивается, заболевают только 15 % пострадавших.
Клиника. При условии развития клинических признаков заболевания бешенство – абсолютно смертельная болезнь. Заболевание характеризуется неуклонным повышением температуры тела до 42˚С, развитием депрессии, апатии, расстройствами дыхания и глотания. При попытке питья и при виде воды возникают приступы гидрофобии – чувство ужаса и болезненные спазмы мышц глотки и гортани. Приступы гидрофобии могут быть спровоцированы движением воздуха (аэрофобия), ярким светом (фотофобия), громким звуком (акустофобия). Приступ сопровождается болезненными судорогами, агрессивностью, помрачением сознания. Через 1-2 дня от начала болезни появляется обильное слюно- и потоотделение. В последующем развиваются параличи нижних конечностей и черепно-мозговых нервов. Смерть наступает от паралича сердца или дыхательного центра. Общая продолжительность болезни – 3-7 дней.
Лабораторная диагностика. Используется вирусоскопический метод и биологическая проба на животных. При световой микроскопии тканей больших полушарий, мозжечка, продолговатого мозга и гиппокампа в цитоплазме нейронов обнаруживаются тельца Бабеша-Негри. Для их выявления используются способы окраски по Туревичу, Муромцеву-Селлеру и др. Тельца Бабеша-Негри имеют различную величину и форму (от 0,25 до 25 мкм, округлой или овальной формы). Тельца окрашиваются в красно-оранжевый цвет и выявляются в 90-95 % случаев в мозге собак, погибших от бешенства, и в 70 % случаев – у погибших от бешенства людей (см. главу 7). При отрицательных результатах патогистологических исследований применяют люминесцентную микроскопию, а также биологическую пробу на мышах. Для выявления антигенов вируса бешенства используют непрямой и прямой метод флюоресцирующих антител. Мазки-отпечатки ткани мозга фиксируют в ацетоне при температуре 4˚С в течение 8-10 ч, после чего на препараты наносят антирабический иммуноглобулин, меченный флюорохромами, и выдерживают во влажной камере при 37˚С в течение 30 минут. После этого препараты промывают буферным раствором (рН 7,4), сушат и исследуют в люминесцентном микроскопе. Нормальная ткань мозга флюоресцирует тусклым желтым цветом, антигены вируса бешенства – в виде зеленых гранул различной величины и формы. Биологическая проба проводится путем внутримозгового заражения под наркозом 15-20 мышей-сосунков или мышей в возрасте 3-5 дней. Инфицирующая доза – 0,03 мл суспензии исследуемого материала. Животные наблюдаются в течение 21 дня от момента заражения. Клинические проявления бешенства у мышей развиваются не ранее 5 дня. Идентификацию вирусов бешенства проводят в материале от погибших животных при использовании люминесцентной микроскопии.
Лечение. Не разработано. Проводится симптоматическое лечение.
Профилактика. Бешенство можно контролировать на 3 уровнях: человек, домашние животные и дикие животные. Имеются вакцины для профилактики среди людей и домашних животных (культуральные инактивированные вакцины, вводимые парентерально). Среди диких животных используется пероральная вакцина.
Предупреждение заболевания человека бешенством после укуса или ослюнения его бешеным или неизвестным животным осуществляется тщательной первичной обработкой раны с промыванием ее перекисью водорода и прижиганием концентрированной йодной настойкой. Затем проводят срочную серотерапию (антирабический γ-глобулин) и вакцинацию на пастеровских пунктах согласно инструкции, утвержденной Министерством здравоохранения Украины.
В настоящее время для профилактики бешенства используется антирабическая инактивированная культуральная сухая вакцина. Вакцина получена Селимовым (1974 г.) методом пассажей вирусов бешенства (штамм-fixe) в культуре клеток почек сирийского хомяка при 32˚С. Вакцинный штамм – Внуково-32 – инактивирован ультрафиолетовыми лучами. Вакцина выпускается в ампулах по 3 мл (после разведения). Вводится подкожно в область живота. В зависимости от категории повреждения и данных о животном разовая доза составляет от 2 до 5 мл. Основной курс вакцинации – от 7 до 21 дня, сроки проведения ревакцинации – согласно инструкции по применению вакцины. Вакцина используется для проведения экстренной профилактики бешенства (укусы, ослюнение бешеными животными). При вакцинации и после ее проведения (даже если она была прервана) употребление алкогольных напитков запрещено в течение 6 месяцев. Антитела появляются через 2 недели после начала прививок, при этом поствакцинальный иммунитет становится действенным примерно через 2 недели после окончания вакцинации. Вакцинация предупреждает возникновение бешенства в 96-99 % случаев. Иммунитет сохраняется в течение 1 года.
Неспецифическая профилактика бешенства городского типа предусматривает предупреждение бродяжничества собак и кошек, обязательную их регистрацию, профилактическую иммунизацию домашних животных, санитарно-ветеринарную пропаганду. Борьба с эпизоотиями природного типа имеет целью поддержание популяции животных, являющихся резервуаром бешенства, на определенном уровне.
Бешенствоподобные вирусы
К бешенствоподобным вирусам относятся: 1) вирус Мокола; 2) вирус Дьювенхейдж; 3) вирус лагосских летучих мышей; 4) лиссавирус европейских летучих мышей. Бешенствоподобные вирусы распространены преимущественно в Африке и способны поражать человека.
История открытия. Вирус лагосских летучих мышей был изолирован в 1956 г. Л.Р. Булгером и Д. Портерфилдом из головного мозга летучих мышей острова Лагос (Нигерия). Вирус Мокола был выделен Г. Кемпом в 1968 г. из органов землероек в районе Мокола (Нигерия); а в 1971 г. – был выделен от человека со смертельным заболеванием центральной нервной системы (Нигерия). В 1970 г. вирус Дьювенхейдж был изолирован из мозга человека, умершего от заболевания, клинически напоминавшего бешенство, после укуса летучей мыши (ЮАР). Лиссавирус европейских летучих мышей был выделен в Германии в 1985 г. из мозговой ткани человека, умершего от бешенствоподобного заболевания после инфицирования в лабораторных условиях.
Особенности вирусов. Вирионы пулевидной формы, длиной 180 нм, диаметром 65 нм. Строение вирионов типично для рабдовирусов. В суперкапсидах вирусов Мокола и вирусов лагосских летучих мышей содержится G-гликопротеин, обеспечивающий агглютинацию эритроцитов птиц. На внутренней поверхности суперкапсида, кроме М-белка, содержится фосфопротеин Р. Нуклеокапсид построен по спиральному типу симметрии. Геном представлен однониточной линейной несегментированной «-»-РНК длиной 12*103 нуклеотидов. Геном вируса Мокола по строению и длине сходен с геномом вируса бешенства.
Антигенная структура. Антигенными свойствами обладают G-, М- и Р-белки, по отношению к которым образуются антитела. Вирусы Мокола и вирусы лагосских летучих мышей проявляют минимальные перекрестные реакции с вирусом бешенства. Вирусы лагосских летучих мышей имеют 3 подтипа: 1) Лагос; 2) Центрально-южноафриканская республика; 3) Южная Африка. Вирусы Мокола и Дьювенхейдж имеют только 1 подтип.
Резистентность сходна с таковой для вирусов бешенства.
Культивирование. Вирусы Мокола, Дьювенхейдж и вирусы лагосских летучих мышей культивируют в клеточных культурах Vero, в организме африканских зеленых мартышек, мышей, макак резус. Вирус Мокола адаптирован к комарам в лабораторных условиях.
Эпидемиология. Ареал распространения бешенствоподобных вирусов – Африка, кроме лиссавирусов европейских летучих мышей, которые встречаются по всей Европе от Испании до Украины. Сезонность не отмечена. Резервуаром и источником инфекции являются: 1) лагосские летучие мыши (вирус передается кошкам и собакам); 2) вируса Мокола - землеройки (вирус выделяется также от собак, кошек); 3) вирусов Дьювенхейдж – насекомоядные летучие мыши; 4) европейские летучие мыши. Механизм передачи инфекции – перкутанный (при укусах животными). Эпизоотии и эпидемии не развиваются. Люди могут выжить при инфицировании вирусами Мокола, лагосских летучих мышей и Дьювенхейдж.
Патогенез. Бешенствоподобные вирусы нейротропны. В поздней стадии болезни происходит инфицирование слюнных желез. Вирус Мокола в головном мозге вызывает лимфоцитарный периваскулярный отек; в нейронах развивается хроматолизис, эозинофильный некроз и ядерный пикноз (особенно в среднем мозге и базальных ганглиях). Вирусы европейских летучих мышей вызывают литические изменения со стороны головного мозга.
Клиника. При инфицировании вирусами Мокола заболевание проявляется лихорадкой, рвотой, развитием параличей конечностей, глубокой комой перед смертью. Болезнь длится 9 дней, как правило, заканчивается смертью.
Заболевание, вызванное вирусами Дьювенхейдж, развивается по типу восходящего паралича Жиллена-Барре с иррадиирующими болями в руках и шее; затем возникают расстройства дыхания, мышечные спазмы и коматозное состояние с летальным исходом.
Вирусы европейских летучих мышей вызывают бешенствоподобные заболевания, длящиеся до 23 дней.
Иммунитет при бешенствоподобных заболеваниях не изучен.
Лабораторная диагностика. Используются вирусоскопический, вирусологический, серологический и молекулярно-генетический методы диагностики. Материалом для исследования являются: ткань головного и спинного мозга, спинномозговая жидкость, сыворотка крови. При световой микроскопии в нейронах отсутствуют тельца Бабеша-Негри. При люминесцентной микроскопии обнаружение антигенов бешенствоподобных вирусов проводится с использованием специфических моноклональных антител. При серологическом методе диагностики антитела к G-, М- и Р-антигенам выявляют в РН и РСК. За рубежом для диагностики бешенствоподобных заболеваний применяется ПЦР.
Лечение. Специфическое лечение не разработано.
Профилактика. Избежание контакта с летучими мышами. Вакцины против бешенства частично защищают при инфицировании вирусами европейских летучих мышей и вирусами Дьювенхейдж. Против бешенствоподобных заболеваний, вызванных вирусами Мокола и вирусами лагосских летучих мышей, вакцин нет.
§ 3. Род Vesiculovirus.
Патогенным для человека представителем рода является вирус везикулярного стоматита.
Вирус везикулярного стоматита
История открытия. Вирус везикулярного стоматита (серотип Индиана) был впервые изолирован в 1926 г. при вспышке заболевания крупного рогатого скота в Ричмонде (Индиана, США), серотип Нью-Джерси – в 1927 г.
Особенности вирусов. Вирион пулевидной формы, длиной 180 нм и шириной 70 нм (рис. 4). Суперкапсид гликолипидный, является производным клетки-хозяина, содержит гликопротеины G. Внутреннюю поверхность суперкапсида образует белок М. Нуклеокапсид содержит РНК, окруженную по длине капсомерами из N-белка. С нуклеокапсидом связаны L-белок (большой протеин) и Р-белок (полимеразоассоциированный фосфопротеин). Геномная РНК - однониточная несегментированная негативная длиной 11*103 нуклеотидов, может принимать циркулярную форму. В РНК закодировано 7 белков, 5 из которых составляют одну рамку считывания, а 2 неструктурных белка С и С’- вторую рамку считывания внутри гена Р.
А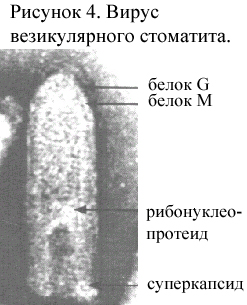 нтигенная
структура.
Вирусы везикулярного стоматита имеют
2 серотипа:
NG (Нью-Джерси) и IN
(Индиана), обладающих перекрестной
реактивностью. Имеются общие
группоспецифические антигены, выявляемые
в РСК.
нтигенная
структура.
Вирусы везикулярного стоматита имеют
2 серотипа:
NG (Нью-Джерси) и IN
(Индиана), обладающих перекрестной
реактивностью. Имеются общие
группоспецифические антигены, выявляемые
в РСК.
Резистентность. Вирусы везикулярного стоматита неинфекционны при рН 3, инфекционны при рН 5-10. Вирусы быстро инактивируются при 56˚С, ультрафиолетовым и рентгеновским облучением, под действием жирорастворителей и формалина.
Культивирование. Вирусы везикулярного стоматита размножаются в большом количестве клеточных культур позвоночных и насекомых, в том числе комаров. ЦПД лучше выражено на клетках позвоночных – хомяков, крупного рогатого скота, приматов.
Эпидемиология. Резервуаром вирусов везикулярного стоматита являются млекопитающие (свиньи, лошади, крупный рогатый скот, крысы, мыши) и насекомые Нового Света. Механизмы передачи инфекции: 1) трансмиссивный (переносчики – комары, москиты, мухи); 2) перкутанный; 3) аэрогенный (воздушно-капельный путь). Люди инфицируются преимущественно аэрогенно. От человека к человеку вирусы везикулярного стоматита не передаются.
Патогенез. Вирусы проникают в слизистую оболочку, в клетках которой происходит их первичная репликация. При поражении кожи размножение вирусов происходит в шиповатом слое эпидермиса. В ряде случаев вирусы могут проникать в кровь и инфицировать внутренние органы. Вирусы интерфероногенны и чувствительны к интерферонам.
Клиника. Инкубационный период составляет 24-48 ч. У человека поражаются язык, десны, губы, кожа груди, препуциум, печень. Развивается гриппоподобное заболевание, часто с ознобом, двухфазной лихорадкой, слабостью, миалгией, головной болью, светобоязнью. В ряде случаев появляются везикулы на языке, слизистой оболочке рта и глотки, на губах и носу. Везикулы представляют собой отделения эпителия от базального слоя, заполненные прозрачной желтоватой жидкостью. Везикулы легко отделяются, оставляя красную поверхность, которая заживает в течение 1-2 недель, если не присоединяется вторичная бактериальная инфекция. У детей может развиваться острый энцефалит.
Иммунитет. У человека не изучен. У лабораторных животных отмечается синтез интерферонов и антител, образование антигенспецифических Т-киллеров.
Лабораторная диагностика. Включает вирусологический, вирусоскопический (люминесцентная микроскопия), серологический (РСК, ИФА) и молекулярно-генетический методы (ПЦР).
Лечение. Используются интерфероны.
Профилактика. Вакцины разработаны, но широкого применения не имеют. Вирусы везикулярного стоматита используется в качестве векторов для генной терапии ВИЧ-инфекции.
