
Глава 12 Семейство Herpesviridae
§ 1. Характеристика семейства.
Название семейства Herpesviridae происходит от греческого слова herpes – ползучий и латинского слова virus – вирус.
Классификация. Семейство Herpesviridae состоит из 3 подсемейств и 9 родов, из которых представители 7 родов патогенны для человека (табл. 1).
Представители подсемейства Alphaherpesvirinae характеризуются широким спектром хозяев, коротким репродуктивным циклом, литическим действием на пораженные клетки, способностью существовать в латентной форме преимущественно в нервных ганглиях.
Представители подсемейства Betaherpesvirinae характеризуются ограниченным кругом хозяев, длительным репродуктивным циклом, развитием персистентной инфекции, приводящей к увеличению размером пораженных клеток железистых, паренхиматозных и лимфоретикулярных тканей.
Представители подсемейства Gammaherpesvirinae характеризуются ограниченным кругом хозяев, тропностью к Т-, В-лимфоцитам и эндотелию сосудов, способностью вызывать литическую и персистентную инфекцию.
Строение вириона герпесвирусов. Вирионы округлой формы, диаметром от 110 до 210 нм. Вирионы имеют суперкапсид, капсид и геном, представленный ДНК (рис. 1).
Суперкапсид имеет 2 слоя. Наружный слой образуется из клеточных мембран и имеет гликолипопротеиновые шипы длиной 8 нм, производные внутренней ядерной мембраны клетки. Гликопротеины D и В отвечают за инфекционность герпесвирусов, являются мощными индукторами нейтрализующих антител, обеспечивают серотипическую специфичность. Внутренний слой представляет собой дополнительную белковую оболочку – тегумент, размер которой различен у разных герпесвирусов. Белки тегумента, вовлекаемые в процесс инициации вирусной репликации, включают регуляторные немедленные ранние протеины ICP4 и IСР0, основной трансактивирующий белок VР16, большую субъединицу вирусной рибонуклеотидной редуктазы (RR1) и vhs, который ингибирует трансляцию клетки хозяина.
Таблица 1
Патогенные для человека герпесвирусы
Подсемейство |
Род |
Виды, патогенные для человека |
Тип поражения |
Доминирующий тип возбудителя |
Alphaherpesvirinae |
Simplexvirus |
ВПГ-1, ВПГ-2 |
Герпетический кератит |
ВПГ-1 |
Нerpes labialis |
ВПГ1>ВПГ2 |
|||
Генитальный герпес |
ВПГ2>ВПГ1 |
|||
Герпес новорожденных |
ВПГ2>ВПГ1 |
|||
Герпетический энцефалит |
ВПГ-1 |
|||
Диссеминированный герпес |
ВПГ1>ВПГ2 |
|||
Герпетический менингоэнцефалит, рак шейки матки |
ВПГ-2 |
|||
Varicellovirus |
Вирус Varicella zoster (ранее назывался ВГЧ-3) |
Ветряная оспа, опоясывающий лишай |
|
|
ILTV-подобные вирусы |
Вирус инфекционного ларинготрахеита (ВИЛТ) |
Инфекционный ларинготрахеит |
|
|
Betaherpesvirinae |
Cytomegalovirus |
Цитомегаловирус, (ранее назывался ВГЧ-5) |
Цитомегаловирусная инфекция |
|
Roseolovirus |
Вирус герпеса человека 6А (ВГЧ-6A) |
Тропны к Т-лимфоцитам, но никакая болезнь в настоящее время с ВГЧ-6А не ассоциируется |
|
|
Вирус герпеса человека 6В (ВГЧ-6B) |
Ложная краснуха (розеола инфантум, экзантема субитум, розеола детская внезапная) |
ВГЧ7>ВГЧ6В |
||
Вирус герпеса человека 7 - ВГЧ-7 |
Ложная краснуха (розеола инфантум, экзантема субитум, розеола детская внезапная) |
ВГЧ7>ВГЧ6В |
||
Gammaherpesvirinae |
Lymphocryptovirus |
Вирус Эпштейна-Барра (ВЭБ), (ранее назывался ВГЧ-4) |
Инфекционный мононуклеоз, синдром хронического мононуклеоза, хроническая, активная ВЭБ-инфекция, африканская форма лимфомы Беркетта, назофарингиальная карцинома у китайцев, саркома Капоши, неберкитовская лимфома |
|
Rhadinovirus |
Герпесвирус, ассоциированный с саркомой Капоши (ВГЧ-8) |
Саркома Капоши |
|
|
Церкопитековый (обезьяний) вирус герпеса типа В (Herpesvirus saimiri) |
Вызывает заболевание у человека по типу ОРВИ |
|
К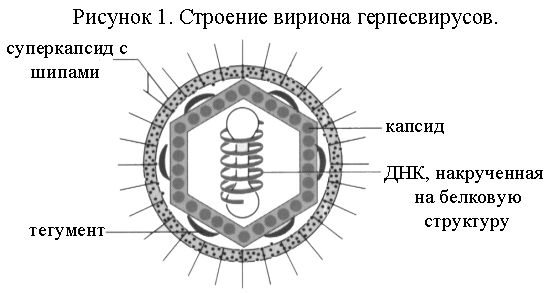 апсид
икосаэдрального типа симметрии диаметром
120-150 нм, построен из 162 капсомеров, каждый
из которых имеет длину 12,5 нм и диаметр
8,5 нм с центральным углублением 4 нм.
Белки нуклеокапсида являются
группоспецифическими антигенами.
апсид
икосаэдрального типа симметрии диаметром
120-150 нм, построен из 162 капсомеров, каждый
из которых имеет длину 12,5 нм и диаметр
8,5 нм с центральным углублением 4 нм.
Белки нуклеокапсида являются
группоспецифическими антигенами.
Геном представлен двухниточной линейной ДНК длиной 125-220*103 пар нуклеотидов, намотанной на внутренние белки. Одна нить ДНК позитивная, вторая – негативная. Концы ДНК имеют повторы и связаны друг с другом ковалентно. ДНК способна образовывать кольцо, что облегчает интеграцию в геном клетки-хозяина. Содержание Г+Ц в ДНК составляет 57-74 мол.%. ДНК герпесвирусов состоит из 2 фрагментов: короткого US и длинного UL. Короткий и длинный фрагменты могут инвертироваться относительно друг друга, поэтому ДНК, экстрагированная из вириона или инфицированной клетки, состоит из 4 популяций с одинаковой молярностью, отличающихся по своей относительной ориентации. Геном кодирует около 100 генов, в том числе ДНК-полимеразу и тимидинкиназу. Гены находятся как в уникальных, так и в повторяющихся последовательностях. Гены RR1 и γ134.5 содержат участки с клеточной гомологичностью, возможно, полученные из инфицированных клеток.
Репродукция герпесвирусов. Герпесвирусы адсорбируются на клетках-мишенях посредством рецепторов. Проникновение вирионов в клетки осуществляется путем слияния суперкапсида с клеточной мембраной. «Раздевание» герпесвирусов происходит в цитоплазме под действием клеточных и вирусных ферментов. При этом нуклеокапсид транспортируется к ядерной оболочке, и вирусная ДНК попадает в ядро, где начинается ее транскрипция и репликация. Транскрипция и репликация происходят при участии, главным образом, клеточных ферментов, а трансляция осуществляется на рибосомах в цитоплазме клетки-хозяина. В результате трансляции «раннего участка» вирусного генома синтезируются ранние белки тегумента (ICP4 и IСР0), включая регуляторные протеины, вирусные полимеразы (тимидинкиназа и ДНК-полимераза) и матричные белки. Вирусная ДНК-полимераза запускает синтез молекул ДНК дочерних популяций. Часть вирусной ДНК транскрибируется клеточной РНК-полимеразой, что индуцирует синтез поздних белков, необходимых для сборки дочерних популяций; последние собираются в ядре и покидают его, отпочковываясь от ядерной мембраны и включая ее фрагменты в состав своей оболочки. При выходе зрелых вирионов из клетки последняя разрушается.
Интеграция ДНК герпесвирусов в геном клетки-хозяина ведет к длительной персистенции вирусов, а также лежит в основе злокачественной трансформации инфицированных клеток.
Подсемейство герпесвирусов дифференцируют иммунологическими методами или гибридизацией ДНК; однако применение последних имеет ряд трудностей, обусловленных гомологией антигенов и ДНК герпесвирусов.
Резистентность герпесвирусов. Герпесвирусы инактивируются высокими температурами (при 50-52˚С в течение 30 минут), ультрафиолетовыми лучами, спиртами, органическими жирорастворителями, детергентами, протеазами, фосфатазой, желчью. Наиболее термостабильны вирусы при рН=6,5-6,9. Способны длительно сохраняться при низких температурах, особенно при -70˚С.
§ 2. Род Simplexvirus.
Включает вирусы простого герпеса первого и второго типов (ВПГ-1 и ВПГ-2). Их общими биологическими характеристиками являются: 1) способность вызывать латентные инфекции, 2) образовывать внутриядерные включения в чувствительных клетках и 3) убиквитарность распространения.
ВПГ-1 и ВПГ-2
История открытия. Впервые выделены В. Грютером в 1912 г. В 1919 г. А. Левенштейн повторно воспроизвел экспериментальную герпетическую инфекцию на кроликах. В 1921 г. Б. Липшютц описал видимые в световой микроскоп ацидофильные внутриядерные включения.
Особенности вирусов. Вирионы имеют диаметр 110-120 нм (рис. 1). Гомологичность последовательностей геномов ВПГ-1 и ВПГ-2 составляет 40-50 %. Геном кодирует более 50 полипептидов, включая минимум 9 гликопротеинов (А, B, C, D, E, F, G, H, I), 6 капсидных протеинов, вирусную протеинкиназу, ДНК-полимеразу, другие ферменты и ДНК-связывающие белки, участвующие в репликации.
Гликопротеины суперкапсида являются типоспецифическими антигенами, белки нуклеокапсида – группоспецифическими. Гликопротеины В и D являются основными антигенами и участвуют в прикреплении вируса к клетке; гликопротеин С связывает С3b-рецептор комплемента на клеточной поверхности; гликопротеины В, D и Н нарушают движение адсорбированного вируса с поверхности в цитоплазму клетки.
О собенностью
генома ВПГ-2 является то, что 5-конец гена
RR1(онкоген ВПГ-2) кодирует активность
протеинкиназы, отвечающей за неопластический
потенциал этого вируса. ДНК-последовательности
ВПГ-2 имеют бессмертные и неопластические
функции. Трансформированные клетки
человека вызывают опухоли, которые
экспрессируют вирусный онкопротеин,
когда их вводят атимическим мышам.
Мутации, которые инактивируют
протеинкиназную активность онкопротеина,
уменьшают неопластический потенциал,
а клеточная пролиферация и рост опухоли
ингибируются «бессмысленными»
олигонуклеотидами, которые угнетают
синтез онкопротеинов. У протеинкиназы
RR1 ВПГ-1 нет онкогенного потенциала.
Однако ВПГ-1 вызывает мутагенез и
амплификацию генов, активирует клеточные
гены и вызывает морфологическую
трансформацию. Мутации в онкогене могут
его как активировать, так и инактивировать.
К инактивации онкогена приводит также
образование нечитаемых участков
олигонуклеотидов в онкогене. Ранний
белок IPC47 регулирует специфический
иммунитет к герпесвирусам путем
интерференции с презентацией антигена
Т-цитотоксикам.
собенностью
генома ВПГ-2 является то, что 5-конец гена
RR1(онкоген ВПГ-2) кодирует активность
протеинкиназы, отвечающей за неопластический
потенциал этого вируса. ДНК-последовательности
ВПГ-2 имеют бессмертные и неопластические
функции. Трансформированные клетки
человека вызывают опухоли, которые
экспрессируют вирусный онкопротеин,
когда их вводят атимическим мышам.
Мутации, которые инактивируют
протеинкиназную активность онкопротеина,
уменьшают неопластический потенциал,
а клеточная пролиферация и рост опухоли
ингибируются «бессмысленными»
олигонуклеотидами, которые угнетают
синтез онкопротеинов. У протеинкиназы
RR1 ВПГ-1 нет онкогенного потенциала.
Однако ВПГ-1 вызывает мутагенез и
амплификацию генов, активирует клеточные
гены и вызывает морфологическую
трансформацию. Мутации в онкогене могут
его как активировать, так и инактивировать.
К инактивации онкогена приводит также
образование нечитаемых участков
олигонуклеотидов в онкогене. Ранний
белок IPC47 регулирует специфический
иммунитет к герпесвирусам путем
интерференции с презентацией антигена
Т-цитотоксикам.
В связи с тем, что ВПГ поражают даже неделящиеся клетки, способны персистировать, а их геном может принимать большой объем чужеродной ДНК, ВПГ-1 используется в качестве вектора.
Резистентность. Инактивируются при температуре выше 60˚С, жирорастворителями, рН<4; выдерживают температуру -256˚С в течение 20,5 ч. При 37˚С сохраняют жизнеспособность в течение 10 ч.
Культивирование.
Культивируются в куриных эмбрионах на
хорион-аллантоисной оболочке, где через
2-3 суток от момента заражения о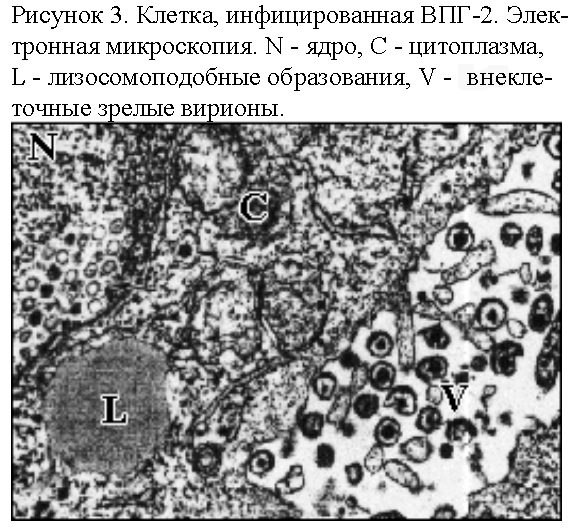 бразуют
белые выпуклые бляшки, видимые
невооруженным глазом. Хорошо размножаются
во всех типах клеточных культур. ЦПД
проявляется в образовании гигантских
многоядерных клеток, внутриядерных
телец-включений, лизисом клеток (рис.
3). К герпесвирусам чувствительны мыши,
крысы, морские свинки, хомяки, кролики,
кошки, собаки, обезьяны, птицы.
бразуют
белые выпуклые бляшки, видимые
невооруженным глазом. Хорошо размножаются
во всех типах клеточных культур. ЦПД
проявляется в образовании гигантских
многоядерных клеток, внутриядерных
телец-включений, лизисом клеток (рис.
3). К герпесвирусам чувствительны мыши,
крысы, морские свинки, хомяки, кролики,
кошки, собаки, обезьяны, птицы.
Эпидемиология. ВПГ-1 инфицировано 70-90 % людей, а ВПГ-2 – 15-50 %. Первичное инфицирование происходит в раннем возрасте, после исчезновения материнских антител. Источником инфекции являются больные люди и вирусоносители. Механизм передачи – перкутанный. Пути передачи для ВПГ-1 – контактно-бытовой (через слюну, посуду, губную помаду), для ВПГ-2 – половой, а также интранатальный (при прохождении плода через инфицированные родовые пути). При ВПГ-1-инфекции возможно трансплацентарное инфицирование плода.
Патогенез. Вирусы инфицируют эпителий слизистой оболочки рта, глотки или половых органов, где происходит их первичная репликация, которая сопровождается гибелью клеток с образованием везикул. Дальнейшее распространение герпесвирусов в организме человека происходит по чувствительным нервам, по лимфатическим и реже – кровеносным сосудам. Важными вторичными клетками-мишенями для герпесвирусов являются нейроны тройничного узла и спинномозговых ганглиев, головного мозга и клетки менингеальных оболочек. При генерализации инфекции у иммуноскомпрометированных лиц (больные СПИДом, опухолями, реципиенты донорских органов) возникает вирусемия с диссеминацией герпесвирусов во множество органов и развитием менингоэнцефалита, пневмонии, гепатита, коагулопатий.
Выздоровление при первичном инфицировании сопровождается латентной формой персистенции герпесвирусов в нервных ганглиях с почти полным иммунитетом от реинфицирования гомологичным типом и частичным иммунитетом от гетерологичного типа. Рецидивы латентной инфекции развиваются у части инфицированных в результате переохлаждения, избыточной инсоляции, стрессовых ситуаций и пр. Из нервных ганглиев герпесвирусы по центробежным нейронам достигают нервных окончаний, откуда проникают в эндотелий капилляров кожи и эпителиальные клетки. В них происходит репродукция герпесвирусов, что сопровождается возникновением эритематозных везикулопапул диаметром 1-2 мм. Везикулярная жидкость содержит большое количество вирионов. Через несколько дней везикулы подсыхают с образованием корочек, отпадающих без формирования рубцов.
ВПГ-1 способен индуцировать апоптоз в активированных лимфоцитах периферической крови, особенно в Т-хелперах, но не в Т-супрессорах. Это может лежать в основе иммуносупрессии и лимфоцитопении при ВПГ-1-инфекции. ВПГ-2 способен трансформировать нормальные эндотелиоциты в опухолевые.
Клиника. ВПГ-1 чаще вызывает инфекции ротоой полости и близлежащих тканей, ВПГ-2 – инфекции половой системы (табл. 1). Классическим проявлением ВПГ-1-инфекции является герпетический гингивостоматит, проявляющийся обширными болезненными везикулярными поражениями слизистой оболочки полости рта и сопровождающийся высокой температурой и увеличением подчелюстных лимфоузлов. Другими клиническими проявлениями ВПГ-1-инфекции являются конъюнктивит и кератит. Наиболее серьезной инфекцией, вызванной ВПГ-1, является спорадический энцефалит, уровень смертности при котором составляет 70 %.
Классическим проявлением первичной ВПГ-2-инфекции является генитальный герпес, который характеризуется двусторонними множественными поражениями кожи и слизистых оболочек половых органов, сопровождающимися повышением температуры тела, увеличением паховых лимфоузлов и дизурией. Манифестная ВПГ-инфекция в 85 % случаев вызывается ВПГ-2, в 15 % - ВПГ-1. В 99 % случаев генитальный герпес, вызванный ВПГ-2, рецидивирует. Наиболее опасным последствием генитального герпеса является инфицирование новорожденных.
Иммунитет. Естественный пассивный иммунитет против ВПГ-1 и ВПГ-2 обеспечивается антителами матери в течение первого полугода жизни. Наибольшая восприимчивость к герпетической инфекции у детей отмечается в возрасте до 2 лет. Приобретенный активный иммунитет не является стерильным и обеспечивается преимущественно специфическими секреторными Ig А. Наличие в организме антител и антигенспецифических Т-киллеров не препятствует персистенции герпесвирусов.
Лабораторная диагностика. Применяются вирусоскопический, вирусологический и серологический методы. Материалом для исследования служат соскобы с роговой оболочки, содержимое везикул, слюна, кровь, спинномозговая жидкость. Вирусоскопический метод с использованием световой микроскопии заключается в приготовлении мазков из свежих герпетических высыпаний, окрашивании их по Романовскому-Гимзе и выявлении многоядерных клеток, содержащих ацидофильные внутриядерные включения (тельца Липшютца). Люминесцентная микроскопия проводится с использованием иммунных противогерпетических сывороток.
Вирусологический метод включает выделение герпесвирусов в культурах клеток, куриных эмбрионах или на лабораторных животных (мыши, кролики). При культивировании на хорион-аллантоисной оболочке куриных эмбрионов ВПГ-2 образует более крупные бляшки, чем ВПГ-1. Индикацию вирусов проводят по ЦПД, идентификацию – в реакции нейтрализации на животных, куриных эмбрионах или клеточных культурах с использованием стандартных противогерпетических иммунных сывороток.
Серологический метод включает использование РСК и ИФА. Наличие в исследуемой сыворотке специфических Ig М свидетельствует об острой первичной инфекции, наличие Ig G – об обострении хронической инфекции.
Лечение. Используются: 1) химиопрепараты-ингибиторы вирусных ферментов: ацикловир (зовиракс) – ингибитор рибонуклеотидной редуктазы; аденинарабинозид – ингибитор синтеза ДНК, фосковир – ингибитор ДНК-полимеразы; 2) α-интерфероны; 3) индукторы продукции эндогенного интерферона. Интерферон и его индукторы наиболее эффективны в репродуктивном цикле герпесвирусной инфекции. В тяжелых случаях, а также при частых рецидивах, для лечения герпесвирусной инфекции используют убитую культуральную герпетическую вакцину. Резистентные к химиотерапии вирусы образуются в результате мутаций генов, кодирующих тимидинкиназу или ДНК-полимеразу.
Профилактика. Неспецифическая профилактика включает противоэпидемические мероприятия, применяемые при ликвидации инфекций наружных покровов (см. главу «Эпидемиология вирусных инфекций»).
При риске интранатального заражения плода показано проведение операции кесарева сечения.
В США разработаны и используются в течение последних 15 лет генно-инженерные и субъединичные герпесные вакцины, полученные из ВПГ-1 и ВПГ-2. Разработана также живая генно-инженерная вакцина, состоящая из ВПГ-2, у которых делетированы онкогены, а сам вирусный штамм ослаблен при выращивании на культурах клеток.
§ 3. Род Varicellovirus.
Патогенным для людей представителем рода является вирус герпеса человека типа 3 (ВГЧ-3, синоним: вирус Varicella zoster).
ВГЧ-3
История открытия. Возбудитель открыт бразильским врачом Э. Арагао в 1911 г., обнаружившим в содержимом пузырьков элементарные тельца вируса.
О собенности
вируса. Вирион
диаметром 150-200 нм. Икосаэдрический
капсид окружен тегументом и суперкапсидом,
состоящим из 2 и более оболочек (рис. 4).
Геномная ДНК состоит из 125*103
пар нуклеотидов. Геном может существовать
в виде 4 изомеров (2 больших – в 95 % случаев
или 2 малых – в 5 %). Геном кодирует не
менее 30 структурных и неструктурных
белков, включая минимум 5 гликопротеинов,
которые обозначают латинскими буквами
от I
до V.
Они являются аналогами гликопротеинов
Е, В, Н, G
и С вирусов простого герпеса. Гликопротеины
участвуют в прикреплении вирусов и
пенетрации клеток и все являются
антигенами. Неструктурные белки менее
иммуногенны. Различий в геномах ВГЧ-3 -
возбудителей ветряной оспы и опоясывающего
лишая не выявлено.
собенности
вируса. Вирион
диаметром 150-200 нм. Икосаэдрический
капсид окружен тегументом и суперкапсидом,
состоящим из 2 и более оболочек (рис. 4).
Геномная ДНК состоит из 125*103
пар нуклеотидов. Геном может существовать
в виде 4 изомеров (2 больших – в 95 % случаев
или 2 малых – в 5 %). Геном кодирует не
менее 30 структурных и неструктурных
белков, включая минимум 5 гликопротеинов,
которые обозначают латинскими буквами
от I
до V.
Они являются аналогами гликопротеинов
Е, В, Н, G
и С вирусов простого герпеса. Гликопротеины
участвуют в прикреплении вирусов и
пенетрации клеток и все являются
антигенами. Неструктурные белки менее
иммуногенны. Различий в геномах ВГЧ-3 -
возбудителей ветряной оспы и опоясывающего
лишая не выявлено.
Резистентность. Чувствителен к жирорастворителям.
Культивирование. Культивируется в клеточных культурах легких, почек и фибробластов эмбриона человека с образованием внутриядерных включений и агрегацией хроматина в «псевдоядрышки», остановкой деления клеток в метафазе, сморщиванием и разрывом хромосом (рис. 5). ВГЧ-3 не размножается в организме лабораторных животных (кролики, мыши) и на хорион-аллантоисной оболочке куриного эмбриона.
Эпидемиология. Инфицирование ВГЧ-3 составляет 100 %, что происходит преимущественно в детском возрасте при развитии ветряной оспы. Источник инфекции – больной человек или вирусоноситель. Механизм передачи – аэрогенный, реализуемый воздушно-капельным путем при экзогенной инфекции. При эндогенной инфекции имеет место реактивация персистирующих вирусов. Возможно трансплацентарное инфицирование плода.
П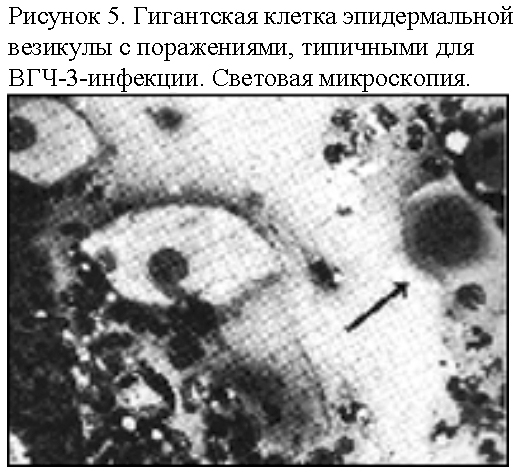 атогенез.
Местом внедрения и первичного размножения
вирусов является эпителий слизистой
оболочки верхних дыхательных путей.
Репликация вирусов происходит также в
регионарных лимфатических узлах, откуда
вирусы лимфогенным путем проникают в
кровь, а с ней – в кожу. ВГЧ-3 поражают
клетки шиповатого слоя эпидермиса,
вызывают их набухание, дегенерацию и
лизис. В результате этого образуются
пузырьки, наполненные жидкостью, в
которых содержатся вирионы. У части
больных происходит инфицирование клеток
спинальных ганглиев с развитием в
последних персистирующей инфекции.
Массовое поражение чувствительных
клеток имеет место у лиц с иммунодефицитом.
У лиц, страдающих опоясывающим лишаем,
рецидивы заболевания развиваются на
фоне развивающегося иммунодефицита
или повторном экзогенном инфицировании.
атогенез.
Местом внедрения и первичного размножения
вирусов является эпителий слизистой
оболочки верхних дыхательных путей.
Репликация вирусов происходит также в
регионарных лимфатических узлах, откуда
вирусы лимфогенным путем проникают в
кровь, а с ней – в кожу. ВГЧ-3 поражают
клетки шиповатого слоя эпидермиса,
вызывают их набухание, дегенерацию и
лизис. В результате этого образуются
пузырьки, наполненные жидкостью, в
которых содержатся вирионы. У части
больных происходит инфицирование клеток
спинальных ганглиев с развитием в
последних персистирующей инфекции.
Массовое поражение чувствительных
клеток имеет место у лиц с иммунодефицитом.
У лиц, страдающих опоясывающим лишаем,
рецидивы заболевания развиваются на
фоне развивающегося иммунодефицита
или повторном экзогенном инфицировании.
Клиника. Инкубационный период при ветряной оспе (Varicella) составляет 10-20 дней, при опоясывающем лишае (Herpes zoster) – неизвестен. Ветряная оспа развивается остро (в течение 24 ч) с подъема температуры, недомогания, появления везикулопапулезной сыпи на лице, затем на туловище и конечностях. Сыпь появляется этапно, с возникновением новых элементов на ранее пораженных участках кожи. Везикулы вскрываются с образованием корочек, отторгающихся на 7 день без образования рубца при отсутствии вторичного бактериального инфицирования. У взрослых ветряная оспа протекает тяжелее, чем у детей, с возможным развитием осложнений (энцефалит, пневмония).
После перенесенной ветряной оспы у части людей может развиться опоясывающий лишай. Заболевание характеризуется лихорадкой, выраженными болями в области слизистых оболочек или кожи, иннервируемых одной или несколькими группами спинальных ганглиев. Через несколько дней на туловище по ходу межреберных нервов, реже – на коже головы или шеи появляются пузырьки, инволюция которых включает образование корочек.
Иммунитет. Пассивный естественный иммунитет в организме ребенка создают антитела, получаемые с материнским молоком. При циклической инфекции развивается стойкий пожизненный иммунитет, обусловленный клеточными и гуморальными факторами. При ациклическом течении инфекционного процесса иммунная система не обеспечивает полного освобождения организма от возбудителя.
Лабораторная диагностика. Проводится с использованием вирусоскопического, вирусологического, серологического и молекулярно-генетического методов. Материалом для исследования являются содержимое везикул, кровь, спинномозговая жидкость. Вирусоскопический метод проводится с использованием электронной и люминесцентной микроскопии. При световой микроскопии в ядрах пораженных клеток выявляются элементарные тельца Арагао. Вирусологическое исследование осуществляют на клеточных культурах с последующей идентификацией вирусов в РСК и РН. При серологическом методе исследуются парные сыворотки в РН, РСК и ИФА (при острой инфекции определяются Ig М, при хронической – Ig G). У больных опоясывающим лишаем применяется ПЦР.
Лечение. Используются человеческий γ-глобулин и химиопрепарат – ацикловир. Показано применение интерферонов и их индукторов.
Профилактика. Неспецифическая профилактика включает противоэпидемические мероприятия, применяемые при ликвидации капельных инфекций (см. главу «Эпидемиология вирусных инфекций»).
Специфическая профилактика проводится иммуноглобулином и живой аттенуированной вакциной Varicella-zoster. Иммуноглобулин защищает серонегативных лиц, даже если он введен после 4 дней от момента заражения. Показаниями к иммуноглобулинопрофилактике являются: 1) тесный недавний контакт с больными ветряной оспой и опоясывающим лишаем; 2) отсутствие перенесенной ветряной оспы в анамнезе; 3) категории лиц высокого риска (новорожденные, беременные, люди с врожденным или приобретенным клеточным иммунодефицитом.
С 1995 г. используется живая аттенуированная вакцина Varicella-zoster (штамм ОКА). Вакцинации подлежат все дети и не болевшие ветряной оспой взрослые. Поствакцинальный иммунитет преимущественно гуморального типа. Вакцинацию можно комбинировать с использованием иммуноглобулина.
§ 4. Род Cytomegalovirus.
В род входит несколько видов вирусов, из которых 1 – цитомегаловирус – ЦМВ патогенен для человека. ЦМВ имеет синонимы: вирус герпеса человека типа 5 - ВГЧ-5 и вирус слюнных желез. Название вируса происходит от латинских слов – cytos клетка, megas - громадный, и virus – вирус.
ВГЧ-5
История открытия. Впервые выделен в 1956 г. из культуры фибробластов К. Смитом.
Особенности вируса. Диаметр вириона 230 нм, капсида – 110-120. Капсид образован 4 основными видами белков. Отмечается большое количество дефектных вирионов и наличие сферических вирусов, которые называют «плотными тельцами». Суперкапсид трехслойный (10 нм), образован минимум 10 белками. Гликопротеин В суперкапсида отличается от аналогичных у других герпесвирусов, определяет тропизм ЦМВ к лимфоцитам и клеткам-предшественникам красного мозга; а также вирулентность. Тегумент слабо структурирован, толщиной 50 нм, состоит из 6 белков. Геномная ДНК состоит из 235*103 пар нуклеотидов. Геном кодирует ферменты: протеинкиназу, ДНК-полимеразу, ДНКазу, топоизомеразу II.
Резистентность. Инактивируется нагреванием (при 65˚С – в течение 30 минут), низкими значениями рН, эфиром, ультрафиолетовыми лучами, ультразвуком, многократными замораживаниями и оттаиваниями.
Культивирование. Используются первичные культуры фибробластов кожи и легкого эмбриона человека, миоцитов, диплоидные клетки W1-38. ЦПД проявляется через несколько недель и выражается образованием гигантских (25-40 нм) округлых клеток, содержащих 1-2 базофильных внутриядерных тельца-включения, примыкающих к ядерной мембране. Пространство между включением и ядерной мембраной остается просветленным, что придают инфицированной клетке вид «совиного глаза» (рис. 6). Возможно образование эозинофильных внутрицитоплазматических телец-включений, а также инфицирование тканей без морфологических изменений. ЦМВ выделяется в культуральную среду в незначительных количествах.
Эпидемиология. Источник инфекции – больной человек или вирусоноситель. Возбудитель передается несколькими механизмами: 1) перкутанным (половой, парентеральный, контактно-бытовой, алиментарный пути; при прохождении через инфицированные родовые пути); 2) аэрогенным (воздушно-капельный путь); 3) наследственным (трансплацентарный путь). Инфицированность детей в возрасте 10 лет составляет 100 %. ЦМВ выделяется в окружающую среду со слюной, цервикальным секретом, спермой, материнским молоком, мочой.
П атогенез.
ЦМВ поражает практически все органы и
ткани, проявляя преимущественную
тропность к слюнным железам. В зависимости
от механизма и путей передачи первично
поражаются эпителий слизистых оболочек,
кожи и слюнных желез, где происходит
начальная репродукция ЦМВ. Вследствие
тропизма ЦМВ к лимфоцитам происходит
их инфицирование и занос возбудителя
в кровь и внутренние органы, в которых
происходит дальнейшее его размножение.
Инфицирование клеток сопровождается
развитием персистенции ЦМВ, преимущественно
латентного типа. При трансплацентарном
инфицировании поражаются печень,
селезенка, легкие, центральная нервная
система, почки. Предрасполагающим
фактором ЦМВ-инфекции является
иммунодефицитное состояние. Развитие
заболевания сопровождается формированием
гиперсупрессорного варианта иммунодефицита.
атогенез.
ЦМВ поражает практически все органы и
ткани, проявляя преимущественную
тропность к слюнным железам. В зависимости
от механизма и путей передачи первично
поражаются эпителий слизистых оболочек,
кожи и слюнных желез, где происходит
начальная репродукция ЦМВ. Вследствие
тропизма ЦМВ к лимфоцитам происходит
их инфицирование и занос возбудителя
в кровь и внутренние органы, в которых
происходит дальнейшее его размножение.
Инфицирование клеток сопровождается
развитием персистенции ЦМВ, преимущественно
латентного типа. При трансплацентарном
инфицировании поражаются печень,
селезенка, легкие, центральная нервная
система, почки. Предрасполагающим
фактором ЦМВ-инфекции является
иммунодефицитное состояние. Развитие
заболевания сопровождается формированием
гиперсупрессорного варианта иммунодефицита.
Клиника. Первичные ЦМВ-инфекции являются субклиническими. Редко они могут манифестировать в виде ЦМВ-мононуклеоза (заболевания, сходного с инфекционным мононуклеозом, кроме негативности гетерофильных антител). У иммуноскомпрометированных лиц ЦМВ часто вызывает острые заболевания: ретинит, пневмонию и гастроэнтерит. Врожденная ЦМВ-инфекция обычно проявляется полиорганными поражениями (гепатит, тромбоцитопеническая пурпура, пневмония, микроцефалия, атрофия зрительного нерва, хориоретинит и др.).
Иммунитет нестерильный, носит преимущественно гуморальный характер: в сыворотке циркулируют комплементсвязывающие и вируснейтрализующие антитела.
Лабораторная диагностика. Материалом для исследования являются слюна, моча, кровь, соскобы со слизистых оболочек и пр. Используются вирусоскопический (световая, люминесцентная, электронная микроскопия), вирусологический, серологический (РСК, РПГА, РН, ИФА) и молекулярно-генетический методы (ПЦР).
Лечение. Для лечения ЦМВ-ретинита используются химиопрепараты, ингибирующие синтез вирусной ДНК – ганцикловир и фоскарнет. Показаны интерфероны.
Профилактика. Вакцины не разработаны. Неспецифическая профилактика включает противоэпидемические мероприятия, применяемые при ликвидации инфекций наружных покровов, а также капельных инфекций (см. главу «Эпидемиология вирусных инфекций»).
§ 5. Род Roseolovirus.
Патогенными для человека представителями рода являются ВГЧ-6A, ВГЧ-6B, ВГЧ-7, вызывающие заболевания, сопровождающиеся сыпью.
ВГЧ-6
История открытия. ВГЧ-6 впервые изолирован Салахуддиным и коллегами в 1986 г. от больного с лимфопролиферативными нарушениями и был назван В-лимфотропным вирусом человека.
Особенности вируса. Основной отличительной чертой от других герпесвирусов является четкая структурированность тегумента. Геномная ДНК состоит из 159*103 пар нуклеотидов. Геном содержит более 100 отдельных генов, кодирующих белки, наиболее значимыми из которых являются гликопротеины В, Н, М и L. Имеется около 100 открытых рамок считывания.
ВГЧ-6 классифицируют на варианты А и В, различающиеся по биологическим, иммунологическим, эпидемиологическим и молекулярным свойствам. Были выделены варианты, а не различные виды, поскольку различия в геномах составляют 4-10 %. ВГЧ-6 (особенно вариант А) является вирусом-помощником для адено-ассоциированного вируса второго типа, так как кодирует гомолог гена, необходимого для репликации ДНК последнего, а также активность АТФ-зависимой эндонуклеазы и геликазы.
Резистентность. Аналогична таковой для других герпесвирусов.
Культивирование. Лучше всего культивируются в активированных первичных Т-лимфоцитах и в Т-клеточных линиях.
Эпидемиология. Естественный хозяин – человек и некоторые виды обезьян. Антитела выявляются у 90 % детей старше 2 лет. Вирусы выделяются в окружающую среду со слюной. Основной механизм передачи – аэрогенный, реализуемый воздушно-капельным путем; дополнительный механизм – перкутанный, воспроизводимый путем бытовых контактов. ВГЧ-6В проникает через гематоплацентарный барьер, вызывая врожденный гепатит.
Патогенез. Инфицируют лимфатические узлы, лимфоциты, макрофаги, моноциты, эндотелиоциты канальцев почек, слюнные железы, нейроны и олигодендроциты головного мозга. ВГЧ-6 являются этиологическими агентами или компонентами патогенеза многих клинических заболеваний, включая рассеянный склероз и синдром хронической усталости.
Клиника. Обычно ВГЧ-6-инфекции протекают субклинически. ВГЧ-6В является возбудителем эритемы субитум (легкого острого инфекционного экзантемного заболевания, у детей), реже – гепатита и мононуклеоза.
Эритема субитум (розеола инфантум или шестое заболевание) имеет инкубационный период 10 дней. Заболевание длится 3-5 дней, проявляется лихорадкой, симптомами поражения дыхательных путей, лимфоаденопатией. Через 48 ч после начала лихорадки на теле и шее появляется макулопапулярная сыпь. Выздоровление не сопровождается развитием осложнений.
ВГЧ-6В в качестве первичной инфекции могут вызывать: нарушение функции печени, гепатоспленомегалию, смертельный и несмертельный фулминантный гепатит, неврологические осложнения, тромбоцитопению, тромбоцитопеническую пурпуру, смертельный и несмертельный гематофагоцитарный синдром. Редко возникают энцефалит (вплоть до развития эпилепсии), менингоэнцефалит и асептический менингит.
У лиц с дефектами иммунитета ВГЧ-6В вызывает пневмонию, энцефалит и диссеминированное поражение. С ВГЧ-6А не связывается возникновение какого-либо заболевания.
Иммунитет преимущественно гуморальный, о клеточном практически ничего не известно.
Лабораторная диагностика. Используются вирусоскопический, вирусологический, серологический (ИФА и иммуноблоттинг) и молекулярно-биологический методы (ПЦР).
Лечение. Используются химиопрепараты, ингибирующие синтез вирусной ДНК – ганцикловир и фоскарнет. Показаны интерфероны.
Профилактика. Неспецифическая.
ВГЧ-7
История открытия. Впервые описан Френкелем и соавторами в 1990 г., выделившими его из Т-хелперов здорового человека.
Особенности вируса. Геномная ДНК состоит из 145*103 пар нуклеотидов. Геном содержит более 100 отдельных генов, кодирующих белки, в том числе гликопротеины В, Н, М и L. Имеется около 100 открытых рамок считывания. Геном кодирует около 30 ферментов, участвующих в репликации ДНК, в том числе: ДНК-полимеразу, редуктазу, фосфотрансферразу, геликазу, тимидинкиназу, урацил-ДНК-гликозилазу.
Резистентность. Аналогична таковой для других герпесвирусов.
Культивирование. Вирусы выделяют на активированных первичных Т-лимфоцитах и в Т-клеточных линиях.
Эпидемиология. Естественный хозяин – человек. Вирусы выделяются в окружающую среду со слюной у 75 % клинически здоровых взрослых, что является наиболее распространенным путем передачи от матерей к детям при бытовом контакте. Возбудители передаются аэрогенным и перкутанным механизмами. Вирусы проникают через гематоплацентарный барьер, но врожденных инфекций не вызывают.
Патогенез. Слюнные железы человека являются единственным известным персистирующим продуцентом инфекционных ВГЧ-7. Вирусы также проявляют тропизм к Т-хелперам, которые имеют специфический рецептор для ВГЧ-7.
Клиника. ВГЧ-7 также являются возбудителями эритемы субитум
Иммунитет. Преимущественно гуморальный.
Лабораторная диагностика. Используются вирусоскопический, вирусологический, серологический (ИФА, иммуноблоттинг) и молекулярно-биологический методы (ПЦР).
Лечение. Используются ингибиторы синтеза вирусной ДНК – ганцикловир и фоскарнет. Показаны интерфероны.
Профилактика. Неспецифическая.
§ 6. Род Lymphocryptovirus.
Патогенным для человека представителем рода является вирус Эпштейна-Барра (ВЭБ), имеющий синоним вирус герпеса человека 4 типа (ВГЧ-4).
ВГЧ-4
История открытия. Впервые были выделены в 1964 г. английским вирусологом М. Эпштейном и канадским вирусологом И. Барром из биоптатов лимфомы Беркетта.
Особенности вируса. Вирион имеет размер 120 нм, капсид – 100 нм. Тегумент тонкий, аморфный. Геномная ДНК состоит из 172*103 пар нуклеотидов и существует в 2 формах: линейной (в зрелых вирионах) и циркулярной эписомальной (в латентно инфицированных клетках). Антигенно ВЭБ отличается от других герпесвирусов. Штаммы ВЭБ классифицируют на 2 типа (1 и 2 или А и В), причем тип А является превалирующим. Типы выделены на основании различий в последовательностях генов, экспрессируемых при латентной инфекции, которые кодируют белки 2 и 3 ядерного антигена ВЭБ (EBNA – Epstein-Barr nuclear antigen). Геном кодирует около 90 генов, 12 из которых различно экспрессируются во время латентной (непродуктивной) инфекции. Остальные гены кодируют белки, которые экспрессируются исключительно во время вирусного репликативного цикла. Геном кодирует несколько белков литического цикла, которые прямо не участвуют в продукции инфекционного вируса, но влияют на внутри- и внеклеточную среду, усиливая эффективность репликации или выраженность инфекционного процесса, нарушая иммунный ответ хозяина. Примером гена, который может улучшать репликацию ВЭБ, является ВНRF1, который кодирует гомолог клеточного белка BCL-2, способного угнетать апоптоз. Во время литического цикла ВЭБ экспрессирует минимум 3 гена, способных модулировать иммунный ответ хозяина. Два из них кодируют гомологи интерлейкина-10 и рецептора колониестимулирующего фактора; третий - гликопротеин 42, играющий важную роль в инфицировании В-лимфоцитов при взаимодействии с рецептором HLA-DR. Белок – продукт гена LMP-1 самостоятельно может индуцировать трансформацию клеток.
Резистентность. Аналогична таковой для других герпесвирусов.
Культивирование возможно только в В-лимфоцитах человека и приматов. Инфицирование лимфоцитов ВЭБ приводит к их трансформации в лимфобластоидные клетки, способные продолжительно расти в культурах. Штаммы типа А имеют больший трансформирующий потенциал. В инфицированном В-лимфоците может образоваться стандартное для ВЭБ количество эписом – 10-100, которые, однако, не способствуют репликации вируса.
Эпидемиология. Инфицированность взрослых составляет 80-90 %. ВЭБ выделяется в окружающую среду со слюной. Источник инфекции – больной человек и вирусоноситель. Механизмы передачи инфекции - аэрогенный (воздушно-капельный путь) и перкутанный (преимущественно контактно-бытовой и половой пути, реже - парентеральный). В отдельных случаях трансплацентарным путем реализуется наследственный механизм передачи.
Патогенез. При инфекционном мононуклеозе ВЭБ инфицируют лимфоидные и эпителиальные клетки носоглотки, где происходит первичная репродукция вирусов. Затем инфицируются В-лимфоциты, циркулирующие около первичного очага, поскольку на них имеются рецепторы СR2 (CD21), и рецепторы к С3d-компоненту комплемента, которые связывают вирус. Дальнейшее размножение ВЭБ происходит в лимфатических узлах, что вызывает их увеличение. Из лимфатических узлов возбудители попадают в кровь, печень и селезенку, вызывая в них воспаление. ВЭБ-трансформированные В-лимфоциты являются мощными активаторами Т-лимфоцитов, что приводит к развитию лимфопролиферации при инфекционном мононуклеозе; а также выделяют патологически измененные иммуноглобулины. Инфицированные В-лимфоциты поражают отдаленные лимфоидные и паренхиматозные органы, в которых образуются очаги лимфопролиферации. Т-лимфоциты, активированные ВЭБ-инфицированными В-лимфоцитами, в свою очередь, разрушают клетки-активаторы, в результате чего развивается воспаление. Инфекционный мононуклеоз является самоограничивающимся заболеванием, затрагивающим, в основном, лимфоидные органы (исключение – печень).
Реактивация ВЭБ-инфекции теоретически возможна, однако клинические признаки реактивации не определены. У подавляющего большинства ВЭБ-инфицированных лиц инфекция протекает латентно, что может вызвать опухолевую трансформацию пораженных клеток. Каждый ВЭБ-трансформированный В-лимфоцит содержит несколько сотен геномов вируса и продукты ранних генов. Ключевыми ранними продуктами являются ВЭБ-ассоциированные ядерные антигены (имеющие афинность к ДНК клетки-хозяина) и латентный белок оболочки. При лимфомах Беркетта онкогенез обусловлен мутациями в 2, 8, 14 и 22 хромосомах, возникающих при интеграции генома ВЭБ в ДНК пораженной клетки. Продукция первого ядерного антигена ВЭБ ведет к активации клеточного протоонкогена c-myc и опухолевой трансформации. При неберкеттовских лимфомах имеет место преимущественная продукция второго и пятого ядерных антигенов, а также первого и второго латентных белков оболочки. Эти белки активируют G1-циклин, делая клетки практически бессмертными. Первый и второй латентные белки оболочки активируют Са2+/кальмодулин-зависимую протеинкиназу, стимулируют синтез интерлейкина-10 и активируют рецепторы к некоторым факторам роста, что, в конечном итоге, приводит к трансформации В-лимфоцитов. Второй латентный белок оболочки проявляет свойства тирозинкиназы и предположительно обусловливает фосфорилирование рецепторов к эпидермальному фактору роста, что повышает чувствительность клеток к его действию.
Клиника. ВЭБ способен вызывать инфекционный нуклеоз; индуцировать волосатоклеточную лейкоплакию, назофаригеальную карциному, африканскую лимфому Беркетта, карциному слюнных желез, болезнь Ходжкина и синдром хронической усталости, синдром Дункана.
Инфекционный мононуклеоз характеризуется острым началом, лихорадкой, слабостью, недомоганием, увеличением шейных лимфатических узлов, ангиной, увеличением печени и селезенки, моноцитозом и появлением в крови атипичных мононуклеаров.
Лимфома Беркетта бывает эндемической (ВЭБ выявляется в 95 % случаев) и спорадической (20 % случаев). Спорадическая форма проявляется односторонним увеличением слюнной железы; эндемическая – мультифокальными поражениями слюнных желез, печени, почек и кишечника.
Иммунитет обусловлен клеточными и гуморальными факторами. В крови переболевших инфекционным мононуклеозом циркулируют антитела к капсидному антигену сначала класса Ig М, затем – класса Ig G (рис. 7). Позднее появляются пожизненно сохраняемые антитела к ранним антигенам МА (мембранный антиген), ЕВNA1, EBNA2, EBNA3A, EBNA3B (табл. 2). При выздоровлении появляются также Т-клетки памяти, которые уничтожают зараженные вирусом В-лимфоциты после их рестимуляции.
Лабораторная
диагностика.
Используются вирусоскопический
(световая, электронная, люминесцентная
микроскопия); вирусологический,
серологический (ИФА) и молекулярно-генетический
(ПЦР) методы. При световой микроскопии
в периферической крови больных
инфекционным мононуклеозом выявляются
крупные атипичные мононуклеары,
 содержание
которых может достигать 10-15 % и более.
содержание
которых может достигать 10-15 % и более.
Таблица 2
Появление антител при ВЭБ-инфекции
Антитело/антиген |
Наличие антител |
||||||
Неимунные лица |
Инфекция |
Реактивация инфекции |
Лимфома Беркетта |
Назофарингеальная карцинома |
|||
Текущая первичная |
Недавно перенесенная первичная |
Перенесенная в прошлом |
|||||
IgM-VCA |
- |
+ |
- |
- |
- |
- |
- |
IgG-VCA |
- |
+ |
+ |
+ |
+ |
++ |
++ |
IgA-VCA |
- |
+ или - |
- |
- |
- |
- |
++ |
IgG- EA/D |
- |
+ |
+ |
- |
+ или - |
- |
++ |
IgA-EA/D |
- |
- |
- |
- |
Неизвестно |
- |
++ |
IgG-EA/R |
- |
+ или - |
+ или - |
- |
+ или - |
++ |
+ или - |
Анти-EBNA |
- |
- |
Низкий титр |
+ |
+ |
+ |
++ |
Примечание. VCA – вирусно-капсидный антиген, ЕА – ранний антиген, EBNA – ядерный антиген. «-» - негативный (<1:10), «+» – позитивный (>1:10).
Лечение. При хронической активной ВЭБ-инфекции показано применение интерлейкина-2 и ацикловира в высоких дозах.
Профилактика. Разработана генно-инженерная вакцина на основе осповакцины, содержащая ВЭБ-гликопротеин. Неспецифическая профилактика аналогична мероприятиям, проводимым при ВПГ-инфекции.
§ 7. Род Rhadinovirus.
Вирус герпеса человека 8 типа (ВГЧ-8)
История открытия. ВГЧ-8 был впервые выделен и связан с возникновением саркомы Капоши в 1994 г. у больного СПИДом. Саркома Капоши была описана в 1872 г. Морисом Капоши.
Особенности вируса. Существует 3 варианта вируса. Геномная ДНК состоит из 250*103 пар нуклеотидов, включает вирусные структурные и функциональные гены, а также гены, захваченные из клетки-хозяина. К продуктам последних относятся: 1) регуляторный протеин клеточного цикла (циклин-D), активирующий клеточные киназы; 2) апоптоз-блокирующий ген (bсl-подобный); 3) 14 клеточных «молчащих» генов (цитокины, β-хемокины, рецепторы к комплементу, ген синтеза интерферона); 4) литический ядерный антиген, связанный с латентностью; 5) белок сигнальной трансдукции (интерлейкин-6); 6) рецептор к интерлейкину-8.
Резистентность. Аналогична таковой для других герпесвирусов.
Культивирование. Используются В-лимфоциты, моноциты, эндотелиоциты человека.
Эпидемиология. Источник инфекции – больной человек или вирусоноситель. Механизм передачи – перкутанный, реализуемый преимущественно половым путем. Не исключен аэрогенный механизм передачи, поскольку ВГЧ-8 выделяется в окружающую среду с мокротой. При саркоме Капоши антитела к ВГЧ-8 выявляются в 90-100 % случаев; у взрослых, больных СПИДом – в 30 %, у здоровых доноров – в 1-5 %. Выделяют 2 вида саркомы Капоши: средиземноморскую и эндемическую африканскую.
Патогенез. Поражаются эндотелиоциты сосудов, В-лимфоциты и моноциты периферической крови. В клетках саркомы Капоши вирус латентен, в моноцитах происходит репликация с лизисом клеток. Опухоль представлена веретенообразными клеточными элементами – производными эндотелиоцитов, фибробластов или моноцитов. Саркома Капоши может быть поли- или моноклональной (например, Т-моноклональной). Развитие саркомы происходит на фоне иммунодефицита. ДНК ВГЧ-8 при саркоме Капоши обнаруживается в 100 % случаев.
При эндемической африканской форме саркомы кофактором к ВГЧ-8-инфицированию является малярия, а при средиземноморской форме ВГЧ-8 выступает основным этиологическим агентом, активируя белок tat.
Клиника. ВГЧ-8-инфекция проявляется развитием В-клеточных лимфом брюшной полости, ангиосаркомы Капоши, болезни Кастльмана и полостных лимфом.
Саркома Капоши – это мультифокальное поражение кожи, слизистой оболочки ротовой полости, пищеварительного тракта и плевры. Инкубационный период – 3-10 лет. Средиземноморская форма саркомы Капоши чаще развивается у мужчин пожилого возраста на ногах (от бляшек до узлов) в течение нескольких лет. Очаги поражения – синюшного цвета, пещеристой структуры. Африканская эндемическая форма саркомы Капоши развивается у жителей Африки и у иммуносупрессированных лиц (реципиентов органов, больных СПИДом).
Иммунитет мало изучен, гуморального и клеточного типов.
Лабораторная диагностика. ПЦР и LANA (latency associated nuclear antigen – ядерный антиген, связанный с латентностью, аналог EBNA).
Лечение. Показаны интерфероны α и β, фоскарнет, ганцикловир, циклофовир, ингибиторы протеаз, элиминирующие ВГЧ-8 из крови.
Профилактика. Вакцины не разработаны, неспецифическая профилактика аналогична мероприятиям, проводимым при ВПГ-инфекции.
Церкопитековый (обезьяний) вирус герпеса типа В (Herpesvirus saimiri).
История открытия. Биологические свойства В-вируса описаны Витли (1986 г.) и Вейглером (1991 г.). Старое название вируса – Herpesvirus simiae. Синонимы – В-вирус, церкопитековый вирус герпеса 1.
Особенности вируса. Геномная ДНК состоит из 145-165*103 пар нуклеотидов. Геном может существовать в 2 формах – М и Н, М-геномы инфекционны, а Н – высоко дефективны.
Резистентность. Чувствителен к жирорастворителям, кислой рН и детергентам. При 37˚С сохраняется 7 дней, при 4˚С – несколько недель, при -70˚С очень стабилен.
Культивирование. Культивируется на первичных клеточных культурах почек кролика и обезьян, а также на НеLа. Цитопатический эффект типичный для большинства герпесвирусов. К вирусу чувствительны мышата-сосунки.
Эпидемиология. Является индигенным для азиатских обезьян-макак. Источник инфекции – больные обезьяны. Механизмы передачи – перкутанный (посттравматический путь) и аэрогенный (воздушно-капельный путь). Вирус у человека способен вызывать опасные (угрожающие жизни) поражения центральной нервной системы. Вирус может передаваться через укусы обезьян; прямым и непрямым путем со слюной и даже при работе с культурами клеток обезьян.
Клиника. Инкубационный период составляет от 3-6 дней до 6 недель, после чего у человека в месте инокуляции вируса может развиться краснота, болезненность, появиться везикулы (в том числе и на слизистых оболочках), лимфоаденопатия. Проявлениями инфекции могут быть пневмония, понос, боль в животе, фарингит, лимфоцитарный плеоцитоз. При отсутствии лечения развиваются восходящий миелит и энцефалопатия, летальность – 75 %, у выживших сохраняются симптомы тяжелых мозговых поражений.
Иммунитет клеточного и гуморального типов, мало изучен.
Лабораторная диагностика. Используется вирусологический, серологический и молекулярно-генетический (ПЦР) методы. Материалом для исследования являются везикулярная жидкость, носоглоточные смывы, смывы с кожи и конъюнктивы, кровь, спинномозговая жидкость, трупный материал. Выделение вирусов проводят в культуре клеток или внутримозговым заражением мышат-сосунков с последующей идентификацией в РСК или РН. Серологический метод исследования позволяет выявить в крови больных вирусоспецифические антитела в РСК, РН, ИФА.
Лечение. Используется ацикловир. Показаны α- и β-интерфероны.
Профилактика. Специфическая профилактика не разработана. Неспецифическая профилактика проводится согласно мероприятиям, используемым при капельных инфекциях и инфекциях наружных покровов.
