- •Ответы на вопросы.
- •8) Строение атома по Бору:
- •1.Концестрация – равновесие смещается в сторону меньшей концентрации .
- •2.Температура – при повышении температуры равновесие смещается в сторону эндотермической реакции , а при понижении – экзотермической реакции .
- •1.В комплексном соединении сначала называется анион затем катион
- •2.Во внутренней координационной сфере сначала указывается количество легандов с помощью греческих числительных
- •1.1. Комплексообразователь
- •1.2. Лиганды
- •1.3. Дентатность лиганда
- •1.4. Координационное число
- •1.5. Внутренняя и внешняя сфера комплексного соединения
- •1.6. Многоядерные комплексы
- •1.Магнитные вещества –вещества частицы которых содержат не спаренные электроны в следствии чего втягиваются во внешнее электромагнитное поле.
- •2.Демагнитые вещества – вещества частицы которых не содержат не спаренные электроны , поэтому выталкиваются из внешнего электронного поля .
- •Вопрос 46.
- •Вопрос 47.
- •Вопрос 48.
- •Вопрос 49.
- •Вопрос 50.
1.Магнитные вещества –вещества частицы которых содержат не спаренные электроны в следствии чего втягиваются во внешнее электромагнитное поле.
2.Демагнитые вещества – вещества частицы которых не содержат не спаренные электроны , поэтому выталкиваются из внешнего электронного поля .
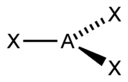
(SP )гибридизация – координационное число =2 ,валентный угол 180 градусов
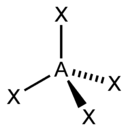
(SP3) гибридизация – координационное число =4 , валентный угол 190 градусов 28 минут
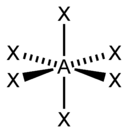
(SP2)гибридизация – координационное число = 6 валентный угол 120 градусов
Тип гибридизации |
Число гибридных орбиталей |
Геометрия |
Структура |
Примеры |
sp2 |
3 |
Треугольная |
|
BF3, NO3-, CO32- |
sp3 |
4 |
Тетраэдрическая |
|
CH4, ClO4-, SO42-, NH4+ |
dsp2 |
4 |
Плоскоквадратная |
|
Ni(CO)4, [PdCl4]2- |
sp3d2 |
6 |
Октаэдрическая |
|
SF6, Fe(CN)63-, CoF63- |
sp |
2 |
Линейная |
|
BeF2, CO2, NO2+ |
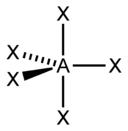
sp3d |
5 |
Гексаэдрическая |
|
PCl5, AsF5 |
Вопрос 46.
Коррозия металлов — это процесс самопроизвольного разрушения металлов и сплавов под влиянием факторов окружающей среды.
Химическая коррозия — она обусловлена взаимодействием металлов с сухими газами или жидкостями не проводящие электричество.
Электрохимическая коррозия — это разрушение металлов при соприкосновении их с электролитами и возникновением в системе электрического тока. В зависимости от среды протекание различают: а)кислотная коррозия — протекает в растворе какой-либо кислоты.
б)атмосферная коррозия — протекает под действием кислорода, воздуха и паров влаги.
Меры защиты от коррозии:
1) покрытие неметаллом
2) металлическое покрытие (хром, никель, цинк, олово)
Вопрос 47.
Электролиз — окислительно-восстановительный процесс, протекающий при прохождении постоянного электрического тока через раствор или расплав электролитов.
Законы электролиза:
1) масса вещества, выделяющиеся на электроде прямо пропорционально количеству электричества, прошедшему через раствор или расплав электролита.
где m – масса вещества; KЭ — электрохимический эквивалент; U – количество электричества.
2) при прохождении одинакового количества электричества через растворы или расплавы разных электролитов масса вещества, выделяющиеся на электродах прямо пропорциональна их химическим эквивалентам.
Практическое применение: большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза. Оцинкованое железо получается электролизом.
Вопрос 48.
Электролиз расплавов:
NaCl = Na+ + Cl
(-)K (+)A
Na+ + 1e = Na0 2Cl-- - 2e = Cl20
2NaCl = 2Na + Cl2
Электролиз водных растворов:
Характер протекания реакций восстановления на катоде из водных растворов определяется положением металла в ряду стандартных электродных потенциалов. Чем меньше алгебраическая величина стандартного электродного потенциала, тем характернее для него ионное состояние и тем труднее восстанавливаются его ионы на катоде. При этом возможно три случая:
1) катионы металлов, расположенные в ряду стандартных электродных потенциалов от Лития до Алюминия включительно, не восстанавливаются на катоде, а вместо них восстанавливается молекулы воды по уравнению:
К(-) 2H2O + 2e = H2 + 2OH-
2) катионы металлов, расположенные в ряду стандартных электродных потенциалов после Алюминия, но до Водорода, восстанавливаются одновременно с молекулами воды.
3) катионы металлов, расположенные в ряду стандартных электродных потенциалов после Водород, восстанавливаются полностью на катоде, а вода не принимает участие.
Лёгкостью отдачи электронов на аноде зависит от состава аниона и их можно расположить в ряд по возрастанию восстановительной активности:
F- < NO3- < SO4-- < H2O < Cl-- < Be-- < J-- < S2-
A(+) 2H2O – 4e = O2 + 4H+
Характер реакции, протекающих на электродах зависит от вещества, из которого изготовлен электрод и различают два вида:
1) нерастворимые (пассивные)
2) растворимые (активные) — изготовлены из меди, цинка, серебра (кроме платины), во внешнюю цепь посылает электроды не анионы раствора, а в результате растворения материала анода.