
- •3. Количественные законы химии, Закон эквивалентов.
- •Закон Гесса (1840):
- •7. Изменение изобарно-изотермического потенциала (энергия Гиббса). Расчёт энергии Гиббса для стандартных условий. Уравнение Гиббса. Анализ уравнения Гиббса.
- •8. . Химическая кинетика. Понятие о скорости химической реакции. Факторы, влияющие на скорость химической реакции. Закон действующих масс. Правило Вант-Гоффа.
- •9. Основные положения теории активных соударений молекул. Энергия активации. Уравнение Аррениуса. Теория переходного состояния. Энергетические диаграммы.
- •10. Химическое равновесие. Константа химического равновесия. Способы нарушения химического равновесия. Принцип Ле-Шателье. Кинетика гетерогенных реакций.
- •12. Каталитические процессы. Энергетические диаграммы каталитических процессов. Катализатор. Механизм действия катализатора.
- •14) Коллигативные свойства растворов. Понижение температуры замерзания. Повышения температуры кипения. Закон Рауля.
- •15) Произведение растворимости. Условия образования осадка.
- •16. Растворы электролитов. Изотонический коэффициент. Основные положения теории электролитической диссоциации. Катионы. Анионы.
- •19. Вода как слабый электролит. Ионное произведение воды. РН, рОн. Индикаторы.
- •24. Окислительно-восстановительные реакции. Окисление. Восстановление. Правила расчёта степени окисления. Высшая, средняя и низшая степени окисления.
- •28 Практическое применение электрохимических процессов в науке, технике, современном производстве.
- •29 Сущность коррозионных процессов металлов и сплавов. Классификация коррозионных процессов металлов.
- •31. Основные методы защиты металлов от коррозии. Применение ингибиторов. Рациональное конструирование. Легирование металлов. Протекторная защита металлов от коррозии.
- •33. Сущность электролизных процессов. Схема электролизной установки, заряды анода и катода. Анодные и катодные процессы Сущность электролизных процессов:
- •36. Сущность электролизных процессов. Электролиз расплавов электролитов( привести примеры, составить уравнения реакций). Законы электролиза. Постоянная Фарадея.
- •37.Практическое применение электролизных процессов в современной промышленности.
- •Анионирование воды
- •40. Классификация полимеров (по происхождению, по составу основной цепи макромолекул, по строению макромолекул, по способу получения).
- •41. Сущность полимеризации как способа получения полимеров. Схема процесса полимеризации, способы её проведения.
- •42. Важнейшие полимеры, получаемые методом полимеризации, их основные физические и химические свойства и практическое применение.
- •43. Сущность поликонденсации как способа получения полимеров. Схема процесса поликонденсации и способы её проведения.
- •44. Важнейшие полимеры, получаемые методом поликонденсации, их основные физические и химические свойства и практическое применение.
- •45. Пластические массы. Классификация пластических масс. Состав пластических масс. Пластические массы в строительстве. Полимерная химия в Беларуси.
24. Окислительно-восстановительные реакции. Окисление. Восстановление. Правила расчёта степени окисления. Высшая, средняя и низшая степени окисления.
ОВР – химическая реакция, протекающая с изменением степени окисления одного или нескольких элементов, входящих в состав реагирующих веществ. Окисление – процесс отдачи электронов. Al0 -3e → Al3+ Восстановление – процесс присоединения электронов. Fe2+ +2e → Fe0 Степень окисления – заряд, который атом приобрел бы, если бы все электронные пары химической связей в соединении, сместились бы в сторону атомов более электроотрицательных элементов. Правила расстановки степеней окисления : 1. Степень окисления у простого вещества равна нулю ( Fe0, Сг0, Al0) 2.Молекула химического соединения электронейтральна( т.е. сумма всех зарядов должна быть равна нулю) 3.Ряд элементов имеет постоянную степень окисления : а) H+ ( искл. гибриды Me : NaH¯) б) Кислород имеет степень окисления (-2),за исключением соединения кислорода со фтором O+2F2¯ и в перекисях( Н2О2 - степень окисления кислорода (-1) в) F¯ г) щелочные металлы имеют степень окисления 1 ( первая группа) д) Mg +2 , Ca+2 (вторая А группа) 4. Металлы всегда проявляют только положительную степень окисления. 5. Высшая степень окисления равна номеру группы в периодической системе ( исключения : F, O2 и др.) 6. Большинство элементов имеют переменную степень окисления N3-H+ , N20, N2+O2- Окислитель – вещество, атомы которого принимают электроны. В ходе реакции окислитель восстанавливает. Восстановитель – вещество, атомы которого отдают электроны. В ходе реакции восстановитель окисляется. Элементы в высших степенях окисления являются окислителями и могут только восстанавливаться S6+ max Элементы в низших степенях окисления могут только окисляться, являясь восстановителями. S2- min Элементы в средних степенях окисления обладают окислительно-восстановительной двойственностью S0, S4+ средние 25. Важнейшие окислители. Важнейшие восстановители.
-кислород
-типичные неметаллы в виде простых веществ(Cl2,Br2,F2,)
-электрический ток на аноде при электролизе.
-сложные вещества содержащие элементы в высших степенях окисления.
Пример:
+ 7+ 2-
KMnO4
-сильные кислоты в том числе кислород содержащий кислоты и их соли,содержащие в высших степенях окисления.
-вода
-некоторые оксиды
Пример:
4+ 2-
PbO2
-все ионы благородных металлов.
Важнейшие восстановление
-водород Н2
-электрический ток на катоде при электролизе.
-все металлы 1А и 2А группы в виде простых веществ.
-бескислородные кислоты и их соли (в случае образования простых веществ)
-С,Со –углерод
-соединение содержащие в низших степенях окисления.H2S
-сернистая и азотистая кислота и их соли.
-гидриды щелочных и щелочноземельных металлов.
26. Электрохимические процессы. Электродный потенциал. Устройство и работа медно-цинкового гальванического элемента Даниэля. Схема гальванического элемента. Электрохимическим процессом называется процессы сопровождающиеся возникновение электрического тока или сами вызываемые их.(в их основе лежат ОВР)
Устройства и работа гальванического элемента Даниэля.

Внутренняя степь
Гальванического
элемента
 -2e
->
-2e
->
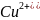 +2e ->
+2e ->
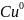
+ -> +
Электрод, на котором протекает процесс окисления, называется анодом.
Электрод на котором протекает процесс восстановления называется катионом (и несёт заряд +)
Схема гальванического элемента

 |
||
|Cu
|
||
|Cu
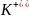
Одна вертикальная черта это условная граница между металлами и растворами электролита.
Две вертикальные черты это условная граница между 2 –мя растворами электролита.
27. Стандартный электродный потенциал металла. Ряд напряжений. Уравнение Нернста. ЭДС гальванического элемента. Водородный электрод Стандартный электродный потенциал металла-
Это электродный потенциал металла ,погружённого в раствор собственных ионов с концентрацией 1моль/л, по сравнению со стандартным водородным электродом ,потенциал которого условно равно 0.
Чтобы определить направление протекания реакции следует рассчитать ЭДС,
Реакция протекает в том направление, при котором ЭДС положительно.
 –min,
–min, -
max
-
max
Концентрация
ионов металла =[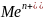 ]=0,1м
]=0,1м
Гальванический элемент может быть составлен из электродов изготовленных из одного и того же металла
В гальваническом элементе анодом будет металл с меньшим стандартным электродным потенциалом.
Ряд напряжений.
Основополагающим звеном для понимания электрохимических процессов является ряд напряжения металлов. Если из двух любых металлов ряда изготовить электроды гальванического элемента, то на предшествующем в ряду материале появится отрицательное напряжение. Величина напряжения (электрохимический потенциал) зависит от положения элемента в ряду напряжении и от свойств электролита. Сущность ряда напряжения установим из нескольких простых опытов, для которых нам понадобятся источник тока и электрические измерительные приборы.
Уравнение
Нернста- +
+
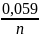 · lg
[
]
· lg
[
]
Для стандартных условий.
 –стандартный
электродный потонцеал соответствующего
металла
–стандартный
электродный потонцеал соответствующего
металла
0,059 –коэф.для стандартных условий
n-количество электронов ,которые принимают участие в конкретном процесс.
[ ]-молярная концентрация ионов металлов в растворе.
Водородный электрод, платиновая пластинка, электролитически покрытая платиновой чернью, погружённая в раствор кислоты с определённой концентрацией ионов водорода Н+ и омываемая током газообразного водорода. Потенциал В. э. возникает за счёт обратимо протекающей реакции
![]()
