
- •3. Количественные законы химии, Закон эквивалентов.
- •Закон Гесса (1840):
- •7. Изменение изобарно-изотермического потенциала (энергия Гиббса). Расчёт энергии Гиббса для стандартных условий. Уравнение Гиббса. Анализ уравнения Гиббса.
- •8. . Химическая кинетика. Понятие о скорости химической реакции. Факторы, влияющие на скорость химической реакции. Закон действующих масс. Правило Вант-Гоффа.
- •9. Основные положения теории активных соударений молекул. Энергия активации. Уравнение Аррениуса. Теория переходного состояния. Энергетические диаграммы.
- •10. Химическое равновесие. Константа химического равновесия. Способы нарушения химического равновесия. Принцип Ле-Шателье. Кинетика гетерогенных реакций.
- •12. Каталитические процессы. Энергетические диаграммы каталитических процессов. Катализатор. Механизм действия катализатора.
- •14) Коллигативные свойства растворов. Понижение температуры замерзания. Повышения температуры кипения. Закон Рауля.
- •15) Произведение растворимости. Условия образования осадка.
- •16. Растворы электролитов. Изотонический коэффициент. Основные положения теории электролитической диссоциации. Катионы. Анионы.
- •19. Вода как слабый электролит. Ионное произведение воды. РН, рОн. Индикаторы.
- •24. Окислительно-восстановительные реакции. Окисление. Восстановление. Правила расчёта степени окисления. Высшая, средняя и низшая степени окисления.
- •28 Практическое применение электрохимических процессов в науке, технике, современном производстве.
- •29 Сущность коррозионных процессов металлов и сплавов. Классификация коррозионных процессов металлов.
- •31. Основные методы защиты металлов от коррозии. Применение ингибиторов. Рациональное конструирование. Легирование металлов. Протекторная защита металлов от коррозии.
- •33. Сущность электролизных процессов. Схема электролизной установки, заряды анода и катода. Анодные и катодные процессы Сущность электролизных процессов:
- •36. Сущность электролизных процессов. Электролиз расплавов электролитов( привести примеры, составить уравнения реакций). Законы электролиза. Постоянная Фарадея.
- •37.Практическое применение электролизных процессов в современной промышленности.
- •Анионирование воды
- •40. Классификация полимеров (по происхождению, по составу основной цепи макромолекул, по строению макромолекул, по способу получения).
- •41. Сущность полимеризации как способа получения полимеров. Схема процесса полимеризации, способы её проведения.
- •42. Важнейшие полимеры, получаемые методом полимеризации, их основные физические и химические свойства и практическое применение.
- •43. Сущность поликонденсации как способа получения полимеров. Схема процесса поликонденсации и способы её проведения.
- •44. Важнейшие полимеры, получаемые методом поликонденсации, их основные физические и химические свойства и практическое применение.
- •45. Пластические массы. Классификация пластических масс. Состав пластических масс. Пластические массы в строительстве. Полимерная химия в Беларуси.
8. . Химическая кинетика. Понятие о скорости химической реакции. Факторы, влияющие на скорость химической реакции. Закон действующих масс. Правило Вант-Гоффа.
Химическая кинетика – раздел физической химии изучающий химическую реакцию как процесс, протекающий во времени, тоесть изучающий скорость хим. реакции.
Скорость хим. реакции – изменение концентрации веществ в единицу времени в единицу реакционного пространства.
V= [моль/л. с]
Факторы, влияющие на скорость хим. реакции.
Природа - реагирующих веществ.
H2 + F2 →2HF
Концентрация.
Температура. ( Чем больше температура, тем больше скорость хим. реакции)
Наличие катализаторов.
Внешние воздействия (освещение).
Для твёрдых веществ (площадь поверхности соприкосновения реагентов). Для твёрдых веществ она является аналогом концентрации. Концентрация твёрдых веществ не входит в выражение закона действующих масс.
CaO(тв) +CO2 →CaCO3(тв) , V =R[CO2]
Закон действующих масс.
При постоянной температуре скорость хим. реакции прямопрапорциональна произведению концентрации веществ в степенях равных стехиометрических коэффициентов .
а×А+в×B→c×C, v=R × [A]a×[B]в
а, в – стехиометрические коэффициенты.
R –константа скорости хим. реакции.
[A]a×[B]в – концентрации реагирующих веществ.
Закон Вант-Гоффа – скорость большинства хим. реакции при увеличении температуры на 100 возрастает в 2-5 раз.
V2/V1=ɣ t2-t1/10
V2/V1 - скорость хим. реакции.
ɣ=2-5 температурный коэффициент.
9. Основные положения теории активных соударений молекул. Энергия активации. Уравнение Аррениуса. Теория переходного состояния. Энергетические диаграммы.
1. Протекание реакции возможно в результате столкновения между частицами.
2. Каждое столкновение может привести к реакциям только в том случае, если его энергия превосходит нейкую минимальную энергию, необходимую для разрыва хим. связей.
Ea – энергия активации – это избыточное количество энергии по сравнению с её средней величиной которой должна обладать молекула в момент столкновения, чтобы быть способной к хим. воздействию.
Уравнение Аррениуса.
R=p×z×e-Ea/RT
R - константа скорости.
P - стерический множитель учитывающий ориентацию частиц в пространстве.
Z - число столкновений частиц в единицу времени в единицу реакционного объёма.
е – экспонента 2,72
-Ea - Температура в Кельвинах.
R = 8,314 (газовая постоянная).
3. Каждое столкновение может приводить к реакции только в том случае если частицы ориентированы строгим образом по отношению друг к другу.
Теория переходного состояния. Энергетические диаграммы.
Основное отличие молекулы реагентов – взаимодействуют между собой не мгновенно, а в течении определённого промежутка времени за который происходит перестройка хим. связи.
H2 I2 HI
0 ● 0------● 0 ̅͞ ●
l l → ⁞ ⁞ → l l
0 ● 0------● 0 ͞ ●
Переходное состояние HI
Энергетические диаграммы.
Экзотермическая Эндотермическая
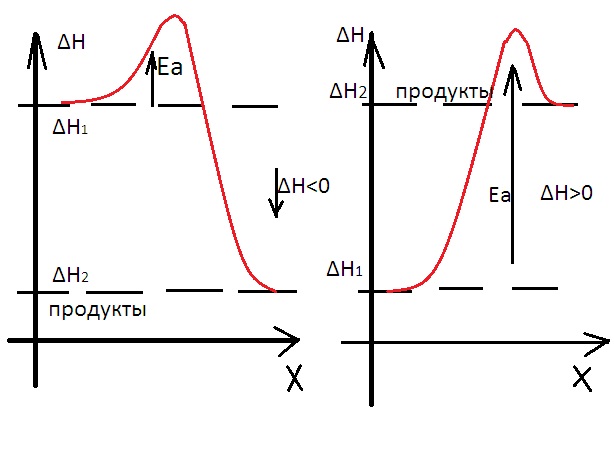
X – координата реакции – путь по которому проходит реакция от реагентов до продукта реакции.
