
- •3. Количественные законы химии, Закон эквивалентов.
- •Закон Гесса (1840):
- •7. Изменение изобарно-изотермического потенциала (энергия Гиббса). Расчёт энергии Гиббса для стандартных условий. Уравнение Гиббса. Анализ уравнения Гиббса.
- •8. . Химическая кинетика. Понятие о скорости химической реакции. Факторы, влияющие на скорость химической реакции. Закон действующих масс. Правило Вант-Гоффа.
- •9. Основные положения теории активных соударений молекул. Энергия активации. Уравнение Аррениуса. Теория переходного состояния. Энергетические диаграммы.
- •10. Химическое равновесие. Константа химического равновесия. Способы нарушения химического равновесия. Принцип Ле-Шателье. Кинетика гетерогенных реакций.
- •12. Каталитические процессы. Энергетические диаграммы каталитических процессов. Катализатор. Механизм действия катализатора.
- •14) Коллигативные свойства растворов. Понижение температуры замерзания. Повышения температуры кипения. Закон Рауля.
- •15) Произведение растворимости. Условия образования осадка.
- •16. Растворы электролитов. Изотонический коэффициент. Основные положения теории электролитической диссоциации. Катионы. Анионы.
- •19. Вода как слабый электролит. Ионное произведение воды. РН, рОн. Индикаторы.
- •24. Окислительно-восстановительные реакции. Окисление. Восстановление. Правила расчёта степени окисления. Высшая, средняя и низшая степени окисления.
- •28 Практическое применение электрохимических процессов в науке, технике, современном производстве.
- •29 Сущность коррозионных процессов металлов и сплавов. Классификация коррозионных процессов металлов.
- •31. Основные методы защиты металлов от коррозии. Применение ингибиторов. Рациональное конструирование. Легирование металлов. Протекторная защита металлов от коррозии.
- •33. Сущность электролизных процессов. Схема электролизной установки, заряды анода и катода. Анодные и катодные процессы Сущность электролизных процессов:
- •36. Сущность электролизных процессов. Электролиз расплавов электролитов( привести примеры, составить уравнения реакций). Законы электролиза. Постоянная Фарадея.
- •37.Практическое применение электролизных процессов в современной промышленности.
- •Анионирование воды
- •40. Классификация полимеров (по происхождению, по составу основной цепи макромолекул, по строению макромолекул, по способу получения).
- •41. Сущность полимеризации как способа получения полимеров. Схема процесса полимеризации, способы её проведения.
- •42. Важнейшие полимеры, получаемые методом полимеризации, их основные физические и химические свойства и практическое применение.
- •43. Сущность поликонденсации как способа получения полимеров. Схема процесса поликонденсации и способы её проведения.
- •44. Важнейшие полимеры, получаемые методом поликонденсации, их основные физические и химические свойства и практическое применение.
- •45. Пластические массы. Классификация пластических масс. Состав пластических масс. Пластические массы в строительстве. Полимерная химия в Беларуси.
ВОПРОСЫ К ЭКЗАМЕНУ ПО КУРСУ «ХИМИЯ»
1. Предмет и значение химии для современного экономиста. Роль химии в современной промышленности, науке, передовых технологиях. Химия и энергетика. Химия и продовольствие. Химия и медицина. Современная химическая промышленность.
2. Основные понятия химической стехиометрии (моль, молярная масса, эквивалент, эквивалентная масса). Определение эквивалентов и эквивалентных масс основных неорганических соединений: оксидов, кислот, оснований, солей.
3. Количественные законы химии, Закон эквивалентов.
4. Основные понятия химической термодинамики: термодинамическая система, параметры состояния и функции термодинамической системы. 1-й закон термодинамики. Энтальпия. Экзо- и эндотермические реакции.
5. Законы термохимии. Закон Лавуазье-Лапласа. Закон Гесса. Следствие из закона Гесса. Практическое применение законов термохимии.
6. 2-й закон термодинамики. Энтропия. Направление протекания химической реакции.
7. Изменение изобарно-изотермического потенциала (энергия Гиббса). Расчёт энергии Гиббса для стандартных условий. Уравнение Гиббса. Анализ уравнения Гиббса.
8. Химическая кинетика. Понятие о скорости химической реакции. Факторы, влияющие на скорость химической реакции. Закон действующих масс. Правило Вант-Гоффа.
9. Основные положения теории активных соударений молекул. Энергия активации. Уравнение Аррениуса. Теория переходного состояния. Энергетические диаграммы.
10. Химическое равновесие. Константа химического равновесия. Способы нарушения химического равновесия. Принцип Ле-Шателье. Кинетика гетерогенных реакций.
12. Каталитические процессы. Энергетические диаграммы каталитических процессов. Катализатор. Механизм действия катализатора.
13. Классификация растворов. Способы выражения концентрации растворов (массовая доля, молярная, моляльная. эквивалентная концентрации, мольная доля). Закон эквивалентов для растворов.
14. Коллигативные свойства растворов. Понижение температуры замерзания. Повышение температуры кипения. Закон Рауля.
15. Произведение растворимости. Условия образования осадка.
16. Растворы электролитов. Изотонический коэффициент. Основные положения теории электролитической диссоциации. Катионы. Анионы.
17. Сильные электролиты. Активность иона. Коэффициент активности. Ионная сила раствора.
18. Слабые электролиты. Константы диссоциации слабых электролитов. Степень диссоциации. Закон Оствальда.
19. Вода как слабый электролит. Ионное произведение воды. рН, рОН. Индикаторы.
20. Сущность гидролиза солей. Гидролиз солей, образованных слабым основанием и слабой кислотой, слабым основанием и сильной кислотой. Привести примеры (уравнения гидролиза в молекулярной, ионной и сокращённой ионной форме).
21. Гидролиз солей, образованных сильным основанием и слабой кислотой. Два признака гидролиза. Ступенчатый гидролиз (привести примеры: уравнения гидролиза в молекулярной, ионной и сокращённой ионной форме).
22. Константа гидролиза. Степень гидролиза. Факторы, влияющие на степень гидролиза солей.
23. Строение и типы химической связи комплексных соединений. Диссоциация комплексных соединений с комплексным анионом и комплексным катионом. Константа нестойкости комплексного иона. Двойные соли.
24. Окислительно-восстановительные реакции. Окисление. Восстановление. Правила расчёта степени окисления. Высшая, средняя и низшая степени окисления.
25. Важнейшие окислители. Важнейшие восстановители.
26. Электрохимические процессы. Электродный потенциал. Устройство и работа медно-цинкового гальванического элемента Даниэля. Схема гальванического элемента.
27. Стандартный электродный потенциал металла. Ряд напряжений. Уравнение Нернста. ЭДС гальванического элемента. Водородный электрод.
28. Практическое применение электрохимических процессов в науке, технике, современном производстве.
29. Сущность коррозионных процессов металлов и сплавов. Классификация процессов коррозии металлов.
30. Основные процессы, протекающие при электрохимической коррозии металлов, их отличия от процессов, протекающих в гальваническом элементе. Зависимость протекания процессов коррозии от рН среды (привести примеры, составить уравнения реакций).
31. Основные методы защиты металлов от коррозии. Применение ингибиторов. Рациональное конструирование. Легирование металлов. Протекторная защита металлов от коррозии.
32. Защита металлов от коррозии путём нанесения анодных и катодных металлических покрытий. Уравнения анодных и катодных процессов в нейтральной и кислой среде. Способы получения металлических покрытий.
33. Сущность электролизных процессов. Схема электролизной установки, заряды анода и катода. Анодные и катодные процессы.
34. Электролиз растворов электролитов. Вода как активный реагент. Катодные процессы. Последовательность разрядки ионов на катоде. Три группы катионов (привести примеры, составить уравнения реакций).
35. Анодные процессы при электролизе растворов электролитов. Последовательность разрядки ионов на аноде. Типы анодов. Особенность электродных процессов с использованием активного анода (привести примеры, составить уравнения реакций).
36. Сущность электролизных процессов. Электролиз расплавов электролитов (привести примеры, составить уравнения реакций). Законы электролиза. Постоянная Фарадея.
37. Практическое применение электролизных процессов в современной промышленности.
38. Жёсткость воды. Типы жёсткости воды и физико-химические способы умягчения воды в системе промышленной водоподготовки. Катионирование и анионирование. Расчёт жёсткьости воды.
39. Высокомолекулярные соединения (ВМС). Основные отличия ВМС от низкомолекулярных веществ. Молекулярная масса полимеров (среднемассовая, среднечисловая), степень полидисперсности.
40. Классификация полимеров (по происхождению, по составу основной цепи макромолекул, по строению макромолекул, по способу получения).
41. Сущность полимеризации как способа получения полимеров. Схема процесса полимеризации, способы её проведения.
42. Важнейшие полимеры, получаемые методом полимеризации, их основные физические и химические свойства и практическое применение.
43. Сущность поликонденсации как способа получения полимеров. Схема процесса поликонденсации и способы её проведения.
44. Важнейшие полимеры, получаемые методом поликонденсации, их основные физические и химические свойства и практическое применение.
45. Пластические массы. Классификация пластических масс. Состав пластических масс. Пластические массы в строительстве. Полимерная химия в Беларуси.
46. Основные методы утилизации отходов полимеров. Рециклинг, захоронение, сжигание, пиролиз.
47. Роль химии в решении глобальных экологических проблем. Основные принципы «зелёной» химии,
1.Предмет и значение химии для современного экономиста. Роль химии в современной промышленности, науке, передовых технологиях. Химия и энергетика. Химия и продовольствие. Химия и медицина. Современная химическая промышленность. Большую роль играет химия в современной промышленности. Химическая и нефтехимическая промышленность являются важнейшими отраслями, без которых невозможно функционирование экономики. Среди важнейших продуктов следует назвать кислоты, щелочи, соли, минеральные удобрения, растворители, масла, пластмассы, каучуки и резины, синтетические волокна и многое другое. В настоящее время химическая промышленность выпускает несколько десятков тысяч наименований продукции. Исключительно важную роль играют химические продукты и процессы в энергетике, которая использует энергию химических реакций. Для энергетических целей используются многие продукты переработки нефти (бензин, керосин, мазут), каменный и бурый уголь, сланцы, торф. В связи с уменьшением природных запасов нефти вырабатывается синтетическое топливо путем химической переработки различного природного сырья и отходов производства. Развитие многих отраслей промышленности связано с химией: металлургия, машиностроение, транспорт, промышленность строительных материалов, электроника, легкая, пищевая промышленность— вот неполный список отраслей экономики, широко использующих химические продукты и процессы. Во многих отраслях применяются химические методы, например, катализ (ускорение процессов), химическая обработка металлов, защита металлов от коррозии. Большую роль играет химия в развитии фармацевтической промышленности: основную часть всех лекарственных препаратов получают синтетическим путем. Исключительно большое значение химия имеет в сельском хозяйстве, которое использует минеральные удобрения, средства защиты растений от вредителей, регуляторы роста растений, химические добавки и консерванты к кормам для животных и другие продукты. Использование химических методов в сельском хозяйстве привело к возникновению ряда смежных наук, например, агрохимии и биотехнологии, достижения которых в настоящее время широко применяются в производстве сельскохозяйственной продукции. Бурное развитие промышленности, в том числе химической, создало серьезную проблему: необходимость снизить отрицательное ее воздействие на окружающую среду.
2.Основные
понятия химической стехиометрии (моль,
молярная масса, эквивалент, эквивалентная
масса). Определение эквивалентов и
эквивалентных масс основных неорганических
соединений: оксидов, кислот, оснований,
солей. Химическая
стехиометрия
– раздел химии в котором исследуется
количественный состав химических
соединений, а также количественные
изменения происходящие при химических
реакциях.
Моль
– это кол-во вещ-ва в системе, которое
содержит столько же элементарных
химических частиц, сколько атомов
углерода содержится в 12 г. изотопа
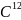 .
Молярная
масса
– масса одного моля вещества M=[
.
Молярная
масса
– масса одного моля вещества M=[ ],
n=
],
n=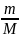 Эквивалент
простого вещ-ва
– это такое его кол-во, которое соединяется
с общим молем атомов водорода или
замещает такое же кол-во атомов
водорода.
Эквивалент
химического соединения
– такое кол-во его молей, которое
взаимодействует без остатка с одним
эквивалентом водорода. Э-
эквивалент.
Эквивалентная
масса
– масса одного эквивалента.
Эквивалент
простого вещ-ва
– это такое его кол-во, которое соединяется
с общим молем атомов водорода или
замещает такое же кол-во атомов
водорода.
Эквивалент
химического соединения
– такое кол-во его молей, которое
взаимодействует без остатка с одним
эквивалентом водорода. Э-
эквивалент.
Эквивалентная
масса
– масса одного эквивалента.
 =
=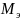 =
=
Определение эквивалентов и эквивалентных масс основных неорганических соединений: 1) Оксиды.
 ,
где
,
где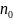 -
кол-во атомов кислорода,
-
кол-во атомов кислорода,
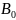 – валентность атомов кислорода
– валентность атомов кислорода
 ,
где
М- молярная масса
,
где
М- молярная масса
Кислоты
Эк-ты=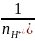 ,
где
,
где
 - основность кислоты или кол-во атомов
водорода
- основность кислоты или кол-во атомов
водорода

Основания
 ,
где
,
где
 кислотность
оснований;
кислотность
оснований;
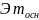 =
=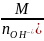
Соли
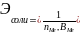 ,
,
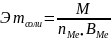
3. Количественные законы химии, Закон эквивалентов.
1.Закон сохранения материи Лавуазье(1774)
В химических реакциях не может происходить возникновение или исчезновение материи
2.Закон постоянства состава (Пруст, 1794г)
Каждое чистое химическое соединение всегда состоит из одних и тех же элементов, связанных между собой в одинаковом весомом отношении
3.Закон кратных отношений (Дальтон, 1803г)
Если какие-либо 2 вещества А и В могут связываться между собой, образуя несколько разных соединений, то весовые количества вещества А, которые связываются с постоянным количеством вещества В, пропорциональны небольшим целым числам.
4.Закон эквивалентных отношений (Рихтер, 1792г)
Весовые количества двух веществ, которые порознь вступают в химические реакции с постоянным количеством третьего вещества, совпадают с весовым количеством двух первых веществ при их реакции друг с другом.
Закон эквивалентов:
m1/m2 = Эm1/Эm2 V1/V2 = Vэ1/Vэ2
Массы (объёмы) реагирующих друг с другом веўеств пропорциональны их эквивалентным массам (объёмам).
4. Основные понятия химической термодинамики: термодинамическая система, параметры состояния и функции термодинамической системы. 1-й закон термодинамики. Энтальпия. Экзо- и эндотермические реакции. Термодинамическая система – часть пространства, выделенная из внешней сред, существующей границей раздела, занимающая определённый объём, и в которой возможен тепло и массообмен между её составными частями; существуют открытые и закрытые системы.
Параметры состояния: P – давление
V – объём
T – температура
n – число молей веществ
PV = nRT – уравнение Менделеева-Клайперона
Функции термодинамической системы: U – внутренняя энергия
M – энтальпия
S – энтропия
G – энергия Гиббса
1-ый Закон Термодинамики:
Невозможен процесс, единственным результатом которого было бы превращение теплоты в работу
Состояние с максимальной энергией является наиболее устойчивым состоянием для изолированной системы
Полная энтропия всегда увеличивается при самопроизвольном процессе ( дельта S>0 )
Энтальпия – термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Экзотермическая реакция: энергия, теряемая в ходе реакции сначала поступает в реакционную смесь и происходит повышение температуры смеси, затем эта энергия передаётся в окружающую среду и после завершения реакции температура смеси снова падает.
Эндотермическая реакция: энергия, поглощаемая в ходе реакции сначала отбирается у реакционной смеси и температура смеси падает, затем энергия поступает из окружающей среды и после завершения реакции температура смеси снова повышается.
5. Законы термохимии. Закон Лавуазье-Лапласа. Закон Гесса. Следствие из закона Гесса. Практическое применение законов термохимии. Законы термохимии: 1. Закон Лавуазье-Лапласа:
Изменение энтальпии хим. реакции, протек-щих в прямом и обратном направлениях = по абсолютному значению и противоположны по знаку.
 ;
∆H=52кДж
;
∆H=52кДж
 ;
∆H=
-52кДж
;
∆H=
-52кДж
