
Азотная;
соляная;
уксусная; 5am
синильная;
селеновая.
Одноосновной кислотой является:
1) селенистая;
2) фосфористая;
3) теллуровая; 5am
4) борная;
5) синильная.
Какая кислота образует два типа кислых солей:
серная кислота;
ортофосфорная кислота; 2am
метафосфорная кислота;
селеновая кислота;
сернистая кислота.
53. Какая кислота не образует кислых солей:
Серная кислота;
ортофосфорная кислота;
метафосфорная кислота; 3am
селеновая кислота;
сернистая кислота.
Укажите катионный комплекс:
1) Na3[Co(NO2)6];
2) [Pt(NH3)2CI2];
3) K3[Cr(OH)6];
4) [Cr(H2O)6] CI3; 4bl
5) K2[Hq(SCN)4].
Укажите комплексный неэлектролит:
1) Na3[Co(NO2)6];
2) [Pt(NH3)2CI2]; 2bl
3) K3[Cr(OH)6];
4) [Cr(H2O)6] CI3;
5) K2[Hq(SCN)4].
Укажите анионный комплекс:
гексацианоферрат (III) калия; 1bl
тетрахлородиамминплатина (IV);
хлорид диамминсеребра;
сульфат тетраамминмеди (II);
хлорид гексааквахрома (III).
Укажите комплексный неэлектролит:
гексацианоферрат (III) калия;
тетрахлородиамминплатина (IV); 2bl
хлорид диамминсеребра;
сульфат тетраамминмеди (II);
хлорид гексааквахрома (III).
58. Укажите формулу хлорида гексааквахрома (III):
1) Na3 [Cr(OH)6];
2) [Cr(H2O)4CI2] CI
3) [Cr(H2O)6 ] CI2;
4) [Cr(H2O)6 ] CI3; 4bl
5)K2Cr2O7.
59. Укажите формулу хлорида гексааквахрома (II):
1) Na3 [Cr(OH)6];
2) [Cr(H2O)4CI2] CI
3) [Cr(H2O)6 ] CI2; 3bl
4) [Cr(H2O)6 ] CI3;
5)K2Cr2O7.
60. К какому классу комплексных соединений относится желтая кровяная соль:
1) К аквакомплексам;
2) Гидратам;
3) К ацидокомплексам; 3bl
4) К аммиакатам;
5) К хелатам.
61. К какому классу комплексных соединений относится медный купорос:
1) К аквакомплексам; 2bl
2) Гидратам;
3) К ацидокомплексам;
4) К аммиакатам;
5) К хелатам.
Какое вещество следует прибавить к раствору Са(НСО3)2, чтобы получить СаСО3:
1) Са(ОН)2;
2) HCI;
3) H2O; 1cm
4) CO2;
5) HNO3 .
“Строение вещества и периодический закон Д.И. Менделеева”
Сколько нейтронов в ядре атома наиболее распространенного изотопа свинца 207Pb?
82
125 2bm
207
289
164
Сколько электронов максимально находится на уровне n = 3?
2
8
18 3bm
32
50
Сколько подуровней включает уровень с n = 4?
1
2 4bm
3
4
5
Сколько энергетических уровней занимают электроны в атоме вольфрама?
5
6
7 2bm
8
9
Сколько протонов в ядре атома осмия?
38
152 3bm
76
114
266
Ядро атома криптона – 80,
 ,
содержит:
,
содержит:
80p и 36n
36p и 44е
36р и 80n 4bm
36р и 44n
44р и 44n
Какое число электронов у иона хрома
 :
:
21
24 1bm
27
52
28
Ион, имеющий в своем составе 18 электронов и 16 протонов, обладает зарядом ядра, равным:
+18
–18
+2 5bm
–2
+16
Чему равно максимальное число электронов, которые могут занимать 3s-орбиталь:
1
2
6 2bm
8
12
Атом какого элемента имеет электронную конфигурацию 1s22s22p63s23p64s1:
K
Са 1bm
Ва
Na
Cs
Какие из перечисленных обозначений орбиталей не верны:
2s, 4f
2р, 3d
1p, 2d 3bl
1s, 2p
3p, 3d
Какая из частиц имеет электронную конфигурацию, одинаковую с атомом аргона:
Са2+
К0 1bl
С10
Na+
Na0
Сродством к электрону называют:
энергию, необходимую для отрыва электрона от невозбужденного атома; 4bl
способность атома данного элемента к оттягиванию на себя электронной плотности;
переход электрона на более высокий энергетический уровень;
выделение энергии при присоединении электрона к атому или иону;
энергию химической связи.
В результате ядерной реакции
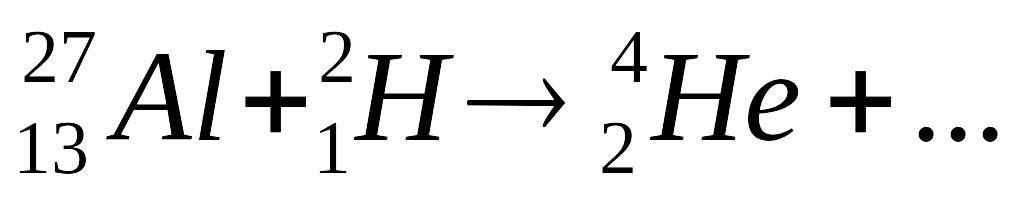 образуется изотоп:
образуется изотоп:
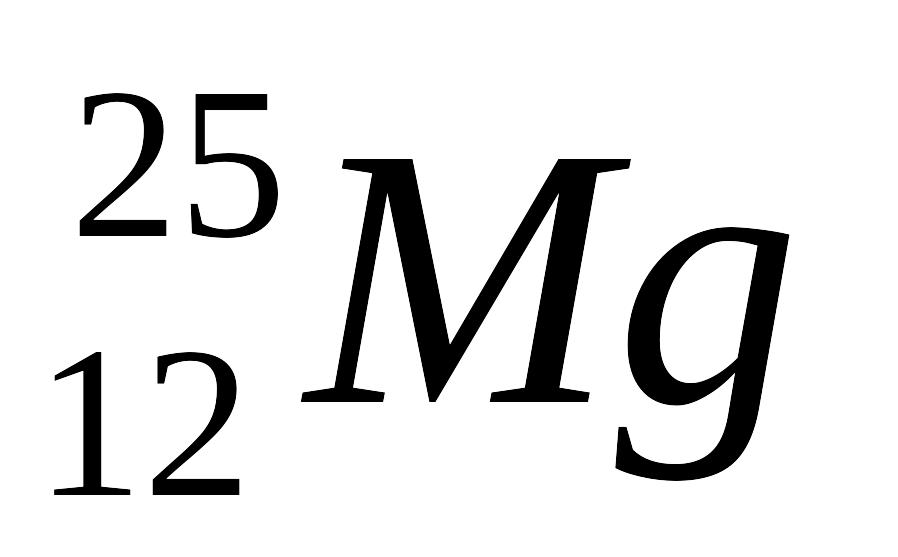
 1bm
1bm
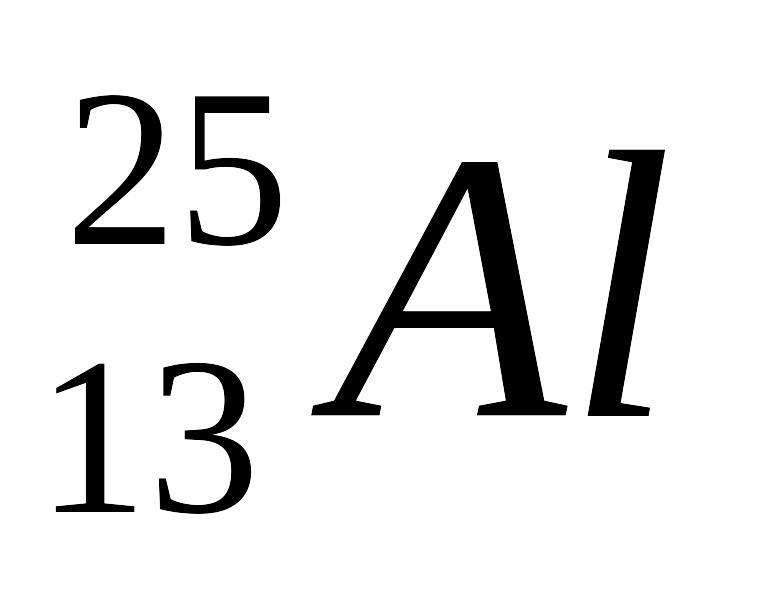
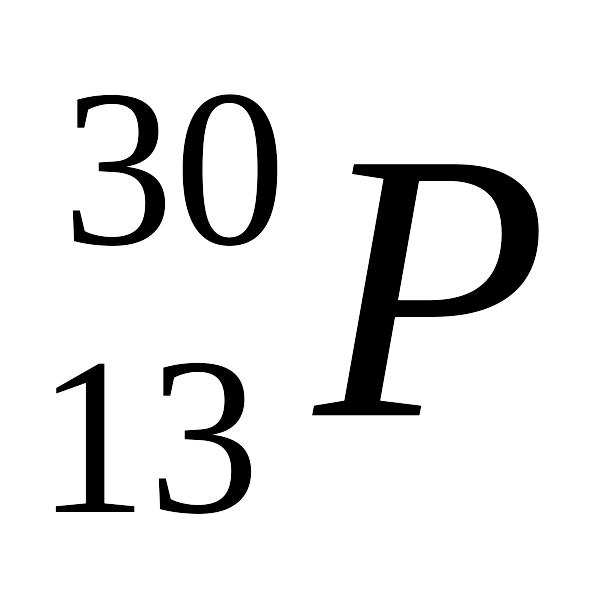
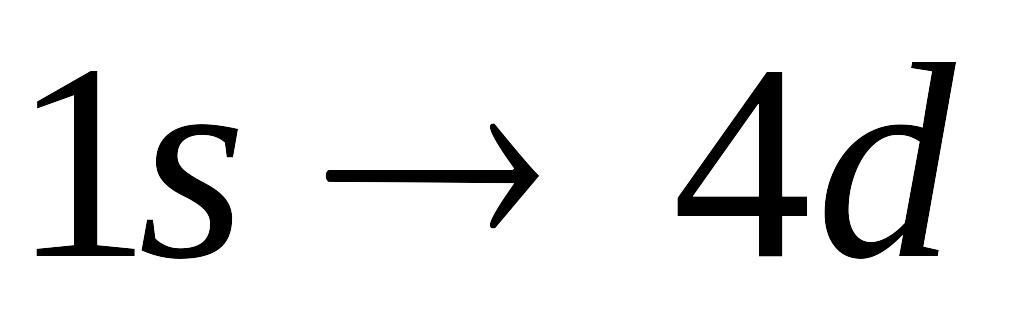
Какой из переходов электрона в атоме водорода требует поглощения фотона с минимальной энергией:
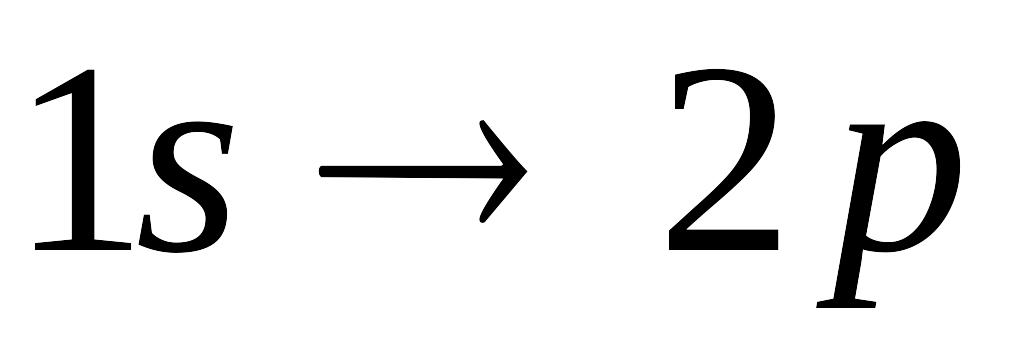
 4bl
4bl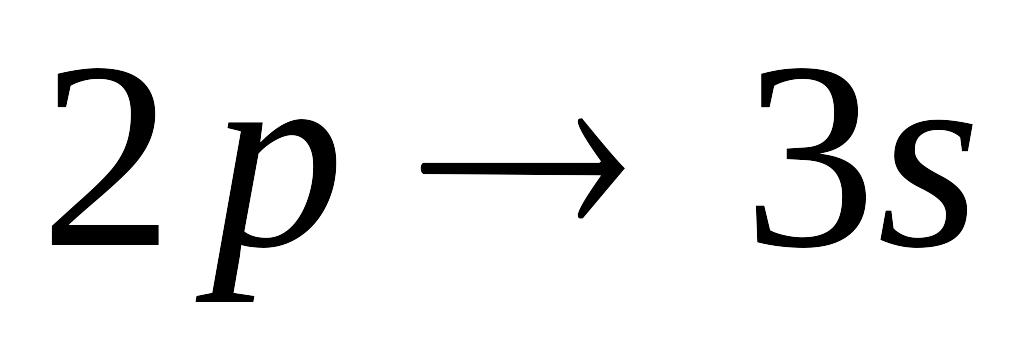

Какое уравнение характеризует корпускулярно-волновую природу электрона:
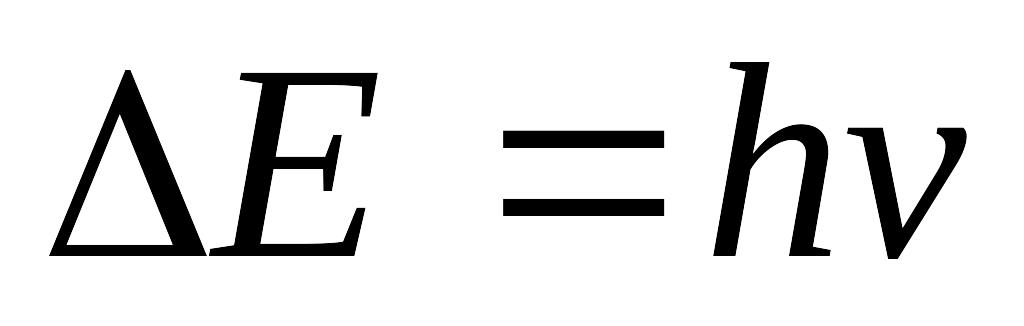

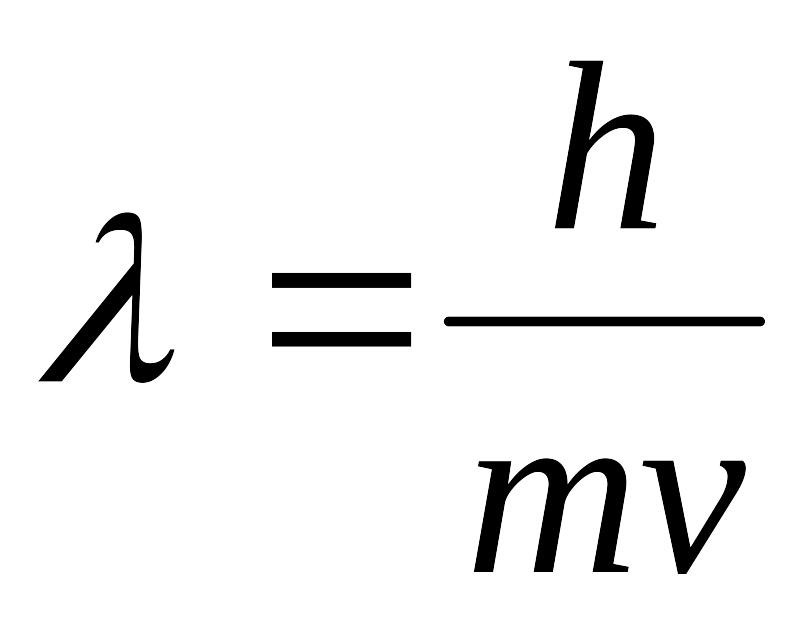 3cn
3cn
Какие значения всех квантовых чисел (n, l, ml, ms) возможны для валентного электрона атома калия:
4, 1, -1, -
 :
:
4, 1, +1, + : 3bm
4, 0, 0, + :
4) 5, 0, +1, + :
5) 4, 1, 0, +
Укажите заряд ядра атома, у которого конфигурация валентных электронов в основном состоянии …4d25s2 :
22
24 3bm
40
72
52
Что определяет главное квантовое число n:
1) форму электронного облака; 2cn
2) энергию электрона;
3) ориентацию электронного облака в пространстве;
4) вращение электрона вокруг собственной оси;
5) гибридизацию электронного облака.
Что определяет орбитальное квантовое число l:
1) форму электронного облака; 1cn
2) энергию электрона;
3) ориентацию электронного облака в пространстве;
4) вращение электрона вокруг собственной оси;
5) гибридизацию электронного облака.
Что определяет магнитное квантовое число m:
1) форму электронного облака; 3cn
2) энергию электрона;
3) ориентацию электронного облака в пространстве;
4) вращение электрона вокруг собственной оси;
5) гибридизацию электронного облака.
Что определяет спиновое квантовое число ms:
1) форму электронного облака; 4cn
2) энергию электрона;
3) ориентацию электронного облака в пространстве;
4) вращение электрона вокруг собственной оси;
5) гибридизацию электронного облака.
При
 -
распаде ядро атома радиоактивного
элемента испускает:
-
распаде ядро атома радиоактивного
элемента испускает:
1) электрон; 3cn
2) позитрон;
3) два протона и два нейтрона, объединенные в ядро атома гелия;
4) два протона;
5) два нейтрона.
При
 -
- распаде ядро атома радиоактивного
элемента испускает:
-
- распаде ядро атома радиоактивного
элемента испускает:
1) электрон; 1cn
2) позитрон;
3) два протона и два нейтрона, объединенные в ядро атома гелия;
4) два протона;
5) два нейтрона.
При + - распаде ядро атома радиоактивного элемента испускает:
1) электрон; 1cn
2) позитрон;
3) два протона и два нейтрона, объединенные в ядро атома гелия;
4) два протона;
5) два нейтрона.
Какая из атомных орбиталей имеет наименьшее значение суммы (n + l):
1) 3d 2bm
2) 4s
3) 4p
4) 5s
5) 4f
Какая из атомных орбиталей имеет наибольшее значение суммы (n + l):
1) 3d 5bm
2) 4s
3) 4p
4) 5s
5) 4f
Атом азота будет более устойчивым, если на 2 р- подуровне три электрона распределяются по одному на каждой орбитали. Это соответствует содержанию:
1) Принципа наименьшей энергии;
2) Принципа Паули; 3cn
3) Правила Гунда;
4) 1-го правила Клечковского;
5) 2-го правила Клечковского.
Двадцать первый электрон атома скандия располагается на 3 d – подуровне, а не на 4 р – подуровне. Это соответствует содержанию:
1) Принципа наименьшей энергии;
2) Принципа Паули;
3) Правила Гунда; 5cn
4) 1-го правила Клечковского;
5) 2-го правила Клечковского.
19 – й электрон атома калия располагается на 4s – подуровне, а не на 3d - подуровне. Это соответствует содержанию:
1) Принципа наименьшей энергии;
2) Принципа Паули; 4cn
3) Правила Гунда;
4) 1-го правила Клечковского;
5) 2-го правила Клечковского.
Единственный электрон атома водорода в основном состоянии располагается на первом энергетическом уровне. Это соответствует содержанию:
1) Принципа наименьшей энергии;
2) Принципа Паули; 1cn
3) Правила Гунда;
4) 1-го правила Клечковского;
5) 2-го правила Клечковского.
Максимальное число электронов на втором энергетическом уровне атомов элементов
равно 8. Это соответствует содержанию:
1) Принципа наименьшей энергии;
2) Принципа Паули; 2cn
3) Правила Гунда;
4) 1-го правила Клечковского;
5) 2-го правила Клечковского.
Один из механизмов образования ковалентной связи:
радикальный; 2cn
обменный;
молекулярный;
ионный;
цепной.
Примером неполярной молекулы, имеющей полярную ковалентную связь, будет:
1)N2
2) H2O 4bl
3) NH3
4) CCl4
5)CaO
Молекула какого вещества является неполярной:
HCl 2bl
CF4
3)NH3
4)H2S
5)HBr
В ряду молекул LiF – BeF2-BF3- CF4-NF3-OF2-F2:
характер связи не меняется;
ионный характер связи усиливается; 4bl
ковалентный характер связи ослабевает;
ковалентный характер связи усиливается;
правильного варианта ответа нет.
В каком соединении между атомами образуется ковалентная связь по донорно-акцепторному механизму:
1) KCl; 3bl
2) CCl4; 3)NH4C1; 4) NH3;
5) H2O.
В молекуле азота образуются:
1)
только
![]() -связи;
3bl
-связи;
3bl
2)
только
![]() -связи;
-связи;
3) как -, так и -связи;
4) одинарная связь;
5) двойная связь.
Молекула метана имеет структуру:
1) плоскую;
2) тетраэдрическую; 2bl
3) пирамидальную;
4) квадратную;
5) октаэдрическую.
Для какого из перечисленных ниже веществ характерно образование ионной решетки:
1) иодид цезия;
2) графит; 1bl
3) нафталин;
4) алмаз;
5) иод.
Для какого из перечисленных ниже веществ характерно образование атомной решетки:
1) нитрат аммония; 2bl
2) алмаз;
3) иод;
4) хлорид натрия;
5) натрий.
Химические элементы расположены в порядке возрастания электроотрицательности в
ряду:
1) Si, P, Se, Br, Cl, O; 1bl
2) Si, P, Br, Se, Cl, O;
3) P, Si, Br, Se, Cl, O;
4) Br, P, Cl, Si, Se;
5) Si, P, Se, Cl, O, Br
Валентные орбитали атома бериллия в молекуле гидрида бериллия … гибридизованы
по типу:
sp 1bl
2) sp2
3) sp3
4) d2sp3
5) d2sp2
106. Молекула гидрида бериллия имеет структуру:
1) квадратную 2bl
2) плоскую
3) тетраэдрическую
4) октаэдрическую
5) шарообразную.
107. Валентные орбитали атома бора в молекуле BF3 гибридизованы по типу:
1) sp 2bl
2) sp2
3) sp3
4) d2sp3
5) d2sp
108. Какая из молекул является наиболее прочной?
Н2 5bl
О2
F2
Cl2
5) N2
109. Какая из указанных молекул имеет наибольший диполь?
H2O 2bl
HF
HCl
HBr
H2S
110. Какую пространственную конфигурацию имеет молекула при sp2 гибридизации АО:
1) линейная 4bl
2) тетраэдр
3) плоский квадрат
4) плоская тригональная
5) октаэдр
Молекула имеет октаэдрическое строение если происходит следующая гибридизация
АО.
sp
dsp2
d2sp3 3bl
sp3
sp2
Современная теория строения атома основана на представлениях:
1) классической механики;
2) квантовой механики; 2an
3) теории Бора;
4) электродинамики;
5) химической кинетики.
Из перечисленных ниже характеристик атомов элементов периодически изменяются:
1) заряд ядра атома
2) относительная атомная масса; 4an
3) число энергетических уровней в атоме;
4) число электронов на внешнем энергетическом уровне;
5) общее число электронов.
Внутри периода увеличение порядкового номера элемента обычно сопровождается:
уменьшением атомного радиуса и возрастанием электроотрицательности атома;
2) возрастанием атомного радиуса и уменьшением электроотрицательности атома;
3) уменьшением атомного радиуса и уменьшением электороотрицательности атома
4) возрастанием атомного радиуса и возрастанием электроотрицательности атома
5) уменьшением электроотрицательности. 1al
Атом какого из элементов легче всего отдает один электрон:
1) натрий, порядковый номер 11;
2) магний, порядковый номер 12; 1al
3) алюминий, порядковый номер 13;
4) кремний, порядковый номер 14;
5) сера, порядковый номер 16.
Атомы элементов IА группы периодической системы элементов имеют одинаковое число:
1) электронов на внешнем электронном уровне;
2) нейтронов;
3) всех электронов; 1al
4) электронных оболочек ;
5) протонов.
Какой из приведенных элементов назван в честь страны:
1) Sn;
2) Si; 4eo
3) Ra;
4) Ru;
5) CI.
Какой ряд включает только переходные элементы:
1) элементы 11, 14, 22, 42;
2) элементы 13, 33, 54, 83; 3cn
3) элементы 24, 39, 74, 80;
4) элементы 19, 32, 51, 101;
5) элементы 19, 20, 21, 22.
Атом какого из элементов VА группы имеет максимальный радиус:
1) азот; 4bl
2) фосфор;
3) мышьяк;
4) висмут;
5) сурьма.
Какой ряд элементов представлен в порядке возрастания атомного радиуса:
1) О, S, Se, Te; 1bl
2) С, N, O, F;
3) Na, Mg, AI, Si;
4) J, Br, CI, F;
5) Sc, Te, V, Cr .
Металлический характер свойств элементов в ряду Mg – Ca – Sr – Ba
1) уменьшается; 2bl
2) возрастает;
3) не изменяется;
4) уменьшается, а затем возрастает;
5) увеличивается, а затем уменьшается .
Основные свойства гидроксидов элементов JА группы по мере увеличения порядкового номера
1) уменьшаются,
2) возрастают, 2bl
3) остаются неизменными,
4) уменьшаются, а затем возрастают,
5) возрастают, а затем уменьшаются.
Простые вещества каких элементов обладают наибольшим сходством физических и химических свойств:
1) Li, S;
2) Be, CI; 3bl
3) F, CI;
4) Li, F;
5) Na, Sc.
Существование каких из приведенных элементов было предсказано Д.И. Менделеевым:
1) Cu, Sb, Bi;
2) AI, B, Si; 3bl
3) Sc, Ga, Ge;
4) Na, P, S.
5) Zn, Cd, Hg.
Что отличает большие периоды от малых:
1) наличие щелочных металлов;
2) отсутствие инертных газов; 3bl
3) наличие d- и f- элементов;
4) наличие неметаллов;
5) наличие элементов с металлическими свойствами.
Как по электронной формуле элемента определить период, в котором находится данный элемент:
1) по значению главного квантового числа внешнего энергетического уровня;
2) по числу валентных электронов; 1bm
3) по числу электронов во внешнем энергетическом уровне;
4) по количеству подуровней во внешнем энергетическом уровне;
5)по значению подуровня, где находится последний валентный электрон.
Какой элемент имеет наименьший ионизационный потенциал:
1) Bi
2) Sb 1bl
3) As
4) P
5) N
Химический элемент третьего периода образует высший оксид состава Э2О3. Как распределяются электроны в атоме данного элемента?
1) 1s22s22p1
2) 1s22s22p63s1
3) 1s22s22p63s23p1 3bm
4) 1s22s22p63s23p6
5) 1s22s22p3
Какой химический элемент образует основание с наиболее ярко выраженными свойствами
1) кальций
2) магний 4bl
3) алюминий
4) калий
5) берилий
Химический элемент имеет следующее распределение электронов по электронным слоям в атоме 2.8.6. Какое положение он занимает в периодической системе химических элементов Д.И. Менделеева:
1) 6 период 6 группа 2bm
2) 3 период 6 группа
3) 2 период 6 группа
4) 3 период 2 группа
5) 2 период 8 группа
Квантовые числа последнего электрона в атоме элемента, равны n = 5, l = 1, m = -1, ms = -
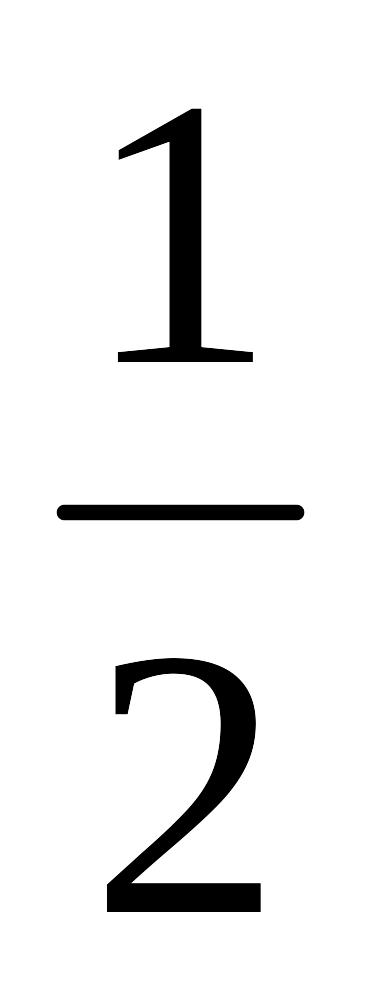 .
Где находится этот элемент в периодической
системе?
.
Где находится этот элемент в периодической
системе?
1) 5 период , первая группа
2) 5 период, главная подгруппа 4 группы 4bm
3) 4 период, шестая группа
4) 5 период, шестая группа главная подгруппа
5) 5 период , шестая группа побочная подгруппа.
Формула высшего оксида химического элемента ЭО2. К какой группе главной подгруппы периодической системы химических элементов Д.И. Менделеева принадлежит этот элемент?
1) первая
2) вторая 4bm
3) третья
4) четвертая
5) шестая.
Из приведенного перечня элементов - Li, Na, Ag, Au, Ca, Ba- к щелочным металлам относятся:
1) все металлы;
2) Li, Na; 2bn
3) Li, Na, Ag, Au;
4) Li, Na, Ca;
5) Ag, Au.
В ряду от Li к Fr :
1) усиливаются металлические свойства;
2) уменьшаются металлические свойства; 1bm
3) уменьшается атомный радиус;
4) усиливается связь валентных электронов с ядром;
5) уменьшается активность по отношению к воде
К металлам не относится последовательность элементов:
1) Ca, Zn, Cd;
2) Ti, Cr, Mn; 3bl
3) B, As, Te;
4) Na, Cu, Ni;
5) K, Ag V.
С ростом порядкового номера элемента кислотные свойства оксидов N2O3 - P2O3 - As2O3
- Sb2O3 - Bi2O3
1) усиливаются;
2) ослабевают; 2bl
3) остаются неизменными;
4) усиливаются, затем ослабевают;
5) ослабевают, затем усиливаются.
137. Молекула аммиака имеет форму:
1) изогнутую;
2) линейную; 4cm
3) плоскостную;
4) пирамидальную;
5) октаэдрическую.
В ряду С-Si-Ge-Sn-Pb неметаллические признаки элементов:
1) возрастают;
2) ослабевают; 2bl
3) не изменяються;
4) возрастают а затем ослабевают;
5) ослабевают а затем возрастают.
Валентные орбитали у атома углерода в молекуле метана СН4 можно описать на основе
представлений о гибридизации типа ( sp; sp2; sp3; d2sp3; dsp2 ).
При этом молекула метана имеет форму:
1) линейную;
2) плоскую; 3bm
3) тетраэдрическую;
4) октаэдрическую;
5) квадратную.
Валентные орбитали у атома кремния в молекуле силана SiH4 можно описать на основе представления о гибридизации типа (sp; sp2; sp3 ; d2sp3; dsp2).
Поэтому молекула силана имеет форму:
1) линейную;
2) плоскую; 3bm
3) тетраэдричесую;
4) октаэдрическую;
5) квадратную.
Какое максимальное число ковалентных связей может образовывать атом азота:
3
4 2bn
5
6
7
Атом азота молекулы аммиака с ионом водорода образует:
ионную связь;
ковалентную связь по обменному механизму; 4bl
неполярную ковалентную связь;
ковалентную связь по донорно - акцепторному механизму;
водородную связь.
Какое утверждение неверно:
Ковалентная связь обладает насыщаемостью;
Ковалентная связь обладает направленностью; 4bn
Ионная связь обладает ненасыщаемостью;
Ионная связь обладает насыщаемостью;
Ионная связь обладает ненаправленностью.
144. Какое утверждение неверно:
1) Ковалентная связь обладает насыщаемостью;
2) Ковалентная связь обладает направленностью;
3) Ионная связь обладает ненасыщаемостью;
4) Ионная связь обладает направленностью; 4bn
5) Ионная связь обладает ненаправленностью.
“Закономерности химических процессов и их энергетика”
Какие изменения температуры Т и давления Р способствует образованию СО по реакции С(тв.) + СО2(г.)
 2СО
(г.) -119,8 кДж:
2СО
(г.) -119,8 кДж:
1) повышение Т и повышение Р;
2) повышение Т и понижение Р;
3) понижение Т и повышение Р; 2bm
4) понижение Т и понижение Р;
5) повышение Р.
Закон действия масс был открыт:
1) М.В. Ломоносовым
2) Г.И. Гессом 4dn
3) Дж.У. Гиббсом
4) К. Гульдбергом и П. Вааге
5) Вант – Гоффом
Какая из указанных систем является гомогенной
1) раствор хлорида натрия
2) вода со льдом
3) насыщенный раствор с осадком 1bn
4) уголь и сера в атмосфере воздуха
5) смесь бензина с водой
Величина константы скорости химической реакции не зависит
1) от природы реагирующих веществ 4cn
2) от температуры
3) от присутствия катализаторов
4) от концентрации веществ
5) ни от каких факторов
Энергия активации – это
1) энергия, необходимая для отрыва электрона от атома 2dn
2) избыточная энергия которой должны обладать молекулы в расчете на 1 моль для ого, чтобы их столкновение могло привести к образованию нового вещества
3) потенциал ионизации
4) энергия, которая выделяется в результате реакции
5) энергия, которая выделяется при присоединении электрона к атому.
Возрастание скорости реакции с ростом температуры принято характеризовать:
1) константой скорости химической реакции 3dn
2) константой химического равновесия
3) температурным коэффициентом скорости реакции
4) коэффициентом пропорциональности
5) энергией активации
Величина константы равновесия зависит:
1) от природы реагирующих веществ и присутствия катализаторов
2) от температуры и присутствия катализаторов 4dn
3) от давления и присутствия катализаторов
4) от природы реагирующих веществ и температуры
5) только от природы реагирующих веществ.
В какой из ниже приведенных обратимых реакций изменение давления не вызовет нарушения равновесия:
1) 2SO2 + O2 ↔2SO3
2) 4HCl + O2 ↔ 2H2O + 2Cl2 3cm
3) H2 + I2 ↔ 2HI
4) 2CO ↔ CO2 + C тверд.
5) 2Н2 + О2 ↔ 2Н2О
176. Реакция, протекающая с повышением энтальпии системы (ΔН > 0) называется:
1) экзотермической 4cm
2) изотермической
3) окислительно – восстановительной
4) эндотермической
5) гетерогенной.
Тепловой эффект химической реакции при постоянном давлении равен:
1) изменению внутренней энергии 3cm
2) изменению энтропии
3) изменению энтальпии
4) сумме теплот образования конечных продуктов
5) сумме теплот образования исходных веществ.
Какая из указанных реакций является эндотермической?
1) 2SO2 + O2 = 2SO3 ; ∆H0 = -196,6 кДж
2)
ZnSO4
= ZnO + SO3
; ∆H0
= +234,0 кДж![]() 2cm
2cm
3) CH4 + 2O2 = CO2 + 2H2O; ∆H0 = -892,0 кДж
4) 2H2 (г) + O2 (г) = 2H2O (ж) ; ∆H < 0
5) H2 (г) + Cl2 (г) = 2HCl (г) ; ∆H0 = -185,0 кДж
179. Какое утверждение неверно для описания системы N2 + 3H2 ↔ 2NH3; ∆H < 0
1) равновесие в системе смещается влево при повышении температуры; 5cm
2) равновесие смещается вправо при понижении температуры;
3) равновесие смещается влево при понижении давления;
4) равновесие смещается вправо при повышении давления;
5) равновесие смещается вправо при понижении давления.
180. Какой случай является условием самопроизвольного протекания химической реакции в
прямом направлении:
∆ G=О
∆ G< О 2cm
∆ G >О
4) ∆ G = + 100 кДж
5) ∆ G = + 150 кДж
181. Какое изменение произойдет в равновесной системе N2 + 3H2 ↔ 2NH3; ∆ H0 =– 92,4 кДж
при повышении давления:
Равновесие не смещается;
Равновесие сместится в левую сторону; 4cm
Равновесие сместится в сторону образования азота;
Равновесие сместится в правую сторону;
Скорость обратной реакции увеличится.
182. Какое изменение произойдет в равновесной системе N2 + 3H2 ↔2NH3; ∆H0 = – 92,4
кДж при понижении температуры:
Равновесие не смещается;
Равновесие сместится в левую сторону;
Равновесие сместится в сторону образования азота;
Равновесие сместится в правую сторону; 4cm
Скорость обратной реакции увеличится.
183. Какое изменение произойдет в равновесной системе N2 + 3H2 ↔ 2NH3; ∆ H0 =– 92,4 кДж
при удалении из системы аммиака:
Равновесие не смещается;
Равновесие сместится в левую сторону;
Равновесие сместится в сторону образования азота;
Равновесие сместится в правую сторону; 4cm
Скорость обратной реакции увеличится.
184.
Какое внешнее воздействие сместит
равновесие в системе: 2СO+O2![]() 2СO2;
2СO2;
∆ H0 = – 566 кДж влево:
Понижение температуры;
Повышение давления;
Удаление из системы СO2;
Добавление в систему O2;
Понижение давления. 5cm
185. Какое внешнее воздействие сместит равновесие в системе: 2СO+O2 2СO2;
∆ H0 = – 566 кДж влево:
Понижение температуры;
Повышение давления;
Удаление из системы СO2;
Добавление в систему O2;
Повышение температуры. 5cm
186. Какое внешнее воздействие сместит равновесие в системе: 2СO+O2 2СO2;
∆ H0 =– 566 кДж вправо:
Повышение температуры;
Понижение давления;
Удаление из системы СO;
Добавление в систему СO2;
Понижение температуры. 5cm
187. Как называется тепловой эффект процесса, протекающего при постоянном давлении:
Внутренней энергией;
Полной энергией;
Энтропией;
Энтальпией; 4cm
Изохорно – изотермическим потенциалом.
188. Какое выражение соответствует изобарно- изотермическому потенциалу реакции:
∆ Н = ∆ U + А
Δ G = Δ Н –Т Δ S 2cn
Δ F = ∆ U –Т Δ S
Q V = ∆ U
Q p = ∆ U + А
189. Выражение теплового эффекта изохорного процесса:
∆ Н = ∆ U + А
Δ G = Δ Н –Т Δ S
Δ F = ∆ U + Т Δ S
Q V = ∆ U 4cn
Q p = ∆ U + А
190. Выражение теплового эффекта изобарного процесса:
∆ Н = ∆ U + А 1cn
Δ G = Δ Н –Т Δ S
Δ F = ∆ U + Т Δ S
Q V = ∆ U
S = k lnW
“РАСТВОРЫ, теория электролитической диссоциации”
191. При разбавлении серной кислоты всегда приливают кислоту к воде. Чем опасно
разбавление концентрированной H2SO4 приливанием к ней воды:
1) может возникнуть пожар;
2) может произойти разложение воды; 4dn
3) может выделиться ядовитый газ;
4) может произойти разбрызгивание раствора вследствие выделения теплоты;
5) не знаю.
Между какими веществами (электролит берется в виде водного раствор1) произойдет химическая реакция:
1) Pb и MgCl2;
2) Zn и MgCl2; 3al
3) Zn и Pb(NO3)2;
4) Zn и NaCl;
5) Fe и K2SO4.
Во сколько раз нужно увеличить концентрацию катионов водорода, чтобы рН раствора уменьшился на 1:
1) 0, 1;
2) 1; 4cm
3) 2, 3;
4) 10;
5) 2.
Гидролиз какой соли протекает полнее (при одинаковом разбавлении растворов):
1) СН3СООК; 4cm
2) KF;
3) AI2(SO4)3;
4) AI2S3;
5) Na2CO3.
При гидролизе какой соли в водном растворе рН<7:
1) BaF2;
2) ZnCI2;
3) Na2S; 2cm
4) CH3COONH4;
5) NaCN.
В растворе какой соли метилоранж приобретает розовую окраску:
1) MgCI2;
2) CH3COONH4; 1cm
3) K2S;
4) Ca(NO3)2;
5) NaCI.
Какое вещество следует добавить, чтобы увеличить степень гидролиза ацетата калия:
1) KCN;
2) K2SO3; 4cm
3) NaCI;
4) Mg(NO3)2;
5) K2S.
Определите значение рН водного раствора, если концентрация ионов гидроксида равна
10-11 моль/л:
1) 2; 2cm
2) 3;
3) 5;
4) 11;
5) 1.
199. Какая из солей подвергается полному гидролизу:
1)MgSO4;
2) AICI3;
3) (NH4)2S; 3cm
4) BaCI2;
5) KCI.
200. В растворе какой соли рН=7:
1) Cu(NO3)2;
2) Ba(NO3)2; 2cm
3) SnCI2;
4) Ca(CN)2;
5) Na2S
В растворе какой соли фенолфталеин приобретает малиновую окраску:
1) NH4CIO4;
2) K2CO3;
3) BaI2; 2cm
4) CaSO4;
5) ZnCI2.
Какова реакция водного раствора гидрокарбоната натрия:
1) слабокислая;
2) слабощелочная; 2cm
3) нейтральная;
4) сильнощелочная;
5) сильнокислая.
Во сколько раз нужно увеличить концентрацию анионов гидроксида в растворе, чтобы рН увеличить на 1:
1) 0, 1;
2) 1;
3) 2, 3; 4cm
4) 10;
5) 2.
В растворах какой соли синеет лакмусовая бумажка:
1) Na3PO4;
2) NiSO4;
3) NaI; 1cm
4) Co(NO3)2;
5) CuCI2.
Какое вещество следует добавить, чтобы уменьшить степень гидролиза хлорида аммония:
1) HCI;
2) NaOH; 1cm
3) (NH4)2S;
4) KCI;
5) NaCI.
206.Определите значение рН водного раствора, если концентрация ионов гидроксида 10-2
моль/л:
1) 2;
2) 5;
3) 9; 4cm
4) 12;
5) 5/10.
207. Какая из солей подвергается полному гидролизу:
1) MqS;
2) BiCl3; 1cm
3) Al2(SO4)3;
4) Ca(CN)2; 5) NaNO3.
В водном растворе концентрация катионов водорода равна 10-3 моль/л. Каково значение рОН в этом растворе:
1) 3;
2) 4; 4cm
3) 10;
4) 11;
5) 5/14.
209. Сколько граммов NаОН содержится в 1 литре 0,5 н. раствора:
1) 40 г
2) 10 г 3bm
3) 20 г
4) 30 г
5) 15 г
210. Сколько граммов Н2SО4 содержится в 1 литре 1 н. раствора:
1) 49 г
2) 98 г 1bm
3) 196 г
4) 24,5 г
5) 56 г
Какое утверждение не соответствует характеристике истинных растворов:
1) растворы – это гомогенные системы;
2) растворы – это многокомпонентные системы; 4bl
3) в растворах вещество дробится до атомно – молекулярного уровня;
4) в растворах содержатся видимые невооруженным глазом частицы веществ;
5) в растворах между молекулами растворителя и частицами растворенного вещества образуются промежуточные соединения.
212.Какое утверждение не соответствует характеристике истинных растворов:
1) растворы – это гомогенные системы;
2) растворы – это многокомпонентные системы; 5bl
3) в растворах вещество дробится до атомно – молекулярного уровня;
4) в растворах между молекулами растворителя и частицами растворенного вещества образуются промежуточные соединения
5) в растворах содержатся крупные агрегаты ассоциированных молекул или макромолекулы высокомолекулярных соединений.
213.Чему равен рН раствора, если молярная концентрация гидроксид- ионов в нем равна10-10 моль/л:
1) 2 3cm
2) 10
3) 4
4) 6
5) 7
214.Сколько граммов воды содержится в 200 г 5 % - ного раствора NaCl:
1) 190 г
2) 195 г 1dm
3) 95 г
4) 180 г
5) 185 г
215.Какой из приведенных электролитов является слабым?
