
- •4.2. Основні елементи кінематики рівномірного обертального руху
- •5. Закон Гука. Діаграма напружень.
- •6. Обертовий рух. Основний закон динаміки обертового руху. Теорема Штейнера.
- •7.Механічний принцип відносності і перетворення Галілея.
- •8. Елементи ств Енштейна. Перетворення Лоренца і наслідки що з нього випливають.
- •5.Фаза коливань.
- •Перетворення енергії при гармонічних коливаннях
- •18. Основне рівняння мкт ідеального газу
- •17/////4.6. Внутрішня енергія і теплоємність ідеального газу
- •Розподіл частинок у потенціальному силовому полі
- •Перше начало термодинаміки
- •21. Оборотні процеси. Цикли. Теплові двигуни і холодильні машини. Друге начало термодинаміки.
- •33. Робота і потужність у колі постійного струму. Закон Джоуля-Ленца
- •34. Розгалужені кола. Правила Кірхгофа.
- •35. Електричний струм в металах, газах та рідинах.
- •36. Магнітне поле та його характеристики.
- •41 Самоіндукція і взаємоіндукція. Індуктивність.
- •42 Енергія магнітного поля.
- •§ 2. Інтерференція світла в тонких плівках
- •49 Дифракція світла
- •Дифракція на щілині[
- •55. Закони випромінювання абсолютно чорного тіла Закон випромінювання Планка
- •Три закони фотоефекту:
- •58. Ефект Комптона
- •61.Співвідношення невизначеностей Гейзенберга
- •62.Хвильова функція і її статистичний зміст
- •63.Рівняння Шредінгера
- •64. Постулати Бору
- •69. Реакції поділу та синтезу ядер.
- •70. Природна радіоактивність ядер. Закон радіоактивного розпаду.
Розподіл частинок у потенціальному силовому полі
Повний безлад, яким характеризується тепловий рух молекул, все ж таки має свої закони. Не дивлячись на те, що кожна молекула постійно змінює свою швидкість, макроскопічний стан газу в системі не змінюється (саме такі роздуми призвели до встановлення Максвелом у 1859 році розподілу молекул газу по швидкостях).
Рівноважний стан газу характеризується не тільки розподілом молекул по швидкостях, але і по координатах. При відсутності зовнішніх силових полів цей розподіл буде однорідним: газ рівномірно розподіляється по всьому об’єму посудини.
Яким буде розподіл молекул газу при наявності поля (наприклад поля тяжіння), яке діє на молекули?
Добре відомо, що атмосферний тиск зменшується з висотою. Наприклад, на висоті 5 600 м тиск дорівнює ½ тиску на рівні моря. Однак звідси не слід робити висновок, що на висоті вдвічі більшій зовсім немає молекул – літаки літають і на висотах 30 000м.
Знайдемо розподіл молекул газу в однорідному полі тяжіння з висотою.
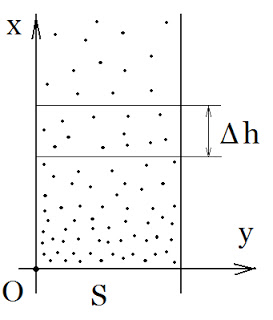
Розглянемо вертикальний стовп газу з площею основи S і виділимо на висоті h елемент (прошарок) Δh. Зауважу, що даний елемент є настільки малий, що в ньому можна рахувати р=const, і настільки великий, щоб можна було говорити про тиск молекул повітря цього прошарку.
Запишемо умову механічної рівноваги:
(p(h)S = Δmg + p(h+Δh)S) → (p(h) = ρgΔh + p(h+Δh)) → (p(h+Δh) - p(h) = - ρgΔh) →
→ (Δp = - ρgΔh).
З рівняння стану ідеального газу (рівняння Клапейрона- менделєєва) знайдемо густану повітря у виділеному прошарку:
ρ = pμ/(RT).
Піставивши значення густини в умову рівноваги та розділивши змінні отримаємо:
Δp/p = -(μg/(RT))•Δh.
Проінтегрувавши останній вираз отримаємо:
lnp = -μgh/(RT) + lnC,
де С – деяка константа, яку знаходимо з умови, що тиск повітря на нульовій висоті дорівнює одній атмосфері, тобто р0.
Пропотенціювавши останній вираз отримуємо шукане значення тиску
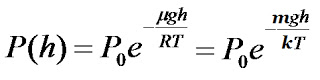
Останні співвідношення називають барометричною формулою.
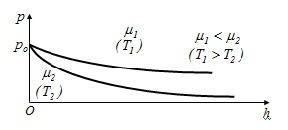
З цього співвідношення можемо зробити висновок, що тиск зменшується із висотою тим швидше, чим важчий є газ (більше μ) і чим нижча температура.
Знаємо з основного рівняння МКТ, що p = nkT, тобто тиск пропорційний концентрації. Підставляючи це в барометричну формулу, отримаємо рівноважний розподіл молекул в довільному потенціальному полі, який носить назву розподіл Больцмана.
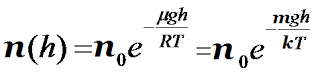
Додатково.
Загальна теорія рівноважних статистичних розподілів була створена Гібсом. Він показав, що в стані теплової рівноваги закон розподілу молекул по довільній величині, що характеризує її стан (координата, швидкість, енергія тощо) має експоненціальний характер, причому в показнику експоненти стоїть взяте зі знаком мінус відношення характерної енергії молекул до величини кТ, яка пропорційна середній кінетичній енергії хаотичного руху молекул.
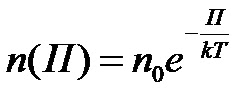
20/////// Перше начало термодинаміки
Перше начало термодинаміки
 Термодинаміка –
це розділ фізики, в якому з найбільш
загальних позицій (без розгляду
молекулярних уявлень про будову речовини)
розглядаються процеси обміну енергії
між об’єктом, який вивчається та
оточуючим його середовищем.
Термодинаміка –
це розділ фізики, в якому з найбільш
загальних позицій (без розгляду
молекулярних уявлень про будову речовини)
розглядаються процеси обміну енергії
між об’єктом, який вивчається та
оточуючим його середовищем.
У природі існує закон збереження і перетворення енергії.
У всіх процесах, які проходять в природі, енергія не зникає безслідно і не створюється з нічого, а переходить від одного тіла до іншого і перетворюється з одного виду в інший в еквівалентних кількостях.
Усі форми енергії: кінетична, потенціальна, внутрішня, електромагнітна, хімічна, внутрішньоатомна тощо здатні перетворюватися одна в одну. І саме можливість взаємного перетворення усіх форм енергії зумовлює багатство і різноманітність явищ природи.
Закон збереження і перетворення енергії відкрито в середині ХІХ ст. німецьким вченим-лікарем Р. Майєром (1814-1878) та англійським вченим Д. Джоулем (1818-1889). Найповніше закон був сформульований у працях німецького науковця Г. Гельмгольца (1821-1894).
Закон збереження і перетворення енергії, поширений на теплові явища, називаєтьсяпершим началом (законом) термодинаміки.
О-ве начало термодинаміки
Будь-яка ізольована система прямує до стану теплової рівноваги. Ізольована система не може сама вийти із стану рівноваги.
1-ше начало термодинаміки
(Існують два рівноправні формулювання першого начала термодинаміки).
Зміна внутрішньої енергії системи у випадку переходу її з одного стану в інший дорівнює сумі роботи зовнішніх сил і кількості теплоти, переданої системі:
ΔU = ΔA +ΔQ
Кількість теплоти, переданої системі, витрачається на зміну її внутрішньої енергії і на виконання системою роботи над зовнішніми тілами:
ΔQ = ΔU + ΔA’
Існує принципово інше формулювання першого закону термодинаміки:
Неможливий вічний двигун (perpetum mobile) першого роду.
Вічний двигун першого роду – уявний двигун, який раз запущений в дію, виконував би роботу як завгодно довго без надходження енергії ззовні.
Вічний двигун другого роду – уявний тепловий двигун, який безпосередньо працював би, перетворюючи всю взяту із навколишнього середовища теплоту в роботу.
Перше начало термодинаміки не забороняє існування і роботу вічного двигуна другого роду.
Запис першого начала термодинаміки при ізохоричному процесі.
Оскільки при ізохоричному процесі V = const, то ΔV = 0 і ΔА = 0, тому
ΔU = ΔQ
Запис першого начала термодинаміки при ізобаричному процесі.
ΔU = ΔA +ΔQ; ΔQ = ΔU + ΔA’
Запис першого начала термодинаміки при ізотермічному процесі.
Оскільки при ізотермічному процесі Т = const, то ΔТ = 0 і ΔU = 0, тому
ΔQ = ΔA’; ΔQ = -ΔA
Запис першого начала термодинаміки при адіабатичному процесі.
Адіабатичним називають процес стиснення або розширення газу без теплообміну з зовнішнім середовищем: ΔQ = 0, тому
ΔU = ΔA; ΔU = -ΔA’.
