
- •Вопрос 20 Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Шкала водородного показателя. Индикаторы. Изменение окраски индикаторов в зависимости от реакции среды.
- •Вопрос 23 Классификация окислительно-восстановительных реакций. Приведите примеры реакций каждого типа. Составьте уравнения соответствующих реакций с помощью метода электронного баланса.
- •Вопрос 26 Водородный электрод. Устройство и электродные процессы. Стандартный водородный электрод. Зависимость величины потенциала водородного электрода от рН среды
- •Вопрос 30 Электродные процессы при коррозии металлов. Катодные реакции в кислых, нейтральных и щелочных средах. Чем может быть вызвана электрохимическая гетерогенность поверхности металла?
- •Вопрос 31 Электролиз с растворимыми и нерастворимыми электродами. Порядок разряда ионов на электродах при электролизе. Законы Фарадея. Практическое применение процессов электролиза.
- •Вопрос 34 Способы защиты металлов от коррозии. Неметаллические защитные покрытия. Виды неметаллических защитных покрытий и их применение.
- •Вопрос 35 Способы защиты металлов от коррозии. Электрохимическая защита. Протекторная защита и катодная защита.
1.
Вещество в химии — физическая субстанция со специфическим химическим составом.
Мате́рия (от лат. materia — вещество) — философская категория для обозначения физической субстанции вообще.
А́том (от др.-греч. ἄτομος — неделимый) — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и электронов.
Хими́ческий элеме́нт — совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева.
Моль (единица кол-ва вещ-ва) Моль, единица количества вещества, т. е. величины, оцениваемой количеством содержащихся в физической системе тождественных структурных элементов (атомов, молекул, ионов и других частиц или их специфических групп).
А́томная ма́сса, относительная атомная масса— значение массы атома, выраженное в атомных единицах массы.
Абсолютная атомная масса-это истинная масса эллемента.
Молекуля́рная ма́сса (менее правильный термин: молекулярный вес) — масса молекулы, выраженная в атомных единицах массы.
Абсолютная масса атома (m) равна относительной атомной массе, умноженной на 1 а.е.м.
2.
Чтобы описать качественный состав вещества, перечисляют, атомы каких элементов входят в состав этого вещества.
При описании количественного состава молекулярного вещества указывают атомы каких элементов и в каком количестве образуют молекулу данного вещества.
При описании количественного состава немолекулярного вещества указывают отношение числа атомов каждого из элементов, входящих в состав этого вещества.
Моля́рный объём — объём одного моль вещества, величина, получающаяся от деления молярной массы на плотность. Характеризует плотность упаковки молекул.
Число́ Авога́дро, конста́нта Авогадро, постоянная Авогадро — физическая величина, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества.
3.
1. Закон сохранения массы веществ (М. В. Ломоносов, 1748-1756 гг., А. Лавуазье, 1777 г.).
Масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате реакции.
2. Закон постоянства состава вещества (Ж. Л. Пруст, 1808 г.).
Каждое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Закон сохранения массы — закон физики, согласно которому масса физической системы сохраняется при всех природных и искусственных процессах.
Закон постоянства состава (Ж.Л. Пруст, 1801—1808гг.) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами.
ОБЪЕМНЫХ ОТНОШЕ́НИЙ ЗАКО́Н, один из Гей-Люссака законов (см. ГЕЙ-ЛЮССАКА ЗАКОНЫ), которому подчиняются идеальные газы (см. ИДЕАЛЬНЫЙ ГАЗ). Установлен Ж. Л. Гей-Люссаком (см. ГЕЙ-ЛЮССАК Жозеф Луи) в 1808 г.
Закон объемных отношений гласит, что при постоянном давлении и температуре объемы газов, вступающих в химическую реакцию, находятся в простых отношениях друг к другу и к объемам газообразных продуктов реакции, то есть отношение объемов, в которых газы участвуют в реакции, соответствует отношению небольших целых чисел.
Измеряя при одинаковых условиях объемы водорода, хлора и хлористого водорода, Гей-Люссак нашел, что один объем водорода и один объем хлора, соединяясь, дают два объема хлористого водорода, то есть отношение объемов равно 1 : 1 : 2. Аналогичная картина имеет место и при других реакциях с участием газов: 2 объема водорода соединяются с 1 объемом водорода, давая 2 объема водяного пара.
Закон Авога́дро — одно из важных основных положений химии, гласящее, что «в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул». Было сформулировано ещё в 1811 году Амедео Авогадро (1776—1856), профессором физики в Турине.
Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём.
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.
Относительная плотность газа - это отношение молярной массы данного газа к молярной массе того газа, по которому она находится.
4. Эквивалентная масса (Эм) называется масса одного эквивалента вещества (элемента).
Эквивалентные массы ранее рассмотренных элементов равны Эм(Cl)=35.3 г/моль, Эм(O)=8 г/моль.
Эквивалентную массу любого элемента можно определить по формуле: Эм=μ/СО, где СО- абсолютная величина степени окисления в соединениях. Поскольку большинство элементов имеют переменную степень окисления, то значения их эквивалентов в различных соединениях различно. Например найдем
Если в задаче указаны объемы газов, то удобнее пользоваться понятием эквивалентный объем, вычисляемый с помощью закона Авогадро. Эквивалентным объемом называется объем занимаемый при н.у. одним эквивалентом вещества. Так 1 моль водорода, т.е. 2г. Занимает объем 22.4л., следовательно 1г. (т.е. одна эквивалентная масса), будет занимать 11,2л. Аналогично можно найти эквивалентный объем кислорода который равен 5.6л.
Закон эквивалентов.
Массы реагирующих веществ, а также продуктов реакции пропорциональны изх эквивалентным массам. m1/m2=Эм1/Эм2
Для химической реакции:
νаА+νвВ=νсС+νдД справедливо nЭм(А)=nЭм(В)=nЭм(С)=nЭм(Д)
Где nЭм – число эквивалентных масс. Поэтому если известно число эквивалентных масс одного из веществ, то отпадает необходимость в подсчете числа Эм оставшихся веществ. Очевидно, что число эквивалентных масс равно отношению массы вещества к эквивалентной массе.
Закон эквивалентов для эквивалентных объемов записывается в следующем виде: V1/V2=Эv1/Эv2
5.
Квантовые числа: (0, 1, 2,...) или полуцелые (1/2, 3/2, 5/2,...) числа, определяющие возможные дискретные значения физических величин, которые характеризуют квантовые системы (атомное ядро, атом, молекулу) и отдельные элементарные частицы.
Характеристика электрического состояния электрона системой квантовых чисел : главное , орбитальное , магнитное и спиновое квантовые числа .
В одномерной модели атома энергия электрона может принимать только определенные значения, иначе говоря — она квантована. Энергия электрона в реальном атоме также величина квантованная. Возможные энергетические состояния электрона в атоме определяются величиной главного квантового числа п, которое может принимать положительные целочисленные значения: 1, 2, 3... и т. д. Наименьшей энергией электрон обладает при п = 1; с увеличением п. энергия электрона возрастает. Поэтому состояние электрона, характеризующееся определенные значением главного квантового числа , принято называть энергетическим уровнем электрона в атоме: при n = 1 электрон находится на первом энергетическом уровне, при n = 2 на втором и т. д. Главное квантовое число определяет и размеры электронного облака. Для того чтобы увеличить размеры электронного облака, нужно часть его удалить на большее расстояние от ядра. Произвольной не может быть и форма электронного облака. Она определяется орбитальным квантовым числом (его называют также побочным или азимутальным), которое может принимать целочисленные значения от 0 до (п — 1), где п — главное квантовое число . Различным значениям п отвечает разное число возможных значений . Так, при я = 1 возможно только одно значение; орбитального квантового числа —• нуль (/ = 0), при п= 2 l может быть равным 0 или 1, при я = 3 возможны значения /, равные О, 1 и 2; вообще, данному значению главного квантового числа п соответствуют п различных возможных значений орбитального квантового числа . Из уравнения Шредингера следует, что, и ориентация электронного облака в пространстве не может быть произвольной: она определяется значением третьего, так называемого магнитного квантового числа т.п. Магнитное квантовое число может принимать любые целочисленные значения, — как положительные, так и отрицательные, в пределах от + L до - L. Таким образом, для разных значений число возможных значений m различно. Так, для s-электронов (l= 0} возможно только одно значение т (m- 0); для p-электронов (L=1) возможны три различных значения т. Помимо квантовых чисел п, I и т, электрон характеризуется еще одной квантованной величиной, не связанной с. движением электрона вокруг ядра, а определяющей его собственное состояние. Эта величина получила название спинового квантового числа или просто спина; спин обычно обозначают буквой S. Спин электрона может иметь только два значения. Таким образом, как и в случае остальных квантовых чисел , возможные значения спинового квантового числа различаются на единицу.
Возбужденное состояние атома - энергетически нестабильное состояние, в которое атом переходит, получая энергию извне. В возбужденном состоянии атом может пребывать лишь короткое время. Возбужденный атом, отдавая энергию, возвращается в основное состояние.
Основное энергетическое состояние атома ( нормальное состояние атома ) – это энергетический уровень при n = 1.
6.
Наиболее важной характеристикой состояния электрона в атоме является энергия электрона, которая согласно законам квантовой механики изменяется не непрерывно, а может принимать только вполне определённые значения. Таким образом, можно говорить о наличии в атоме набора энергетических уровней.
Энергетический уровень — совокупность АО с близкими значениями энергии. Энергетические уровни нумеруют с помощью главного квантового числаn, которое
принимает целочисленные положительные значения (n=1,2,3…). Чем больше значение
n, тем выше энергия электрона и данного энергетического уровня. Каждый атом содержит
бесконечное число энергетических уровней, часть из которых в основном состоянии атома заселена электронами, а часть — нет (эти энергетические уровни заселяются в возбуждённом состоянии атома ).
Электронный слой — совокупность электронов, находящихся на данном энергетическом уровне. Иными словами, электронный слой – это энергетический уровень, содержащий электроны.
Совокупность электронных слоёв образует электронную оболочку атома .
Принцип наименьшей энергии.
Максимальная устойчивость атома (как системы) соответствует минимуму его полной энергии. В атоме каждый электрон стремится занять положение, соответствующее минимальному значению энергии, что отвечает наибольшей его связи с ядром. Последовательность заполнения энергетических уровней и подуровней в атоме электронами происходит в соответствии с этим принципом наименьшей энергии.
Принцип Паули. Изучая многочисленные, спектры атомов швейцарский физик В. Паули в 1925 году пришел к выводу, который получил название принципа или запрета Паули: „Двум электронам атома запрещено быть во всех отношениях похожими друг на друга" или, что то же самое, „в атоме не может быть даже двух электронов с одинаковыми значениями всех четырех квантовых чисел". Энергетические состояния электронов, характеризуемые одинаковыми значениями трех квантовых чисел: n, I и m1 принято обозначать энергетической ячейкой.
Правило Гунда.
Электроны в пределах данного подуровня располагаются сначала каждый в отдельной ячейке в виде неспаренных „холостых" электронов. Иными словами, при данном значении I электроны в атоме располагаются так, что суммарное спиновое число их максимально.
Периодическая система элементов Д. И. Менделеева, естественная классификация химических элементов, являющаяся табличным (или др. графическим) выражением периодического закона Менделеева. П. с. э. разработана Д. И. Менделеевым в 1869—1871.
Периодический закон Менделеева, фундаментальный закон, устанавливающий периодическое изменение свойств химических элементов в зависимости от увеличения зарядов ядер их атомов.
«свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Современная формулировка периодического закона гласит: «свойства химических элементов находятся в периодической зависимости от заряда ядра этих элементов».
22Ti 1s ² 2s ²2p ⁶3s ²3p ⁶4s ²3d ² Электронно-графические формулы этих атомов:
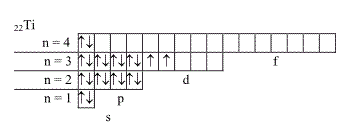
7.
Химическая связь — это взаимодействие атомов, обуславливающее устойчивость молекулы или кристалла как целого.
Ковалентная связь образуется, когда два атома могут «обобщить» электроны:
А . + В . → А:В
Ионная связь образуется, когда "обмен "становится настолько неравными, что электрон отрывается от своего атома А и полностью переходит к атому B, в результате чего образуется пара ионов:
А . + В . → А+ :В-
Полярная ковалентная связь
Если нет такого понятия, как "абсолютная ионная "связь, может быть есть полностью ковалентная? Ответ "да". Это случай, когда два ядра притягивают электрон с равным усилием. Это положение гарантируется для гомоядерных двухатомных молекул - молекул, состоящих из двух одинаковых атомов. Таким образом, в Cl2, O2, H2 электроны поделены между двумя одинаковыми атомами поровну. В таких молекулах, в центр положительного заряда, в точности совпадает центром отрицательного заряда - по середине между двумя ядрами. Связывающие электроны находятся в пространстве между связываемыми атомами.
Особенностью ковалентной связи является также ее поляризуемость. Если молекула состоит из двух атомов, которые связаны полярной связью, то такая молекула является полярной молекулой, т.е. представляет собой диполь.
Донорно-акцепторная связь
Другой тип химической связи - донорно-акцепторная. Различают обменный и донорно-акцепторный механизм образования связи. Ковалентная связь, образующаяся по донорно-акцепторному механизму (т.е. за счет пары электронов одного из атомов), называется дoнорно-акцeпторной. Так рассмотренный выше пример с LiF -есть пример донорно-акцептороной связи.
А : + В → А:В
Ионной называется связь между ионами, т. е. заряженными частицами, образовавшимися из атома или группы атомов в результате присоединения или
отдачи электронов Ионная связь характерна для солей и щелочей. Сущность ионной связи лучше рассмотреть на примере образования хлорида натрия. Натрий, как щелочной металл, склонен отдавать электрон, находящийся на внешнем электронном слое. Хлор же, наоборот, стремится присоединить к себе один электрон. В результате натрий отдает свой электрон хлору.
Металлическая связь — связь между ион-атомами в кристаллической решетке металлов и сплавах, осуществляемая за счет притяжения свободно перемещающихся (по кристаллу) электронов (Mg, Fe).
ДИПОЛЬНЫЙ МОМЕНТ электрический, векторная величина, характеризующая асимметрию распределения положит. и отрицат. зарядов в электрически нейтральной системе. Два одинаковых по величине заряда +q и —q образуют электрич. диполь с дипольным моментом m = q l, где l - расстояние между зарядами.
8.
Эне́ргией сродства́ а́тома к электро́ну, или просто его сродством к электрону (ε), называют энергию, выделяющуюся в процессе присоединения электрона к свободному атому Э в его основном состоянии с превращением его в отрицательный ион Э− (сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации соответствующего изолированного однозарядного аниона).
Электроотрицательность атома, величина, характеризующая способность атома в молекуле притягивать электроны, участвующие в образовании химической связи.
Относительная электроотрицательность – величина безразмерная. Ее значения приведены в приложении 10.
Так как относительная электроотрицательность зависит прежде всего от энергии ионизации атома (энергия сродства к электрону всегда намного меньше), то в системе химических элементов она изменяется примерно также, как и энергия ионизации, то есть возрастает по диагонали от цезия (0,86) ко фтору (4,10). Приведенные в таблице значения относительной электроотрицательности гелия и неона не имеют практического значения, так как эти элементы не образуют соединений.
Сте́пень окисле́ния (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
9.
Термодинамика химическая, раздел физической химии, рассматривающий термодинамические явления в области химии, а также зависимости термодинамических свойств веществ от их состава и агрегатного состояния.
Вну́тренняя эне́ргия термодинамической системы (обозначается как E или U) — это сумма энергий теплового движения молекул и межмолекулярных взаимодействий.
Энтропи́я (от др.-греч. ἐντροπία — поворот, превращение) — в естественных науках мера неупорядоченности системы, состоящей из многих элементов.
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста её энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Для типичных условий протекания химической реакции (Т = const, Р = const) термодинамическая возможность протекания реакции определяется знаком изменения значения энергии Гиббса ΔG системы во время прохождения реакции. Реакция протекает, если ΔG < 0.
10.
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики.
Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени. … Скорость реакций с участием газообразных реагентов зависит также от давления. Зависимость скорости реакции от концентрации.
Зависимость скорости реакции от концентрации . Все химические реакции можно разделить на гомогенные и гетерогенные. К гомогенным реакциям относятся реакции , протекающие между веществами , находящимися в одном агрегатном состоянии, если между ними отсутствуют поверхности раздела. К гомогенным реакциям относятся реакции между газами, неограниченно смешивающимися жидкостями и жидкими растворами. Гомогенные реакции протекают в объеме, т.е. имеются наиболее благоприятные условия для контакта молекул реагирующих веществ .
Реакции между веществами , находящимися в разных агрегатных состояниях, или в одном агрегатном состоянии, но разделенных поверхностями раздела относятся к гетерогенным реакциям . К ним относятся, например, реакции между газом и жидкостью, двумя несмешивающимися жидкостями, механическими смесями твердых веществ . В гетерогенных реакциях химический процесс протекает только на поверхностях раздела реагирующих фаз.
Зависимость скорости гомогенной реакции от концентрации определяется законом действующих масс (закон Гульдберга и Вааге, 1864-1867): Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов.
Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
11.
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени.
Зависимость скорости реакции от температуры . Для большинства реакций справедливо правило Вант-Гоффа: Повышение температуры на 10К увеличивает скорость большинства реакций в 2-4 раза.
Энергия активации в химии и биологии — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция.
12.
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации с, температуры t , присутствия катализаторов, а также от некоторых других факторов (например, от давления - для газовых реакций, от измельчения - для твердых веществ, от радиоактивного облучения).
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества [1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Зависимость скорости реакции от катализатора
Катализаторы – вещества, не расходующиеся в результате протекания реакции и не входящие в состав конечных продуктов реакции , но увеличивающие скорость реакции . Катализаторы могут участвовать в образовании промежуточных продуктов реакции , но к концу реакции они полностью регенерируются.
Явление изменение скорости под действием катализатора называется катализом, а реакции - каталитическими.
Теория каталитических реакций основана на следующих положениях:
а) катализ применим для реакций , в которых для данных условий энергия Гиббса отрицательна (G < 0);
б) в присутствии катализатора изменяется механизм реакции , она протекает через новые стадии с невысокой энергией активации;
в) при катализе не изменяется тепловой эффект реакции ;
г) для обратимых реакций катализатор не влияет на равновесие, не меняет константы равновесия и равновесных концентраций;
д) катализатор действует селективно (избирательно).
Различают положительный катализ (ускорение реакций) и отрицательный катализ (замедление реакций). Обычно термин « катализ » относят именно к положительному катализу , а отрицательный называют ингибированием. Соответственно «отрицательные катализаторы» называются ингибиторами.
Влияние катализатора Катализаторы - это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождается в конце реакции.
Влияние , оказываемое катализаторами на химические реакции, называется катализом.По агрегатному состоянию , в котором находятся катализатор и реагирующие вещества, следует различать:
гомогенный катализ ( катализатор образует с реагирующими веществами гомогенную систему, например, газовую смесь;
гетерогенный катализ ( катализатор и реагирующие вещества находятся в разных фазах; катализ идет на поверхности раздела фаз).
13.
Химическое равновесие — состояние химической системы, в котором протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
1. Влияние температуры . В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое - эндотермическому. N2 + 3H2 2NH3 + Q
Прямая реакция - экзотермическая, а обратная реакция - эндотермическая. Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам:При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры - в направлении экзотермической реакции.
2. Влияние давления . Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переоходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам:При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом;
при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом
3. Влияние концентрации . Влияние концентрации на состояние равновесия подчиняется следующим правилам:При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
14.
Растворы, макроскопически однородные смеси двух или большего числа веществ (компонентов), образующие термодинамически равновесные системы. В Р. все компоненты находятся в молекулярно-дисперсном состоянии; они равномерно распределены в виде отдельных атомов, молекул, ионов или в виде групп из сравнительно небольшого числа этих частиц. С термодинамической точки зрения Р. — фазы переменного состава, в которых при данных внешних условиях соотношение компонентов может непрерывно меняться в некоторых пределах. Р. могут быть газообразными, твёрдыми (см. Твёрдые растворы). Чаще же всего термин "Р." относят к жидким Р.
По степени раздробленности (дисперсности) системы делятся на следующие классы: грубодисперсные, размер частиц в которых более 10-5 м; тонкодисперсные (микрогетерогенные) с размером частиц от 10-5 до 10-7 м; коллоидно-дисперсные (ультрамикро-гетерогенные) с частицами размером от 10-7 до 10-9м. Если фиксировать внимание на двух основных компонентах дисперсных систем, то одному из них следует приписать роль дисперсионной среды, а другому - роль дисперсной фазы. В этом случае все дисперсные системы можно классифицировать по агрегатным состояниям фаз.
Когда вещество находится в окружающей среде в виде молекул или ионов, то такие растворы называют истинными, т.е. гомогенными однофазными растворами .
Обязательным условием получения дисперсных систем является взаимная нерастворимость диспергируемого вещества и дисперсионной среды. Например, нельзя получить коллоидные растворы сахара или хлорида натрия в воде, но они могут быть получены в керосине или в бензоле, в которых эти вещества практически нерастворимы.
Растворимость веществ в воде зависит от температуры. Как правило, растворимость твердых веществ в воде увеличивается с повышением температуры, а растворимость ионов — уменьшается, поэтому волу можно почти полностью освободить от растворенных в ней газов кипячением.
Коэффициент растворимости показывает, какую массу вещества надо растворить при определенных условиях в 100 г воды (или в 1 литре воды), чтобы получить насыщенный при данных условиях раствор. При записи коэффициента растворимости обязательно указывается вещество, растворитель и внешние условия (для веществ в твердом состоянии обычно в качестве внешних условий указывают только температуру).
некоторое время наступает процесс его насыщения.
В насыщенном растворе одновременно протекают два процесса: растворение и кристаллизация. При постоянной температуре скорость растворения и скорость кристаллизации равны, а поэтому концентрация насыщенного раствора при постоянной температуре постоянна. Следовательно, насыщенным называется раствор, который находится в динамическом равновесии с избытком растворенного вещества. Если концентрация какого-либо раствора будет меньше концентрации насыщенного раствора при данной температуре, то он называется ненасыщенным.
Раствор, концентрация которого больше концентрации насыщенного при данных условиях, называют пересыщенным.
15.
Растворы, макроскопически однородные смеси двух или большего числа веществ (компонентов), образующие термодинамически равновесные системы. В Р. все компоненты находятся в молекулярно-дисперсном состоянии; они равномерно распределены в виде отдельных атомов, молекул, ионов или в виде групп из сравнительно небольшого числа этих частиц. С термодинамической точки зрения Р. — фазы переменного состава, в которых при данных внешних условиях соотношение компонентов может непрерывно меняться в некоторых пределах. Р. могут быть газообразными, твёрдыми (см. Твёрдые растворы). Чаще же всего термин "Р." относят к жидким Р.
Количественное значение растворимости обычно выражают максимальной массой вещества в граммах, которую можно растворить в 100 г растворителя при данной температуре. Это количество называется коэффициентом растворимости или просто растворимостью (S).
В настоящее время для выражения количественного состава растворов используются различные способы. Наиболее часто используются следующие:
1. Концентрированный раствор – раствор , содержащий относительно большое количество растворенного вещества. В этом случае масса растворенного вещества соизмерима с массой растворителя.
Например, в 100 г воды растворено 30 г хлорида натрия (30 г и 100 г – сравнимые величины). Такой раствор можно считать концентрированным.
2. Разбавленный раствор – это раствор , в котором содержание растворенного вещества мало по сравнению с массой растворителя.
Например, в 100 г воды растворено 0,1 г гидроксида натрия. Это разбавленный раствор , так как массы растворенного вещества и растворителя сильно отличаются друг от друга.
Термины концентрированный и разбавленный используются лишь для приблизительного выражения количественного состава растворов . Границы между этими понятиями достаточно условны.
Массовая доля компонента системы равна отношению массы компонента к массе системы:
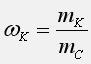
Объемная доля компонента системы равна отношению объема компонента к объему системы:
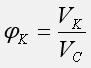
Мольная доля компонента системы равна отношению количества вещества компонента к количеству вещества системы:
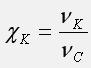
Массовая , объемная и мольная доли обладаю тремя общими свойствами:
Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора.
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов.
Моляльность — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности».
Например, в фотометрии часто используют массовую концентрацию , равную массе растворённого вещества в 1 л раствора. При приготовлении растворов кислот часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты.
Растворы –это гомогенные (однофазные) системы переменного состава, состоящие из двух илиболее веществ (компонентов). Растворение похоже на хим. реакцию, но составраствора может изменится в широких пределах. Кроме того, в свойствах растворовобнаруживаются свойства отдельных компонентов. Таким образом, раствор занимаетпромежуточную стадию между хим. соед. и механическими смесями.
Способыколичественного выражения состава растворов: приблизительные (концентр.раствор, разбавленный, ненасыщенный,пересыщенный).Точные: 1. Массовая доля:отношение массы растворённого вещества к массе раствора. 2.Объёмная доля φ=Vв-ва/Vр-ра .3.Мольная (молярная) доля χ=υв-ва/Σ υр-ра*100% отношение кол-ва растворённого вещ-ва к сумме кол-в всех веществ составляющихраствор. 4. Массовая концентрация.CМАСС=mв-ва/Vр-ра. (CМАСС= Смол*M) 5. Молярная концентрация Смол= υв-ва/ Vр-ра . 6.Молярнаяконцентрация эквивалента (нормальная) Снорм= υЭв-ва/ Vр-ра , Снорм= Смол/z .7.Моляльность Смоляльн= υв-ва/mрастворителя
Вопрос16. Растворы неэлектролитов. Давление насыщенного парарастворителя над раствором и над чистым растворителем. Закон Рауля. Как можнорассчитать повышение температуры кипения и понижение температуры замерзанияраствора по сравнению с растворителем?
Неэлектролиты– вещества с ковалентными неполярными или малополярными связями.
ОСМОС – явление, обусловленное переносом растворителячерез полупроницаемую мембрану. Закон Ван- Гоффа π=CRT , гдеπ –осмотическое давление.
Закон Рауля:Относительное понижение давления насыщенного пара растворителя над растворомравно мольной доле растворённого вещества. (Po-P)/Po=N.Второй закон Рауля – понижение температуры кипения и повышениетемпературы замерзания раствора прямо пропорционально моляльной концентрации раствора.
Δtкип=Ккип*m*1000/Mg=Kкип*Смоляльн,Δtзам=Кзам*m*1000/Mg=Kзам*Смоляльн
Вопрос17. Электролитическая диссоциация.Диссоциация слабых электролитов как равновесный процесс. Степень диссоциации иконстанта диссоциации. Факторы, влияющие на процесс диссоциации. Законразбавления Оствальда. Как будет влиять на состояние равновесия уксуснойкислоты введение в систему ацетата натрия?
Явление электролитической диссоциации: при растворении соли в воде ионы,образующие данный электролит, под действием полярных молекул воды отрываютсядруг от друга и перераспределяются между молекулами растворителя. Электролитическаядиссоциация- самопроизвольный процесс распада электролита в растворе собразованием положительно и отрицательно заряженных ионов, или соответственнокатионов и анионов. 1)Чем более полярен растворитель, тем больше степеньдиссоциации в нем данного электролита. 2)повышение температуры, как правило,увеличивает диссоциацию и при нагревании степень диссоциации возрастает. 3)приуменьшении концентрации электролита, т.е. при его разбавлении, степень дисс.увеличивается. Диссоциация слабых электролитов. Константа диссоциациисл. электролитов - это отношение произведения концентраций продуктов реакции кконцентрации реагентов. Степеньдиссоциации α - это отношение числа молекул, распавшихся на ионы, к общемучислу растворенных молекул. Зависит от природы реагирующих веществ, от природырастворителя, от температуры, от концентрации.Чем более полярен растворитель,тем больше степень диссоциации в нем данного электролита. Электролиты, степеньдиссоциации которых даже в относительно концентрированных растворах велика(à1), называют сильными (почти все соли, мин. соли: H2SO4, HNO3, HMnO4; основания щел и щел-зем металлов), а электролиты, степень диссоциациикоторых даже в разбавленных растворах мала,-слабыми (Почти все орг. кислоты,некоторые мин.кислоты: H2CO3, H2S, многие гидрооксидыметаллов).Константа диссоциации – константа равновесия процессадиссоциации. Характеризует способность данного в-ва распадаться на ионы. Чембольше константа диссоциации тем лучшев-во диссоциирует. Кислоты и основания диссоциируют ступенчато.Каждая ступень диссоциации характеризуется своей константой. Константаравновесия Kрэтой реакции и есть Kд:Kp=[H+][An]/[HAn]Если выразить равновесные концентрации черезконцентрацию слабого электролита Cи его степень диссоциации α, то получим Kд=(C*α*C* α)/C(1- α)=(C* α 2)/(1- α).Это соотношение называют закономразбавления Оствальда.Для очень слабых электролитов при α << 1 это уравнение упрощается:. Kд=(C* α 2)α=√Kд/C
Вопрос18. Растворыэлектролитов. Диссоциация средних, кислых и основных солей. Диссоциация кислоти оснований. Ступенчатая диссоциация. Приведите примеры. Использование законовРауля и Вант-Гоффа для описания свойств электролитов. Изотонический коэффициент(Неполностью)
Вводных растворах сильные электролиты полностью диссоциируют. Поэтому числоионов в них больше чем в слабых при той же концентрации. Принципиальное отличиесильных электролитов от слабых состоит в том, что равновесие диссоциациисильных электролитов полностью смещено вправо:H2SO4>H++HSO4- Каждый ионокружен оболочкой из ионов противоположного знака. В свою очередь, каждый изэтих ионов сольватирован. Это окружение называется ионной атмосферой. Теория опроцессах диссоциации в водных растворах; в соответствии с ней кислотыпредставляют собой вещества, которые в водных растворах отдают положительныеионы водорода; основания представляют собой вещества, которые в водном раствореотдают отрицательные гидроксидионы. Кислота —> Анион (кислотный остаток) + Н+Основание —* Катион + ОН~ По Аррениусумежду кислотой и основанием не существует функциональной связи. Тольковзаимодействие катионов водорода с гидроксидионами с образованием водыявляется по Аррениусу кислотно-основной реакцией: Н+ + ОН-= Н2О
Вопрос19. Реакции ионного обмена в растворах электролитов. Условия практической необратимости протекания реакций ионного обмена. Напишите молекулярные и ионно-молекулярные уравнения реакций, иллюстрирующих эти условия.
Условия практической необратимости реакций ионного обмена: образование осадка,выделение газа, образование воды или другого слабого электролита.
В обменных реакциях, протекающих в растворах электролитов, наряду с недиссоциированными молекулами слабых электролитов, твердыми веществами и газами участвуют также находящиеся в растворе ионы. Поэтому сущность протекающих процессов наиболее полно выражается при записи их в форме ионно-молекулярных уравнений. Например, уравнения реакций нейтрализации сильных кислот щелочами
HClO4 + NaOH →NaClO4 + H2O,
2HNO3 + Ba(OH)2 → Ba(NO3)2 + 2H2O,
выражаются одним и тем же ионно-молекулярным уравнением
H+ + OH– → H2O,
из которого следует, что сущность этих процессов сводится к образованию из ионов водорода и гидроксид-ионов малодиссоциированного электролита – воды. Аналогично уравнения реакций
BaCl2 +H2SO4 → BaSO4 + 2HCl,
Ba(NO3)2 + Na2SO4 → BaSO4 + 2NaNO3
выражают один и тот же процесс образования из ионов Ва2+ и SO42— осадка малорастворимого электролита – сульфата бария
Ва2+ + SO42– → BaSO4↓.
Вопрос 20 Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Шкала водородного показателя. Индикаторы. Изменение окраски индикаторов в зависимости от реакции среды.
Водоро́дный показа́тель, pH (лат. pondus Hydrogenii - сила водорода, произносится «пэ аш», английское произношение — piː'eɪtʃ) — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на один литр
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды.
Вода достаточно плохо диссоциирует. Но всё же обладает измеримойпроводимостью. Вода диссоциирует на катионы водорода и анионы гидроксила. Таккак степень диссоциации воды крайне мала то концентрация недиссоциированныхмолекул H2O в воде практически равна общейконцентрации воды. Для воды и разбавленных водных растворов при неизменнойтемпературе произведение ионов водорода и гидроксил -ионов есть величинапостоянная = ионное произведение воды.=10-14 . Растворы в которыхконцентрации ионов водорода = концентрации ионов гидроксила называютсянейтральными([H+]=10-7). Если водорода больше([H+]>10-7) то кислый, если гидроксила([H+]<10-7),тоосновной, но произведение ВСЕГДА остаётся постоянным. Кислотность или щелочностьсреды выражается водородным показателем pH=-lg[H+] Методы измерения:колориметрический и потенциометрический. Колориметрический метод
основанна свойстве кислотно – основных индикаторов изменять свою окраску в зависимостиот активности ионов водорода в растворе (в общем по цвету индикатора). Потенциометрическийметод – электрохимический метод анализа, основанный на зависимости величиныэлектродного потенциала, а, следовательно, и ЭДС, составленного изсоответствующих электродов гальванического элемента, от состава раствора(Короче проводимость воды)
Название индикатора
Цвет индикатора в различных средах
в кислой
в нейтральной
в щелочной
Метиловыйоранжевый
Метиловый красный
Фенолофталеин
Лакмус
Красный(pH<3,1 )
Красный (pH<4,2)
Бесцветный (pH<8)
Красный (pH<5)
Оранжевый (3,1<pH<4,4)
Оранжевый (4,2<ph<6,3)
Бледно-малиновый (8<pH<9,8)
Фиолетовый (5<pH<8)
Желтый (ph>4,4)
Желтый (pH>6,3 )
Малиновый (pH>9,8)
Синий(pH>8)
Вопрос 21 Гидролиз. Гидролиз солей. Количественные характеристики процесса гидролиза. Степень гидролиза и константа гидролиза. Смещение равновесия процесса гидролиза. Необратимый гидролиз. Напишите в молекулярном и ионно-молекулярном виде уравнения реакций гидролиза следующих солей: FeCl3, K3PO4, Na2SО4, Al2S3 . Укажите реакцию среды в водных растворах этих солей.
Гидролизсолей – процесс взаимодействия в-ва сводой, при котором составные части в-ва взаимодействуют с составными частямиводы, образуя слабодиссоциирующие ионы или молекулы. При гидролизе происходитизменение реакции среды. Гидролизу подвергаются соединения различных классов.Гидролизу будут подвергаться соли, образованные: а)сл.основание и сильн.кислотой.б)сл.кислотой и силь.основание в)сл.кислотой и сл. основанием.; Солиобразованные силь.основ и силь.кисл (NaCl,NaNO3) гидролизявляется процессом обратимым: чем слабее электролит, образующий соль, темглубже протекает процесс гидролиза. Гидролиз протекает тем полнее, чем слабееэлектролит, образовавший соль, чем выше температура и чем больше разбавлениераствора.
Степеньгидролиза – доля в-ва подвергшеесягидролизу. Зависит: от константы равновесия, от температуры, от концентрациисоли. Константа гидролиза – это отношение произведения концентрацийкислоты и основания к концентрации образовавшейся соли.Kгидр=Кв/Кд.сл.электр.
1) Al2 (SO4)3+H2O=2AlOHSO4+H2SO4(сл. + сильн.)
2) Na2CO3+H2O=NaHCO3+NaOH(сильн. + сл.)
3) Cr2 (CO3)3+H2O=Cr(OH)3|-+H2CO3(сл. +сл.)
4)KNO3 гидролизуне подвергается (сильн. + сильн.)
Вопрос 22 Окислительно-восстановительные реакции. Степень окисления элемента. Окислитель и восстановитель. Процессы окисления и восстановления. Приведите примеры типичных окислителей и восстановителей. Какие процессы представляют собой процессы окисления, а какие восстановления:
S-2 → S0 Cr2O72- → Cr+3 Mg0 → Mg+2 O2 +2H2O → 4OH-
Окислительно-восстановительныереакции – такие реакции, в результатекоторых изменяется степень окисления одного из реагирующих веществ. Степеньокисления – условный заряд атома в молекуле, возникающий, исходя изпредположения, что электроны не смещены, а полностью отданы атому болееэлектроотрицательному. Процесс окисления – процесс отдачи электроноватомами, молекулами или ионами, при этом степень окисления повышается, авещество является восстановителем. Процесс восстановления – процессприсоединения электронов атомами, молекулами или ионами, при этом степеньокисления понижается, а вещество является окислителем. Окислитель –вещество, которое принимает электроны, при этом оно восстанавливается. Восстановитель– вещество, которое отдает электроны, при этом оно окисляется. Типичные восстановители: активные металлы ( щелочные ищелочноземельные, Zn, Al, Fe, и др. Me0–neàMe+n), а также некоторые неметаллы, H2 и C (в виде угля или кокса),S.Типичные окислители - неметаллы (F2 ,Cl2,Br2,I2, O2),галогены, выступая в кач. окислителей , приобретают степень окисленности-1 ( от F к I окислительные св-ва ослабевают).
