
- •Министерство образования республики беларусь белоруский государственный университет
- •Противоопухолевые комплексы платины
- •Оглавление
- •Введение
- •История
- •Механизмы действия противоопухолевых комплексов платины (II, IV)
- •Гипотеза Розенберга
- •Гипотеза биопроцессов
- •Основной механизм комплексов Pt(II)
- •Особенности структур противоопухолевых комплексов платины (II, IV) и основные принципы их дизайна
- •Особенности структуры комплексов
- •Комплексы платины (IV)
- •Механизм устойчивости к противоопухолевым препаратам на основе комплексов платины (II, IV).
- •Стерически затрудненные комплексы платины (II. IV).
- •Tpанc-комплексы платины (II).
- •Комплексы платины (II, IV) с производными 1,2-диаминоциклогексана
- •Модифицирование лабильных групп комплекса.
- •Полинуклеарные комплексы платины (II)
- •Водорастворимые комплексы платины (II. IV)
- •Заключение Список используемой литературы:
Комплексы платины (II, IV) с производными 1,2-диаминоциклогексана
Следует отметить, что среди первых препаратов платины (II, IV), проявляющих активность в отношении устойчивых к цисплатину клеточных линий лейкемии L1210, были комплексы, содержащие 1,2-диамииоциклогексан (рис. 9):
- транс-с11-(1,2-диаминоциклогексан)тетрахлороплатина (IV) (ормаплатин),
- транс-(1,2-диаминоциклогексан)оксалатоплатина (II) (оксалиплатин) и др. [158, 159].
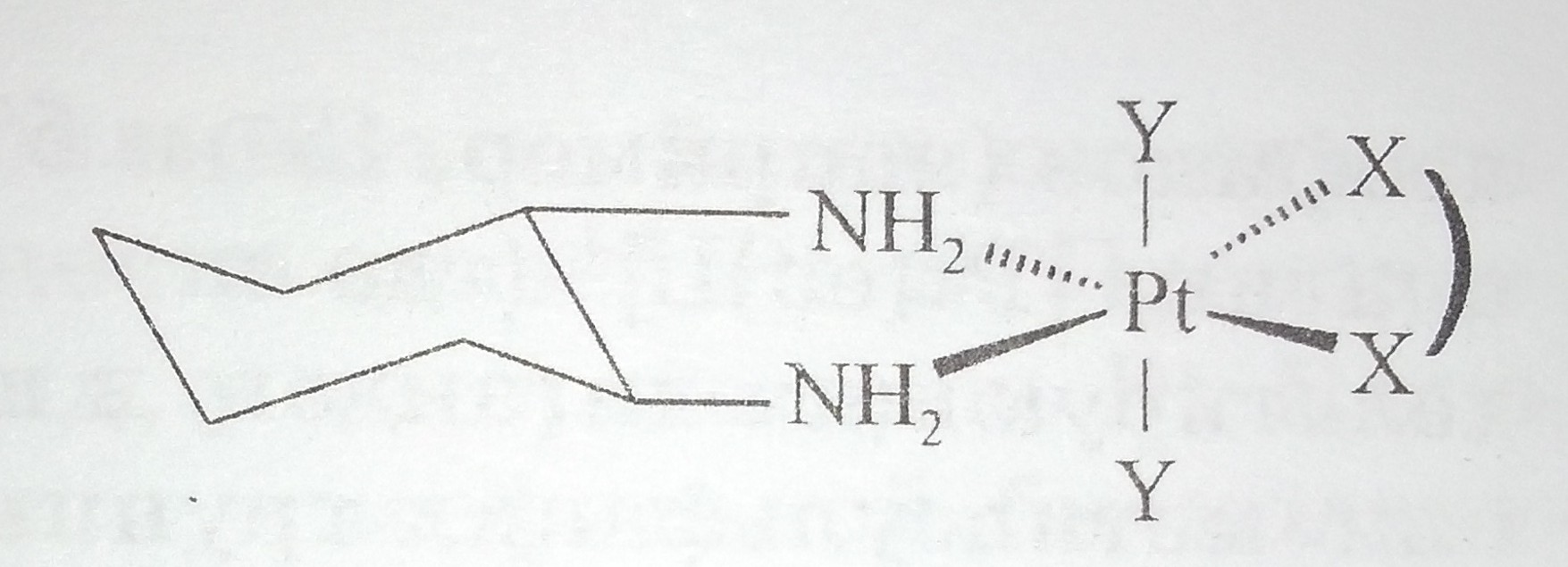
Рис. 9. Схематическое изображение структуры комплексов платины с производными 1,2-диаминоциклогексана.
Исследование комплексов платины (II, IV) с производными диаминоциклогексана показало, что они представляют собой отдельную оригинальную группу противоопухолевых комплексов, отличающуюся от цисплатина и карбоплатина по клеточным мишеням, механизмам действия и резистентности. Следовательно они могут быть потенциально эффективны в случае устойчивости к циоплатину и карбоплатину.
Из множества тестированных комплексов лишь 12 соединений были отобраны для клинических испытаний, среди них оксалиплатин, транс-(1,2-диаминоциклогексан(неодеканоат)2платина (II), а также комплексы, содержащие транс- или цис-изомеры 1,2-диаминоциклогексана и моно- и/или дикарбоновые кислоты в качестве уходящей группы X (X - диацетат, оксалат, малонат и др.; Y - ацетат, трифторацетат), общая структурная формула которых представлена на рис. 9 [17, 29]. Оказалось, что оксалиплатин характеризуется меньшей нейротоксичностью, чем ормаплатин, и проявляет активность при колоректальном раке в комбинации с 5-фторурацилом.
Некоторые сочетания карбоксилатных лигандов в аксиальном и экваториальном положениях способны в достаточной степени оптимизировать противоопухолевые свойства коплексов с производными 1,2-диаминоциклогексана, причем аксиально-трифторацетатные комплексы значительно активнее, чем соответствующие аксиально-ацетатные [160].
Независимо от изомерии диаминоциклогексанового участка молекулы, соответствующие комплексы достаточно активны в отношении клеточных линий лейкемии L1210, а также проявляет сопоставимую с цисплатином активность в отношении модельной солидной опухоли (ретикулосаркомы), которая является клинически предсказательной, что указывает на целесообразность продолжения исследований комплексов такого типа [160].
Модифицирование лабильных групп комплекса.
Одно из перспективных направлений разработки новых препаратов платины (II), в том числе и аналогов цисплатина цис-PtA2X2, связано с модифицированием лабильных уходящих групп X, поскольку, как отмечалось выше, реакционная способность связей Pt-X имеет прямое отношение к токсичности этих соединений [15, 17, 29]. Однако установить определенную связь между биоативноcтью и реакционной способностью комплексов, исходя из кинетических соображений, пока не удалось.
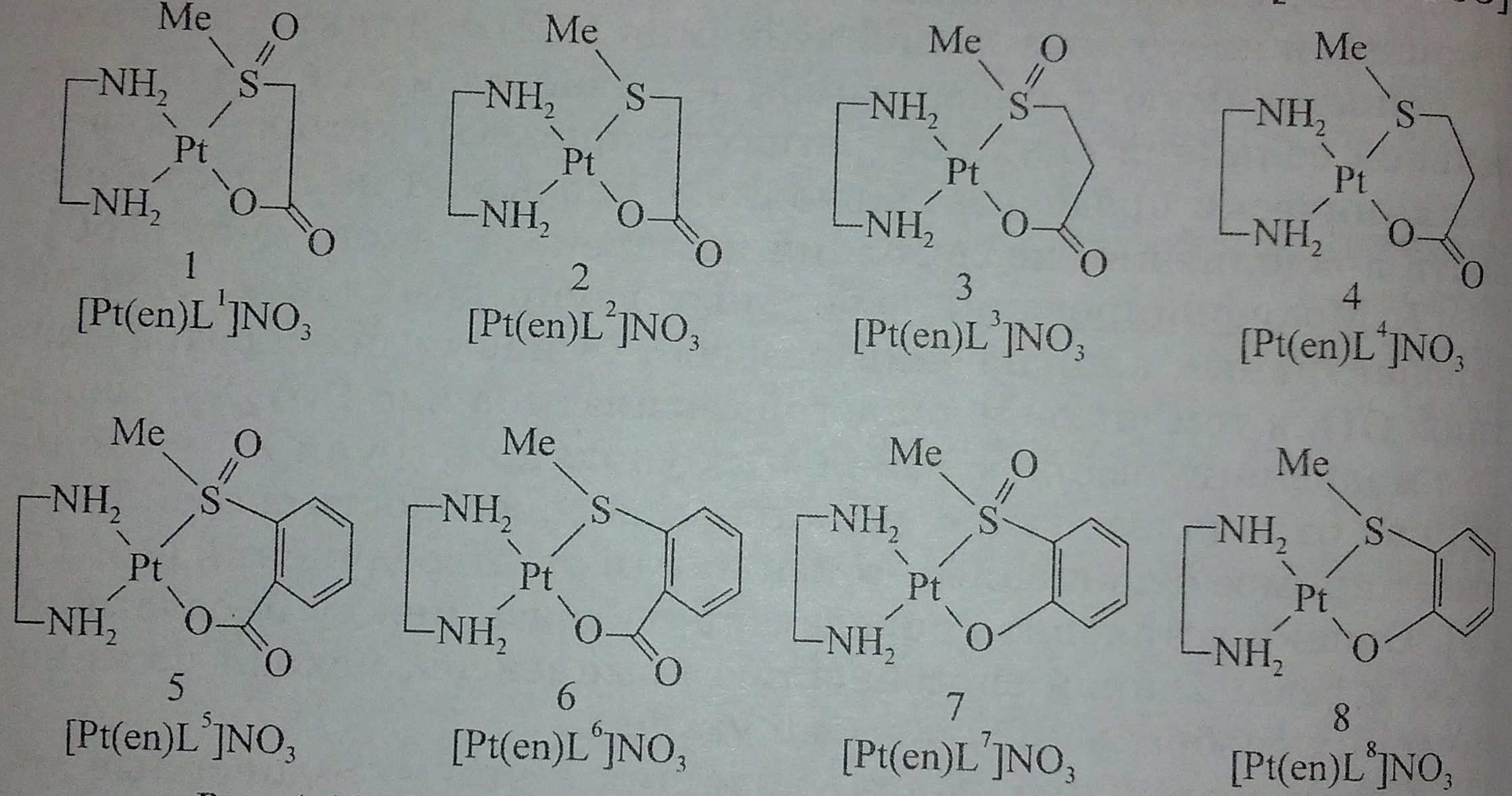
Рис. 10. Схематическое изображение (1-8) структуры комплексов платины (II) с S-донорными лигандами [161]
Среди возможных типов уходящих групп - S-донорные лиганды (рис. 10). Особенности их поведения (цитотоксичность, реакционная способность) в отношении наиболее важных бионуклеофилов (например, CI и 5'-ГМФ) изучались для аналогов цисплатина [Pt(en)L]+ (где еn - этилендиамин, L - анионы из ряда хелатирующих лигандов, в которых донорные метилсульфинил или метилсульфанил-группы связаны с анионными боковыми участками карбоксилатов или фенолятов, причем L образует хелат с платиной (II) через атомы серы и кислорода [161-164]. Для соединений, структурные формулы которых схематически представлены на рис. 10, были получены следующие результаты, на основании которых оценена перспективность использования данного типа лигандов в качестве уходящих групп. Весьма вероятно, что комплексы с высоко-лабильными лигандами X могут реагировать с нуклеофильными центрами различных биомолекул, прежде чем достигнут мишени. В такой ситуации S-нуклеофилы - наиболее подходящие объекты для взаимодействия, поскольку, как известно, некоторые формы токсичности комплексов платины (II) обусловлены реакцией [PtX2]-группы с нуклеофильными S-центрами некоторых белков [164]. Другое важное следствие реакции комплекса платины (II) in vivo с S-центрами для фармакологических свойств аналогов цисплатина связано, как указывалось выше, с его инактивацией внутриклеточным глутатионом.
С учетом этих факторов, некоторые S-донорные лиганды и были предложены для снижения токсичности и преодоления устойчивости к препаратам платины (II).
Следует отметить, что между реакционной способностью этих комплексов в реакциях с нуклеофилом 5'-ГМФ и их цитотоксичностью наблюдается лишь незначительная корреляция: наиболее реакционноспособные комплексы (1 и 5) характеризуются высокой цитотоксичностью, а инертный комплекс (8) имеет самую низкую цитотоксичность. В зависимости от природы лиганда L (L - монодентатный и координирует с платиной (II) через атом S) и нуклеофила (Nu) реакции либо останавливаются на стадии монозамещенного комплекса [Pt(en)L(Nu)], либо образуется комплекс [Pt(en)(Nu)2] [162, 163].
