
- •1. Лабораторные работы.
- •Методика
- •Порядок проведения работы
- •Обработка результатов опыта
- •Оценка погрешности
- •Основные понятия и определения
- •Описание опытной установки.
- •Методика определения газовой постоянной
- •Порядок проведения опыта
- •Оценка погрешности
- •Контрольные вопросы
- •Изобарная Ср и изохорная Сv теплоёмкости .
- •Э кспериментальная установка
- •Порядок проведения опыта.
- •Обработка результатов опытов.
- •2.Расчетные задания.
- •2.1.Газовый цикл.
- •2.2.Теплопроводность при стационарном режиме.
- •3.Задачи.
- •3.1 Термодинамика.
- •3.2.Теория теплообмена.
- •4.Вопросы для самоконтроля.
Основные понятия и определения
Термическое (характеристическое) уравнение состояние Клапейронадля1кг. Идеального газа имеет вид:
![]()
![]()
, где: Р - удельное давление (Н/м2);
V - удельный объём (м3/кг);
Т - абсолютная температура(К).
Коэффициент пропорциональности R в уравнении (1) называется газовой характеристической постоянной, величина которой зависит от физической природы газа. При нормальных условиях для воздуха:
молекулярная масса μ=28,96 кг/кмоль
плотность ρ=1,293 кг/м3
объём киломоля Vμ=22,4м3/моль
газовая постоянная R=287 дж/кг*град
Для выяснения физического смысла газовой постоянной запишем уравнение Клапейрона для двух состояний газа при постоянном давлении (изобарный процесс):
PV1=RT1 (2)
PV2=RT2 (3)
В ычитая
из уравнения (3) уравнение (2) и преобразуя,
получим:
ычитая
из уравнения (3) уравнение (2) и преобразуя,
получим:
Уравнение (4) показывает, что газовая постоянная по своему физическому смыслу является работой, совершаемой 1кг. газа в изобарном процессе при изменении его температуры на 1 градус.
Величина R в уравнении Клапейрона (1) является постоянной для каждого газа в отдельности.
Уравнению (1) можно придать универсальную форму записи, если газовую постоянную отнести не к 1 кг, а к 1 киломолю (молю) газа. Для этого приводим некоторые определения:
Молекулярная масса газа μ (кг/кмоль) – есть численное выражение отношения массы молекулы данного вещества к 1/12 массы атома изотопа углерода 12С.
Килограмм- молекула (киломоль, моль)- количество газа, масса которого в килограммах численно равна его молекулярной массе (например, для кислорода моль равен 32 кг, для азота- 28 кг и т.д.). Из закона Авогадро следует, что объём киломоля ( μV=Vμ) при одинаковых физических условиях имеет постоянное значение.
Т огда
уравнение состояния для 1 моля газа и
выражение Rμ
запишутся в виде:
огда
уравнение состояния для 1 моля газа и
выражение Rμ
запишутся в виде:
Vμ - объём 1 моля м3/моль
μ - масса киломоля данного газа кг/кмоль
Произведение μR в уравнении (6) называется универсальной газовой постоянной и по физическому смыслу является работой 1 киломоля идеального газа в изобарном процессе при изменении его температуры на 1 градус.
Для нормальных физических условий численное значение универсальной газовой постоянной в технической и СИ системах измерения будут одинаковы для всех газов и равны соответственно:
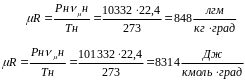

Индивидуальная газовая постоянная в двух системах измерения, отнесенная к 1 кг газа при этом будет равной:
Тогда универсальное уравнение состояния запишется в виде:
PVμ=848 TМКГСС; PVμ=8314 TСИ (7)
Vμ - объём моля;
μ - масса киломоля газа.
Уравнение (7) называют уравнением Клапейрона – Менделеева, т.к. оно впервые было предложено Менделеевым в 1874 г.
Описание опытной установки.
Воздушным компрессором 1 воздух нагнетается в тонкостенный металлический сосуд 2. Давление воздуха в сосуде контролируется
м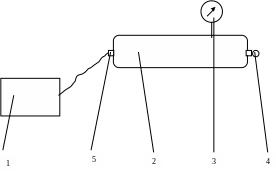 анометром
3.Сосуд снабжён клапаном 4 для выпуска
воздуха и клапаном 5 – для впуска.
анометром
3.Сосуд снабжён клапаном 4 для выпуска
воздуха и клапаном 5 – для впуска.
Для контроля веса сосуда используются весы.
