
- •Билет 1
- •Билет 2.
- •Химические свойства.
- •Номенклатура солей
- •Билет 4
- •Отклонения от закона Рауля.
- •2 Закон Рауля.
- •Следствия из закона Рауля:
- •7 Билет
- •Второй закон утверждает:
- •Билет 9
- •Билет 12:
- •1) Теории кислот и оснований
- •Водородная теория Либиха
- •Теория электролитической диссоциации Аррениуса-Оствальда
- •Протонная теория Брёнстеда-Лаури
- •Теория сольвосистем
- •Электронная теория Льюиса
- •Общая теория Усановича
- •Билет 13
- •Автопротолиз как кислотно-основное взаимодействие
- •Константа автопротолиза
- •Автопротолиз воды
- •Билет 19
Билет 4
1) Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов. Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
Реакция должна протекать либо при постоянном объёме Qv(изохорный процесс), либо при постоянном давлении Qp(изобарный процесс).
В системе не совершается никакой работы, кроме возможной при P = const работы расширения.
Если реакцию проводят при стандартных условиях (Стандартные условия — значения температуры и давления, при которых определяются (или к которым приводятся) значения различных количественных характеристик веществ, зависящих от давления и температуры (например, электродные потенциалы, скорости звука и т. д.). при Т = 298,15 К = 25 ˚С и Р = 1 атм = 101325 Па, тепловой эффект называют стандартным тепловым эффектом реакции или стандартной энтальпией реакции ΔHrO. В термохимии стандартный тепловой эффект реакции рассчитывают с помощью стандартных энтальпий образования. Результаты термохим.измерений- тепловые эффекты реакций- принято относить к одному молю образующегося вещества. Количество теплоты, которое выделилось при образовании одного моля соединения из простых веществ, наз. теплотой образования данного соединения. При расчёте теплоты образования элемент берётся в виде простого вещества, т.к оно более устойчиво при данных условиях. Теплоты образования наиболее устойчивых при данных условиях простых веществ принимаются за 0, а менее устойчивых равны теплотам их образования из устойчивых. Тепловые эффекты можно включать в уравнения реакций. Химические уравнения, в которых указано количество выделяющейся или поглощаемой теплоты, наз. термохимическими уравнениями. Или ТУ- уравнения, в которых указан тепловой эффект реакции и агрегатное состояние вещества. Величина теплового эффекта обычно указывается в правой части уравнения со знаком плюс(эндотерм.), со знаком минус(экзотерм.). ТУ реакции образования воды: 2H2 + O2= 2H2O =285,8 кДж. А вот теплота образования NO отрицательна и равна -90.25 лДж/моль. Соответствующее термохим.уварнение имеет вид: 1/2N2+1/2O2=NO- 90.25 кДж.
Важнейшей характеристикой веществ, применяемых в качестве топлива, явл.их теплота сгорания. Теплота́ сгора́ния — это количество выделившейся теплоты при полном сгорании массовой (для твердых и жидких веществ) или объёмной (для газообразных) единицы вещества. Измеряется в джоулях или калориях. Теплота сгорания, отнесённая к единице массы или объёма топлива, называется удельной теплотой сгорания (дж или кал на 1 кг, м³ или моль). Для её измерения пользуются методами калориметрии. Теплота сгорания определяется химическим составом горючего вещества. Эту величину принято относить к одному молю вещества. Выражение «теплота сгорания ацетилена равно 1300 кДж/моль» эквивалентно термохимическому уравнению: C2H2+ 2и1/2O2=H2O+2CO2+1300 кДж.
2) Неэлектролиты — вещества, водные растворы и расплавы которых не проводят электрический ток, так как их молекулы не диссоциируют на ионы. Сильное физико-химическое взаимодействие при растворении приводит к сильному изменению свойств раствора (химическая теория растворов). Великий русский химик Д.И. Менделеев создал химическую теорию растворов, которую он обосновал многочисленными экспериментальными данными, изложенными в его книге «Исследования водных растворов по их удельному весу», вышедшей в 1887 г. Сольваты (гидраты) образуются за счет донорно-акцепторного, ион-дипольного взаимодействий, за счет водородных связей, а также дисперсионного взаимодействия (в случае растворов родственных веществ, например бензола и толуола). Особенно склонны к гидратации (соединению с водой) ионы. Ионы присоединяют полярные молекулы воды, в результате образуются гидратированные ионы; поэтому, например, в растворе ион меди (II) голубой, в безводном сульфате меди он бесцветный. Многие из таких соединений непрочны и легко разлагаются при выделении их в свободном виде, однако в ряде случаев образуются прочные соединения, которые можно легко выделить из раствора кристаллизацией. При этом выпадают кристаллы, содержащие молекулы воды. Кристаллические вещества, содержащие молекулы воды, называютя кристаллогидратами, а вода, входящая в состав кристаллогидратов, называется кристаллизационной. Кристаллогидратами являются многие природные минералы. Ряд веществ (в том числе и органические) получаются в чистом виде только в форме кристаллогидратов. Д.И. Менделеев доказал существование гидратов серной кислоты, а также ряда других веществ. Таким образом, растворение - не только физический, но и химический процесс. Растворы образуются путем взаимодействия частиц растворенного вещества с частицами растворителя. Ученик Д.И. Менделеева Д.П. Коновалов всегда подчеркивал, что между химическими соединениями и растворами нет границ. Жидкие растворы занимают промежуточное положение между химическими соединениями постоянного состава и механическими смесями. Как и химические соединения, они однородны и характеризуются тепловыми явлениями, а также часто наблюдающейся концентрацией - сокращением объема при смешивании жидкостей. С другой стороны, в отличие от химических соединений растворы не подчиняются закону постоянства состава. Они, как и смеси, могут быть легко разделены на составные части. Процесс растворения есть физико-химический процесс, а растворы - физико-химические системы.
Растворы неэлектролитов – частицы, плохо растворимые в воде, так как нет носителя электрического заряда. Закон Рауля справедлив только для разбавленных растворов неэлектролитов.
Зако́ны Ра́уля — общее
название открытых французским химиком
Ф. М. Раулем в 1887 г. количественных
закономерностей, описывающих некоторые
коллигативные (зависящие от концентрации,
но не от природы растворённого вещества)
свойства растворов. Первый закон Рауля
связывает давление насыщенного пара
над раствором с его составом; он
формулируется следующим образом:
Понижение давления насыщ.пара растворителя
над раствором прямо пропорционально
мольной доле растворённого вещества,
причём коэффициент пропорциональности
равен давлению насыщенного пара над
чистым компонентом.
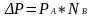
Растворы, для которых выполняется закон Рауля, называются идеальными. Идеальными при любых концентрациях являются растворы, компоненты которых очень близки по физическим и химическим свойствам (оптические изомеры, гомологи и т. п.), и образование которых не сопровождается изменением объёма и выделением либо поглощением теплоты. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
