
- •Билет 1
- •Билет 2.
- •Химические свойства.
- •Номенклатура солей
- •Билет 4
- •Отклонения от закона Рауля.
- •2 Закон Рауля.
- •Следствия из закона Рауля:
- •7 Билет
- •Второй закон утверждает:
- •Билет 9
- •Билет 12:
- •1) Теории кислот и оснований
- •Водородная теория Либиха
- •Теория электролитической диссоциации Аррениуса-Оствальда
- •Протонная теория Брёнстеда-Лаури
- •Теория сольвосистем
- •Электронная теория Льюиса
- •Общая теория Усановича
- •Билет 13
- •Автопротолиз как кислотно-основное взаимодействие
- •Константа автопротолиза
- •Автопротолиз воды
- •Билет 19
Автопротолиз как кислотно-основное взаимодействие
Понятие автопротолиза вытекает из протонной теории кислот и оснований Брёнстеда-Лоури. В ней понятие о кислотах и основаниях было объединено в единое целое, проявляющееся в кислотно-основном взаимодействии. Сущностью кислотно-основного взаимодействия по Брёнстеду-Лоури является передача протона от кислоты к основанию. При этом в любом кислотно-основном взаимодействии участвуют две пары сопряженных кислот и оснований (протолитов):
А1+B2A2+B1
Растворители, которые являются протолитами по отношению к растворенным веществам, называются протонными растворителями. К их числу относятся вода H2O, аммиак NH3, фтороводород HF, уксусная кислота CH3COOH и др. Главное из свойств всех протонных растворителей — способность их молекул к автопротолизу: каждый протонный растворитель является амфолитом по отношению к самому себе.
Реакция автопротолиза в общем виде отвечает уравнению:
2HLH2L+ + L-
При этом образуются так называемые лионий (катион растворителя) H2L+ (кислота сопряженной пары H2L+ / HL) и лиат (анион растворителя) L- (основание сопряженной пары HL / L-)[1]. Так, для воды автопротолиз протекает с образованием катионов гидроксония H3O+ и гидроксид-ионов, OH-):
2H2OH30+ + OH-
Это равновесие называется равновесием автопротолиза воды.
Автопротолизхарактерен не только для воды, но и для многих других протонных растворителей, молекулы которых связаны между собой водородными связями, например, для аммиака, метанола и фтороводорода:
2NH3NH4+ + NH2-
2CH3OHCH3OH2+ +CH3O-
2HFHF2+ + F-
Константа автопротолиза
Применение закона действующих масс к равновесной гомофазной реакции автопротолиза позволяет получить количественную характеристику — константу автопротолиза (иначе ионное произведение) растворителя KS. Термин «константа автопротолиза» используется обычно в протолитической теории, а «ионное произведение» — в теории электролитической диссоциации.
Для протонного растворителя HL может быть записана соответствующая константа равновесия:
Kc=[L-][H2L+]/[HL]2=const=f(t) (2 в знаменателе-степень)
Степень протолиза очень мала и, следовательно, равновесная молярная концентрация непротолизованных молекул растворителя [HL] практически равна исходной концентрации этого растворителя CHL, то есть постоянна.
Объединяя постоянные Kс и [HL]2 в одну константу Kс · [HL]2 и обозначая ее Ks, получим выражение:
Ks=[L-][H2L+]=const=f(t)
Величина Ks — константа автопротолиза или ионное произведение растворителя — служит количественной характеристикой реакции автопротолиза данного растворителя. Константа автопротолиза является постоянной величиной для данной температуры и данного растворителя.
Поскольку значения констант автопротолиза очень малы, на практике для удобства пользуются величиной, которая называется «показатель константы автопротолиза». Она рассчитывается как отрицательный десятичный логарифм константы автопротолиза:
pKs=-lgKs
Автопротолиз воды
Наиболее важное значение имеет автопротолиз воды. Константа автопротолиза для воды обычно называется ионным произведением воды и обозначается как . Ионное произведение численно равно произведению равновесных концентраций ионов гидроксония и гидроксид-анионов. Обычно используется упрощенная запись:
Kw=[H+]*[OH-]
При стандартных условиях ионное произведение воды равно 10−14. Оно является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. Автопротолиз воды объясняет, почему чистая вода, хоть и плохо, но всё же проводит электрический ток.На основе ионного произведения воды вычисляются водородный показатель и константа гидролиза солей, константа сольватации (произведение растворимости) — важнейшие характеристики равновесных процессов в растворах электролитов.
2) Энергия активации — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция. Термин введён Сванте Августом Аррениусом в 1889. Типичное обозначение энергии реакции Ea. Энергия необходимая для перехода веществ в состояние активированного комплекса наз.энергией гибсо-активации.
ΔG=ΔH- TΔS
Вероятность того, что при столкновении частиц образуется активированный комплекс и произойдёт реакция зависит от энергии сталкивающихся частиц.
РИСУНОК ИЗ ЛЕКЦИИ!!! ГРАФИК
Верхняя точка макс.кривой отвечает состоянию, когда реагир.молекулы настолько сближены и искажены, что становится возможным образование продуктов реакции.
Энтропия активации характеризует вероятность надлежащей ориентации молекул при столкновении. Зависимость скорости реакции от температуры хар-ет правило Вант-Гоффа. При повыш.t на каждые 10С скорость реакции возр. в 2-4 раза.
 ;
;

Энергия
активации (Е*) -
это энергия, необходимая для перевода
в состояние активированного комплекса
1 моль реагирующих веществ. Разность
ΣНf - ΣНi составляет тепловой эффект
реакции (ΔrH). Для обратной реакции
тепловой эффект будет иметь ту же
величину, но противоположный знак. Для
обратной реакции энергия активации
составит величину. ![]()
Зависимость константы скорости химической реакции от температуры описывается уравнением Аррениуса: где k- конст.скорости, e-осн.логарифма, Z-множитель,указ.на число столкновений между частицами в ряду.
e^(-Eакт/RT)- вероятность тго,что столкнувшиесы молекулы будут иметь дост.эн.для взаимод.
e^(+Eакт/RT)-вероятность провальной ориентации молекул в момент столкновения.
Если Еакт<150кДж, то такая реакция протекает самопроизвольно. И наоборот.

Константа скорости, а следовательно и скорость химической реакции экспоненциально растет с увеличением температуры.
15 –
Билет 16.
1) Обратимые и необратимые процессы, пути изменения состояния термодинамической системы. Процесс называют обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. При этом предполагается, что равновесие существует между отдельными частями рассматриваемой системы и на границе с окружающей средой. Обратимый процесс - идеализированный случай, достижимый лишь при бесконечно медленном изменении термодинамических параметров. Скорость установления равновесия должна быть больше, чем скорость рассматриваемого процесса. Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы называют необратимым.
Для
химической реакции применяют понятия
термодинамической и кинетической
обратимости, которые совпадают только
в непосредственной близости к состоянию
равновесия. Р-ция А + В ![]() С
+ D наз. кинетически обратимой или
двусторонней, если в данных условиях
продукты С и D могут реагировать друг с
другом с образованием исходных веществ
А и В. При этом скорости прямой и обратной
реакций, соотв.
С
+ D наз. кинетически обратимой или
двусторонней, если в данных условиях
продукты С и D могут реагировать друг с
другом с образованием исходных веществ
А и В. При этом скорости прямой и обратной
реакций, соотв. ![]()
![]() ,
где
,
где ![]() и
и ![]() -константы
скорости, [А], [В], [С], [D]-
текущиеконцентрации (активности),
с течением времени становятся равными
и наступает химическое
равновесие, в котором
-константы
скорости, [А], [В], [С], [D]-
текущиеконцентрации (активности),
с течением времени становятся равными
и наступает химическое
равновесие, в котором![]() -константа
равновесия, зависящая
от температуры. Кинетически необратимыми
(односторонними) являются обычно такие
реакции, в ходе которых хотя бы один из
продуктов удаляется из зоны реакции
(выпадает в осадок, улетучивается или
выделяется в виде малодиссоциированного
соединения), а также реакции, сопровождающиеся
выделением большого кол-ва тепла.
-константа
равновесия, зависящая
от температуры. Кинетически необратимыми
(односторонними) являются обычно такие
реакции, в ходе которых хотя бы один из
продуктов удаляется из зоны реакции
(выпадает в осадок, улетучивается или
выделяется в виде малодиссоциированного
соединения), а также реакции, сопровождающиеся
выделением большого кол-ва тепла.

Необратимые реакции протекают до конца -- до полного израсходования одного из реагирующих веществ. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Это связано с тем что необратимая реакция. протекает только в одном направлении, обратимая реакция протекает как в прямом так и в обратном. Когда скорости протекания прямой и обратной реакции становятся одинаковыми, наступает химическое равновесие. Закон действующих масс: при постоянной температуре скорость химической реакции прямо пропорционально произведению концентраций реагирующих веществ. (формула U=k*[A]*[B])
2)Гетерогенные равновесия в водных растворах характеризуются тем, что перенос частиц происходит через поверхность раздела по крайней мере двух сосуществующих фаз.
1. Твердая фаза (осадок) – жидкая фаза (насыщенный раствор вещества, находящегося в осадке). Осаждение отделяемого вещества с последующим фильтрованием– один из наиболее простых. Не менее важен и обратный процесс – переведение малорастворимых веществ в раствор. Это наиболее часто встречающийся в химии случай реакций образования и растворения осадков.
2. Твердая фаза (ионит) – жидкая фаза (раствор). ионный обмене на поверхности ионитов (катионитов и анионитов).
3. Жидкая фаза (раствор вещества в растворителе I) – жидкая фаза (раствор вещества в растворителе II). Этот случай реализуется тогда, когда некоторое вещество растворено в двух несмешивающихся друг с другом растворителях, причем в одном из них растворимость вещества больше, чем в другом
ПР постоянная величина которая характеризует способность электролита растворяться. ПР -- произведение концентраций ионов электролита в его насыщенном растворе. Растворимость малорастворимого электролита всегда уменьшается при введении электролита с одноимённым ионом.
В насыщенном растворе труднорастворимого сильного электролита произведение активностей (a) величина постоянная и является произведением растворимости.
Солевой эффект: увеличение растворимости малорастворимого сильного электролита в присутствии других солей не имеющих с ним общих ионов
Также на произведение растворимости влияет и ионная сила раствора т.к. от ионной силы раствора зависит коэффициент активности (f) от которого зависит значение активности (a), а произведение активностей и есть ПР.
17-
Билет 18:
1) Положение химического равновесия зависит от следующих парамктров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1884 году французским ученым Ле-Шателье. Современная формулировка принципа Ле-Шателье такова: При всяком внешнем воздействии на систему, находящуюся в состоянии хим.равновесия в ней протекают процессы, приводящие к уменьшению этого воздействия.
1.Повышение температуры увеличивает выход продуктов эндотермической реакции.
2.При увеличении давления стимулируется реакция, сопр.уменьшением объёма, тк этот процесс спсобствует уменьшению влияния давления.
3.Добавление в реакционную смесь, находящуюся в равновесии одного из компонентов благоприятствует протеканию той реакции, в ходе которой этот компонент расходуется.
1. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое - эндотермическому.
N2 +
3H2 |
Прямая реакция - экзотермическая, а обратная реакция - эндотермическая. Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам:
При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры - в направлении экзотермической реакции. |
2. Влияние давления. Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переоходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе. Влияние давления на положение равновесия подчиняется следующим правилам:
При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом; при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом |
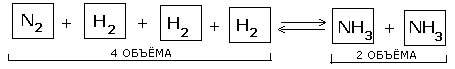
Таким образом, при переходе от исходных веществ к продуктам объем газов уменьшился вдвое. Значит, при повышении давления равновесие смещается в сторону образования NH3, о чем свидетельствуют следующие данные для реакции синтеза аммиака при 400 0С:
давление, МПа |
0,1 |
10 |
20 |
30 |
60 |
100 |
объемная доля NH3, % |
0,4 |
26 |
36 |
46 |
66 |
80 |
3. Влияние концентрации. Влияние концентрации на состояние равновесия подчиняется следующим правилам:
При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции; при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ. |
