
- •38. Дисперсные системы. Классификация.
- •Известные способы диссоциации воды:
- •36.Кислоты и основания в химии. Протонная и электронная теории.
- •Электронная теория Льюиса.
- •35.Растворение- как физико химический процесс. Теория электролитической диссоциации. Слабые и сильные электролиты.
- •Растворение – это процесс равномерного распределения одного вещества в другом, при котором растворяемое вещество переходит в агрегатное состояние растворителя.
- •Физико-химические основы процесса
- •31. Межмолекулярное взаимодействие. Силы Ван-Дер-Ваальса. Водородная связь.
- •30.Гибридизация атомных орбиталей и пространственно расположенных атомов в молекуле.
- •29. Метод валентных связей. Метод молекулярных орбиталей..
- •28.Типы химической связи: ковалентная, ионная, металлическая. Свойства веществ с различной связью.
- •27.Химическая связь. Основные характеристики химической сязи.
- •26.Структура периодической системы. И ее электронная конфигурация.
- •Структура периодической системы
- •25.Квантовое число. Атомные орбитали. Принцип запрета Паули. Правило Хунда и Клечковского.
25.Квантовое число. Атомные орбитали. Принцип запрета Паули. Правило Хунда и Клечковского.
Правило Клечковского (также Правило n+l; также используется название правило Маделунга) — эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах.
Правило Клечковского гласит:
-
Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного иорбитального квантовых чисел
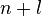 .
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением
.
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением 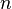 .
.
Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: модуль суммарного значения спинового квантового числа электронов данного подслоя должен быть максимальным. Сформулировано Фридрихом Хундом в 1925 году.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 – d-орбиталями (5 типов), l = 3 – f-орбиталями (7 типов).
Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемогоспином (от англ. веретено). Для обозначения электронов с различными спинами используются символы:
 и
и  .
.
Атомная орбиталь (АО) — область наиболее вероятного пребывания электрона (электронное облако) в электрическом поле ядра атома.
