
- •2.Первый закон термодинамики. Внутренняя энергия. Энтальпия.
- •3. Стандартные состояния веществ и стандартные теплоты химических и биохимических реакций. Термохимия. Калорическая ценность пищевых продуктов.
- •4.Теплоемкость. Зависимость теплового эффекта реакции от температуры. Закон Кирхгофа.
- •5.Второй закон термодинамики. Обратимые и необратимые процессы. Энтропия. Способы расчета энтропии.
- •6.Тепловая теорема Нернста. Третий закон термодинамики. Постулат Планка. Абсолютная энтропия.
- •7.Свободная энергия Гиббса. Свободная энергия Гельмгольца. Критерии направленности процессов и равновесия в термодинамических системах.
- •8.Парциальные мольные величины. Химический потенциал. Фугитивность
- •9.Растворы. Способы выражения состава раствора. Активность
- •10.Коллигативные свойства растворов. Закон Рауля. Криоскопия. Эбулиоскопия.
- •11.Коллигативные свойства растворов. Закон Вант-Гоффа. Осмос. Диализ
- •13.Термодинамика однокомпонентных систем. Равновесия жидкость – пар, жидкость – твердая фаза, твердая фаза – пар.
- •15.Константа химического равновесия. Термодинамический закон действующих масс. Изотерма Вант-Гоффа.
- •16.Энергия Гиббса и направленность химических реакций.
- •17.Уравнения изобары и изохоры химической реакции. Принцип Ле-Шателье.
- •18.Теория сильных электролитов Дебая-Хюккеля
- •19.Кинетический закон действующих масс. Зависимость константы скорости от температуры. Уравнение Аррениуса.
- •23.Основные характеристики атома: орбитальный радиус, потенциал ионизации, сродство к электрону. Электроотрицательность.
13.Термодинамика однокомпонентных систем. Равновесия жидкость – пар, жидкость – твердая фаза, твердая фаза – пар.
На фазовых диаграммах однокомпонентных систем поля, по правилу фаз, соответствуют однофазным состояниям, линии, разграничивающие их — двухфазным, точки пересечения линий — трёхфазным (эти точки называют тройными точками).
Двухфазные линии, как правило, либо соединяют две тройные точки, либо тройную точку с точкой на оси ординат, отвечающую нулевому давлению. Исключение составляет линия жидкость-газ, заканчивающаяся в критической точке. При температурах выше критической различие между жидкостью и паром исчезает.

14.Термодинамика двухкомпонентных систем. Диаграммы давление пара – состав, температура – состав. Азеотропы.
В двухкомпонентной
системе, согласно правилу фаз Гиббса
![]()

Диаграмма состояния двухкомпонентной системы эвтектического типа: а) компоненты нерастворимы в твердом состоянии: б) компоненты частично растворимы в твердом состоянии.
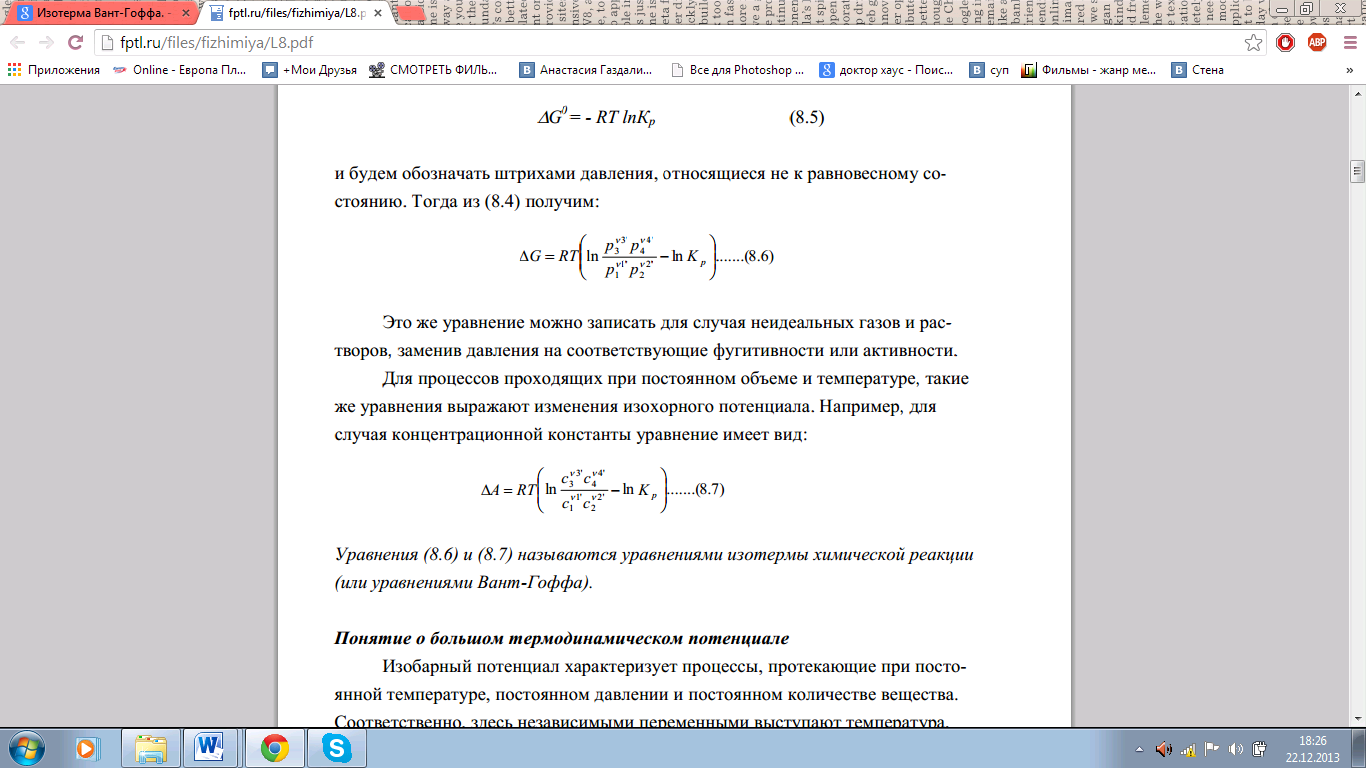
15.Константа химического равновесия. Термодинамический закон действующих масс. Изотерма Вант-Гоффа.
Константа химического равновесия — характеристика химической реакции, по значению которой можно судить о направлении процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях.
Константа химического равновесия определяется по закону действующих масс. Ее значения находят расчетно или на основании экспериментальных данных. Константа химического равновесия зависит от природы реагентов и от температуры.
Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
16.Энергия Гиббса и направленность химических реакций.
Энергия Гиббса и направление протекания реакции
В химических процессах одновременно действуют два противоположных фактора — энтропийный (T S) и энтальпийный (∆H). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (∆G)
![]()
Существует полезное
соотношение, связывающее изменение
свободной энергии Гиббса ∆G в ходе
химической реакции с её константой
равновесия K:
![]()
Вообще говоря, любая
реакция может быть рассмотрена как
обратимая. При этом константа равновесия
определяется как
![]()
где ~k1 — константа скорости прямой реакции, ~k{-1} — константа скорости обратной реакции.
17.Уравнения изобары и изохоры химической реакции. Принцип Ле-Шателье.
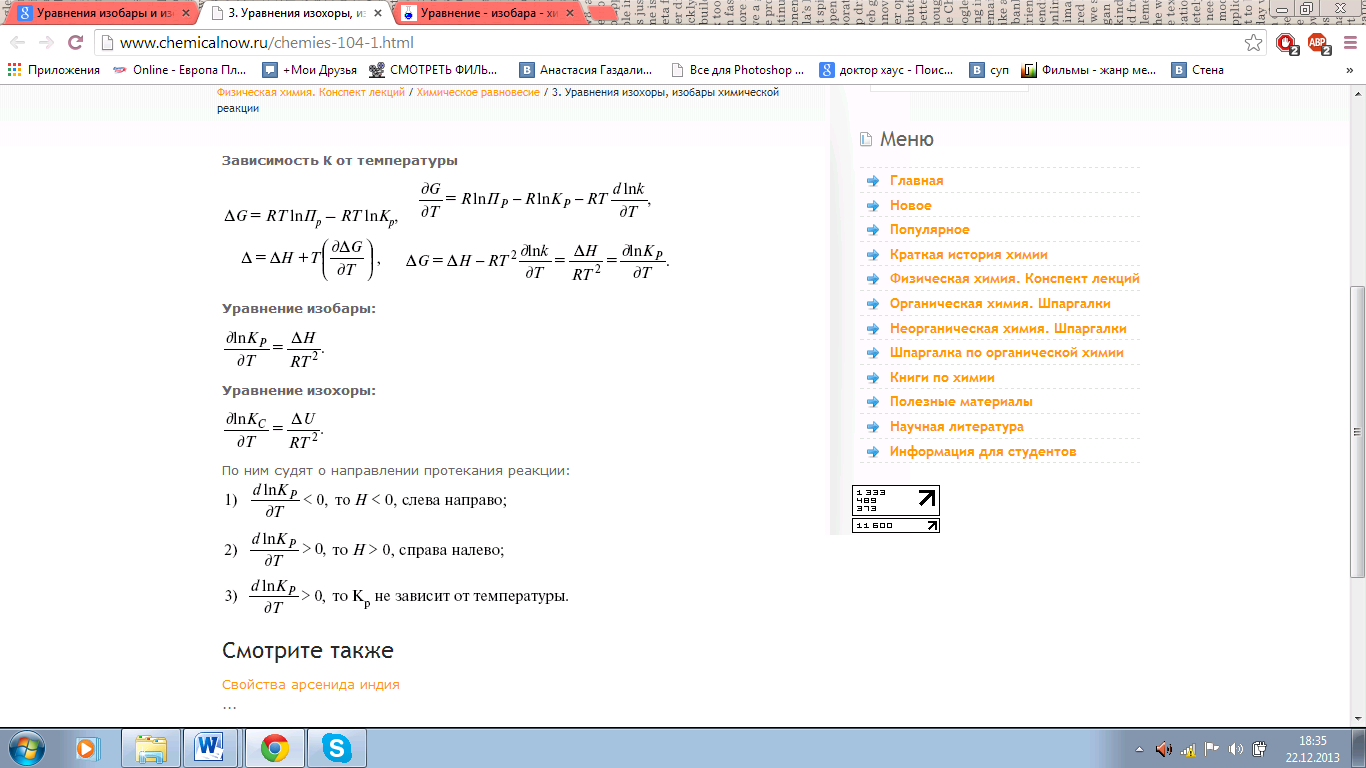
Принцип Ле Шателье— если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
