
- •2.Первый закон термодинамики. Внутренняя энергия. Энтальпия.
- •3. Стандартные состояния веществ и стандартные теплоты химических и биохимических реакций. Термохимия. Калорическая ценность пищевых продуктов.
- •4.Теплоемкость. Зависимость теплового эффекта реакции от температуры. Закон Кирхгофа.
- •5.Второй закон термодинамики. Обратимые и необратимые процессы. Энтропия. Способы расчета энтропии.
- •6.Тепловая теорема Нернста. Третий закон термодинамики. Постулат Планка. Абсолютная энтропия.
- •7.Свободная энергия Гиббса. Свободная энергия Гельмгольца. Критерии направленности процессов и равновесия в термодинамических системах.
- •8.Парциальные мольные величины. Химический потенциал. Фугитивность
- •9.Растворы. Способы выражения состава раствора. Активность
- •10.Коллигативные свойства растворов. Закон Рауля. Криоскопия. Эбулиоскопия.
- •11.Коллигативные свойства растворов. Закон Вант-Гоффа. Осмос. Диализ
- •13.Термодинамика однокомпонентных систем. Равновесия жидкость – пар, жидкость – твердая фаза, твердая фаза – пар.
- •15.Константа химического равновесия. Термодинамический закон действующих масс. Изотерма Вант-Гоффа.
- •16.Энергия Гиббса и направленность химических реакций.
- •17.Уравнения изобары и изохоры химической реакции. Принцип Ле-Шателье.
- •18.Теория сильных электролитов Дебая-Хюккеля
- •19.Кинетический закон действующих масс. Зависимость константы скорости от температуры. Уравнение Аррениуса.
- •23.Основные характеристики атома: орбитальный радиус, потенциал ионизации, сродство к электрону. Электроотрицательность.
9.Растворы. Способы выражения состава раствора. Активность
Раствором называется однородная система, состоящая из двух или более независимых компонентов (растворенное вещество и растворитель), а также продуктов их взаимодействия.
Состав растворов количественно принято выражать через безразмерные количественные величины – доли (массовую, объемную, молярную) и размерные величины – концентрации.
Массовая доля (W) или процентная концентрация - отношение массы растворенного вещества к массе раствора. Массовая доля – безразмерная величина, ее выражают в долях от единицы в процентах (10%).
Объемная доля - отношение объема растворенного вещества к объему раствора.
Молярная концентрация (молярность) См (моль/л) – показывает число молей растворенного вещества в одном литре раствора, выражается отношением количества растворенного вещества к объему раствора.
Молярная доля N – отношение числа молей растворенного вещества к сумме числа молей растворенного вещества и растворителя.
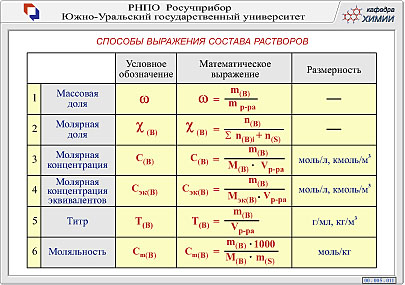
Активность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учётом различных взаимодействий между ними в растворе, то есть с учётом отклонения поведения системы от модели идеального раствора.
10.Коллигативные свойства растворов. Закон Рауля. Криоскопия. Эбулиоскопия.
Свойства растворов, которые зависят только от концентрации частиц в растворе и не зависят от природы растворенного вещества, называются коллигативными.
Коллигативные свойства разбавленных растворов могут быть описаны количественно и выражены в виде законов. К ним относятся:
осмотическое давление
давление насыщенного пара растворителя над раствором
температура кристаллизации раствора
температура кипения раствора
Это первый закон Рауля – парциальное давление над раствором прямо пропорционально мольной доле растворенного вещества.
Второй закон Рауля – понижение температуры кипения и повышение температуры замерзания раствора прямо пропорционально моляльной концентрации раствора:
Методы эбулиоскопии и криоскопии основаны на измерении повышения точки кипения и соответственно понижения точки замерзания раствора анализируемого вещества по сравнению с чистым растворителем. Оба явления объясняются понижением давления пара раствора относительно чистого растворителя.
Криоскопия - явление понижение температуры замерзания р-ра относительно чистого растворителя
дельта Т=Кm, К - постоянная (понижение температуры замерзания одно моляльного р-ра)
m - моляльность
Эбулиоскопия - явление понижение температуры кипения р-ра относительно чистого растворителя
Осмос - самопроизвольное односторонние движение растворителя через полупроницаемую мембрану в р-р
11.Коллигативные свойства растворов. Закон Вант-Гоффа. Осмос. Диализ
Свойства растворов, которые зависят только от концентрации частиц в растворе и не зависят от природы растворенного вещества, называются коллигативными.
Коллигативные свойства разбавленных растворов могут быть описаны количественно и выражены в виде законов. К ним относятся:
осмотическое давление
давление насыщенного пара растворителя над раствором
температура кристаллизации раствора
температура кипения раствора
Закон Вант-Гоффа:
осмотическое давление раствора численно
равно тому газовому давлению, которое
имело бы растворенное вещество, будучи
переведенным в газообразное состояние
в том же объеме и при той же температуре.
Поскольку объем (разбавление) обратно
пропорционален концентрации, то закон
Вант-Гоффа можно записать в виде
![]()
Осмотическое давление π – внутреннее давление растворенного вещества.
Явление, связанное со способностью проходить через мембрану, в частности, только молекул растворителя, называется осмосом, а вызываемое им изменение давления по обе стороны мембраны – осмотическим давлением. Явление осмоса чрезвычайно разнообразно и во многом определяется природой мембраны и компонентов раствора.
Процесс диализа основан на процессах осмоса и диффузии, что объясняет способы его ускорения.
Диализ применяют для очистки коллоидных растворов от примесей электролитов и низкомолекулярных неэлектролитов.
12.Гетерогенные системы. Правило фаз Гиббса.
Гетероге́нная систе́ма— неоднородная система, состоящая из однородных частей (фаз), разделённых поверхностью раздела.
Правило фаз Гиббса — соотношение, связывающее число веществ (компонентов), фаз и степеней свободы в гетерогенной системе.
В равновесной многофазной системе число степеней свободы равно числу компонентов системы плюс два минус число фаз, если на систему из внешних термодинамических параметров влияют только давление и температура:
С = К – Ф + 2
где С – число степеней свободы; К – число компонентов; Ф – число фаз.
Компонентами называются химические однородные вещества, которые являются независимыми составными частями системы. При выборе компонентов выбираются те вещества, наименьшее число которых достаточно для образования всей системы, так и любой ее части.
