
- •2.Первый закон термодинамики. Внутренняя энергия. Энтальпия.
- •3. Стандартные состояния веществ и стандартные теплоты химических и биохимических реакций. Термохимия. Калорическая ценность пищевых продуктов.
- •4.Теплоемкость. Зависимость теплового эффекта реакции от температуры. Закон Кирхгофа.
- •5.Второй закон термодинамики. Обратимые и необратимые процессы. Энтропия. Способы расчета энтропии.
- •6.Тепловая теорема Нернста. Третий закон термодинамики. Постулат Планка. Абсолютная энтропия.
- •7.Свободная энергия Гиббса. Свободная энергия Гельмгольца. Критерии направленности процессов и равновесия в термодинамических системах.
- •8.Парциальные мольные величины. Химический потенциал. Фугитивность
- •9.Растворы. Способы выражения состава раствора. Активность
- •10.Коллигативные свойства растворов. Закон Рауля. Криоскопия. Эбулиоскопия.
- •11.Коллигативные свойства растворов. Закон Вант-Гоффа. Осмос. Диализ
- •13.Термодинамика однокомпонентных систем. Равновесия жидкость – пар, жидкость – твердая фаза, твердая фаза – пар.
- •15.Константа химического равновесия. Термодинамический закон действующих масс. Изотерма Вант-Гоффа.
- •16.Энергия Гиббса и направленность химических реакций.
- •17.Уравнения изобары и изохоры химической реакции. Принцип Ле-Шателье.
- •18.Теория сильных электролитов Дебая-Хюккеля
- •19.Кинетический закон действующих масс. Зависимость константы скорости от температуры. Уравнение Аррениуса.
- •23.Основные характеристики атома: орбитальный радиус, потенциал ионизации, сродство к электрону. Электроотрицательность.
2.Первый закон термодинамики. Внутренняя энергия. Энтальпия.
Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника.
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Это определение особенно важно для химической термодинамики.
Внутренняя энергия
является функцией состояния. В циклическом
процессе внутренняя энергия не изменяется
![]()
Первое начало термодинамики:
при изобарном процессе
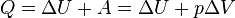
при изохорном процессе

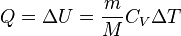
при изотермическом процессе
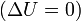

энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении.
![]()
Таким образом, энтальпия в данном состоянии представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объёмом V ввести в окружающую среду, имеющую давление р и находящуюся с телом в равновесном состоянии.
3. Стандартные состояния веществ и стандартные теплоты химических и биохимических реакций. Термохимия. Калорическая ценность пищевых продуктов.
Стандартное состояние вещества - обычно то состояние, в котором вещество находится в стандартных условиях.
1.Если твердое вещество, то это обычное кристаллическое вещество.
Жидкое-чисто жидкое без примесей.
Газообразное-чистый газ при давление в 1 атмосферу.
Растворимое-раствор концентрации 1 моль\литр.
Экзотермические-выделение энергии, эндотермические- поглощение.
Термохи́мия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплот фазовых переходов.
В основе термохимических расчётов лежит закон Гесса: Тепловой эффект (∆Н) химической реакции (при постоянных Р и Т) зависит от природы и физического состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Калори́метр— прибор для измерения количества теплоты, выделяющейся или поглощающейся в каком-либо физическом, химическом или биологическом процессе.
Калориметрия - это метод, который используется для измерения теплоты, которая поглощается или выделяется в ходе химической реакции
4.Теплоемкость. Зависимость теплового эффекта реакции от температуры. Закон Кирхгофа.
Теплоемкость:
•Внутренняя энергия вещества возрастает если температура повышается.(Кривая на графике характеризует теплоемкость).
•Производная поглощенной теплоты , отнесенная к температуре называется теплоемкостью.
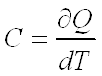
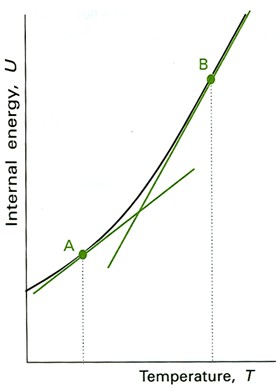
Закон Кирхгофа для химической реакции
•Зависимость энтальпии
химической реакции от температуры
выражается законом Кирхгофа.

•Для химической
реакции: Это выражение применяется для
каждого вещества в реакции:
![]()
