Билет 9.
Импорт белков в ядро клетки.
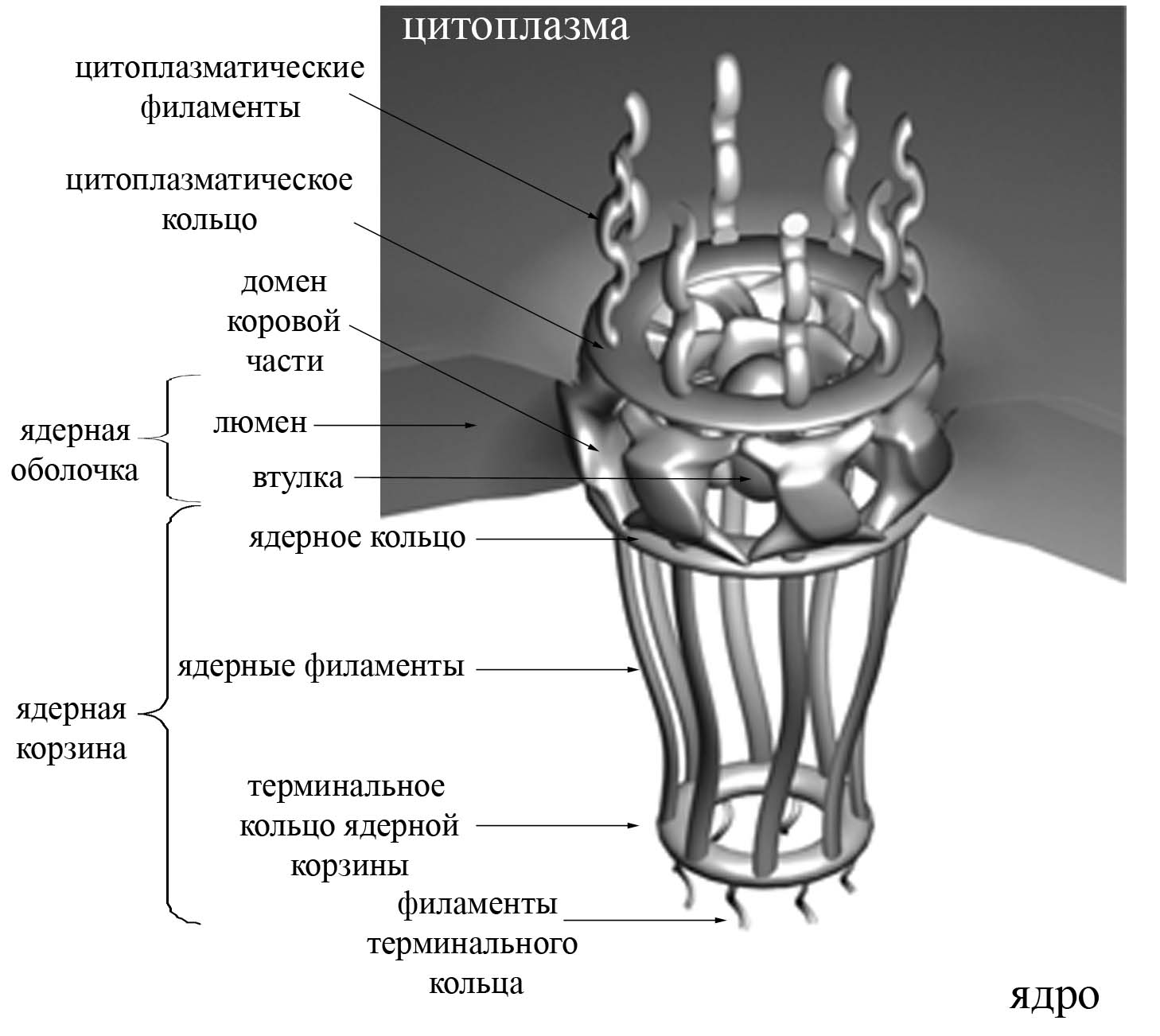
Ядерный поровый комплекс – супрамолекулярная структура с молекулярной массой более 125 мДа (у позвоночных), состоящая из более 1000 белков.
|
Через ядерную оболочку беспрепятственно в обе стороны происходит пассивный транспорт высокомолекулярных соединений, имеющих массу не более 5 кДа. Больше – сложнее, либо совсем не проходят.
Впервые аминокислотные последовательности ядерной локализации (NLS) были обнаружены на С-конце субъединиц нуклеоплазмина (ядерный белок, принимающий участие в структуризации хроматина). Если удалить примерно 50 аминокислот с С-конца, то ни весь нуклеоплазмин, ни его мономеры в ядро не попадают.
|
Белок с NLS проходит в ядро в несколько этапов:
Связывание NLS с рецептором, импортинами (α и β) и закрепление на цитоплазматических филаментах порового комплекса;
Постепенный проход этого комплекса через пору (импортины якобы разрыхляют пространство внутри поры);
Импортин β связывается с белком RAN (малая ГТФаза, гидролиз ГТФ делает этот процесс необратимым), происходит распад комплекса (NLS не отщепляется). Импортины возвращаются в цитоплазму (β-импортин в составе с RAN).
Определение аминокислотной последовательности белков с помощью секвенаторов.
Секвенирование по Эдману (1960).
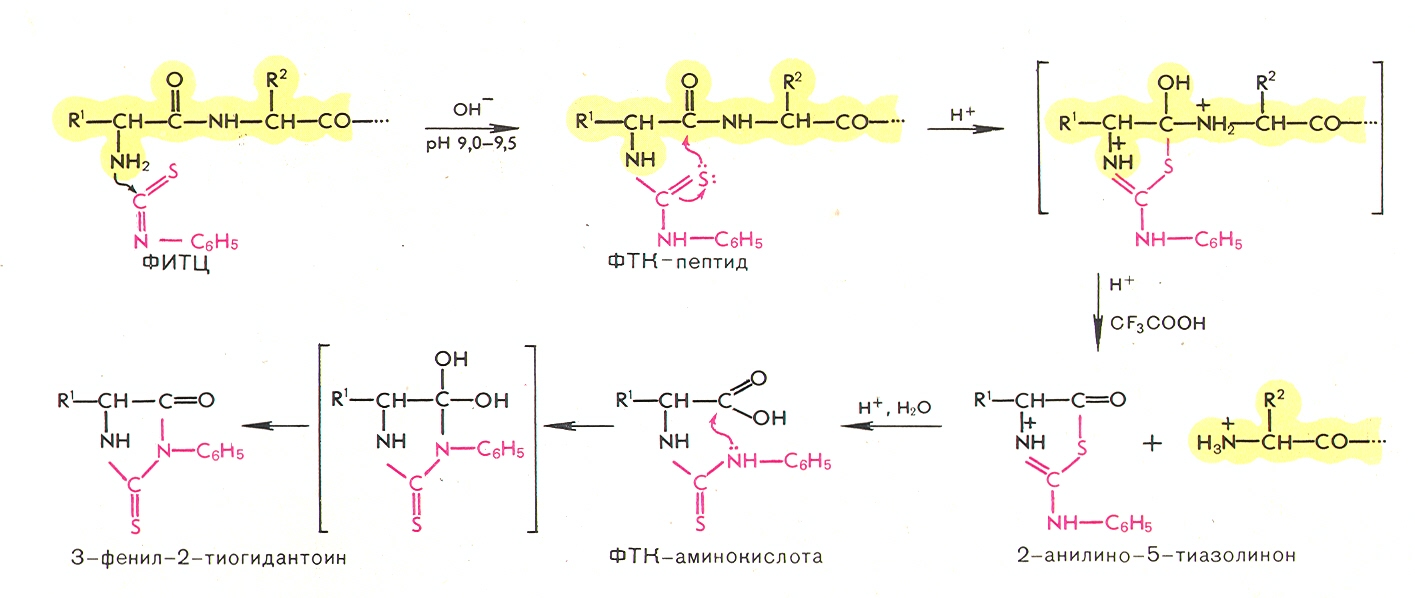
Необходимо разорвать все дисульфидные связи и защитить цистеины от повторного замыкания, всё очень хорошо почистить.
ФИТЦ (фенилтиоизоцианат, мощный электрофильный агент) реагирует с незаряженной N-концевой аминокислотой в слабощелочных условиях, формируя ФТК-производное (фенилтиокарбомоил-производное).
При нагревании в безводной кислой среде происходит перестройка, циклизация продукта и отщепление пептида с образованием анилино-тиозолинон-производного.
Анилино-тиазолинон экстрагируют из органического растворителя и добавляют к раствору водной кислоты, где формируется фенил-тиогидантоин – устойчивое производное аминокислоты, которое можно регистрировать с помощью хроматографии.
В 1976 Эдманом и Бэггом был создан прототип автоматического жидкофазного секвенатора, где реакции были стандартизированы, был исключён контакт образца (нанесён на твёрдую подложку из квадрола (нековалентно связан)) с воздухом, что привело к увеличению выхода реакции отщепления до 95%.
Далее группой под руководством Ларсена было придумана иммобилизация белка через различные боковые радикалы (в том числе по С-концу) на полистирольную матрицу (ковалентная иммобилизация).
В 1981 году Худ и Ханкепиллер сконструировали газофазный секвенатор. Хитрая конструкция позволила значительно уменьшить расход реактивов, растворителей и исследуемого образца белка (до 100-500 пмоль).
Подробнее – со стр. 57 учебника Овчинникова.
N- и O-гликозилирование белков в гликопротеинах.
Гликопротеины – белки, содержащие ковалентно связанный углеводный компонент. Делят на 2 класса по количеству связанных олигосахаридных цепочек: протеогликаны – количество олигосахаридных цепочек многократно превышает пептидную часть; собственно гликопротеины – сладенького понемножку.
N-гликопротеины
Углеводный остаток присоединяется к амидному азоту остатка аспарагина (желательна непосредственная близость гидроксиаминокислот). Первым моносахаридным звеном обычно оказывается N-ацетилглюкозамин. Последующие – остатки маннозы, галактозы, нейраминовой кислоты, фукозы и др.
Биосинтез N-гликопротеинов происходит в шероховатом ретикулуме, причём на амидную группу Asn переносится сразу большой-большой олигосахарид, включающий глюкозу, маннозу, ацетилглюкозамин, который подвергается процессингу (обязательное удаление глюкозы и удаление/добавление других сахаров).
O-гликопротеины
Углеводный остаток присоединяется к оксигруппе Ser или Thr (однозначного сиквенса для гликозилирования нет). Первый моносахарид – N-ацетилгалактозамин.
Биосинтез ступенчатый, всё по порядку, количество моносахаридов не такое большое. О-гликозилирование свойственно веществам, определяющим группу крови (муцины).
Углеводный компонент почти никогда не входит в состав каталитического центра, наличие гликозилирования обычно не влияет на скорость ферментативной реакции. Зато олигосахариды в составе гликопротеинов участвуют в процессах межклеточного узнавания, дифференциации, трансформации клеток, связывании гормонов с рецепторными белками.