
- •8. Концентрирование азотной кислоты
- •Температура кипения водных растворов азотной кислоты
- •8.1. Концентрирование азотной кислоты при помощи водоотнимающих веществ
- •8.1.1. Концентрирование азотной кислоты с помощью серной кислоты
- •8.1.2. Теоретические основы процесса
- •8.1.3. Технологическая схема концентрирования азотной кислоты с помощью серной кислоты
- •8.1.4. Технологический режим процесса концентрирования азотной кислоты с помощью серной кислоты
- •Основная аппаратура отделения концентрирования
- •Факторы, влияющие на работу концентрационной колонны
- •8.2. Концентрирование азотной кислоты с применением нитрата магния
- •8.2.1. Физико-химические основы процесса концентрирования азотной кислоты с применением нитрата магния
- •8.2.2. Технологическая схема концентрирования азотной кислоты с применением нитрата магния
- •9. Прямой синтез концентрированной азотной кислоты
- •9.1. Физико-химические основы процесса
- •9.2. Выделение избыточной реакционной воды
- •9.3. Окисление оксида азота II
- •9.4. Абсорбция оксидов азота концентрированной азотной кислотой
- •9.5. Выделение оксидов азота
8.2.1. Физико-химические основы процесса концентрирования азотной кислоты с применением нитрата магния
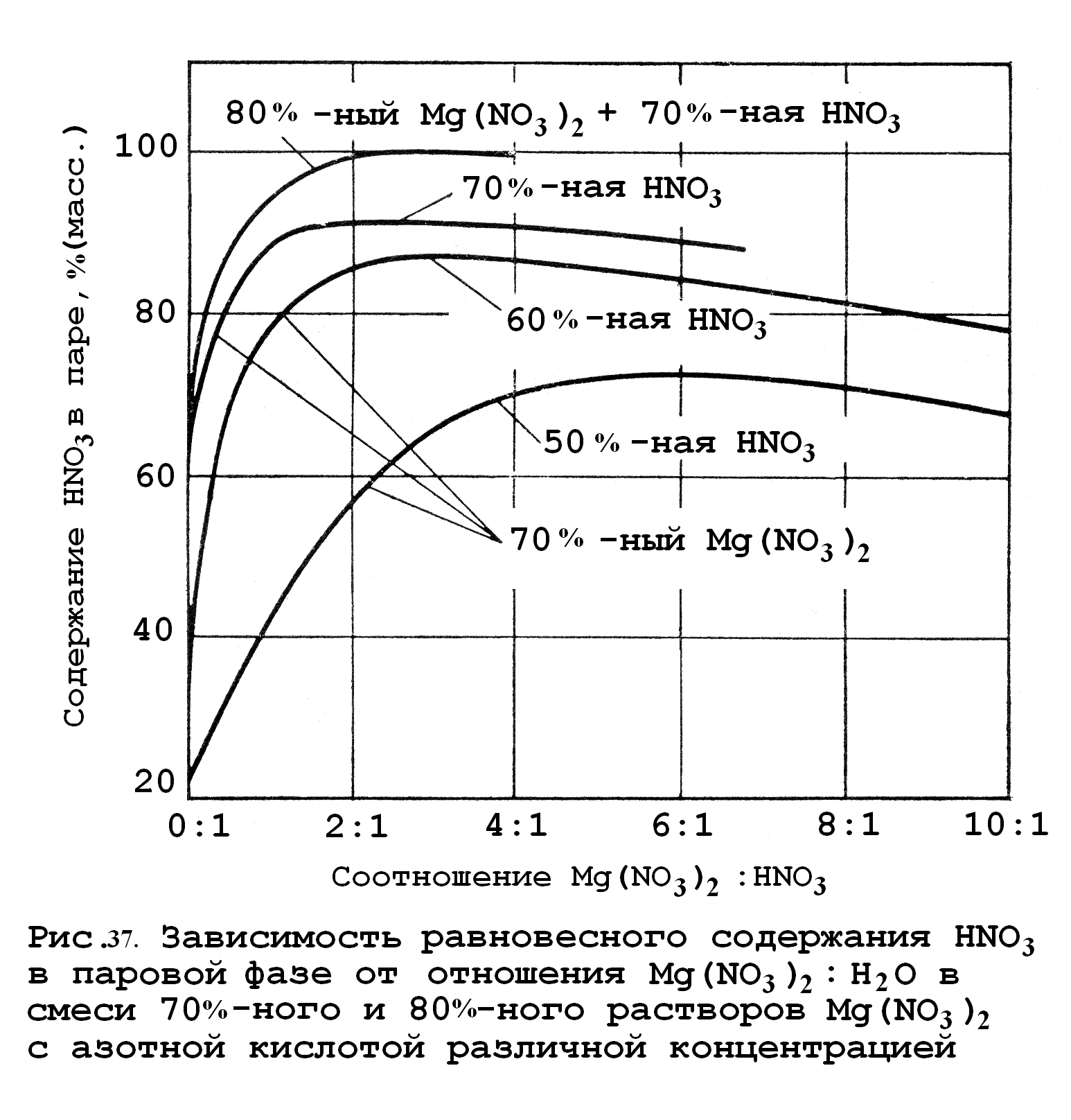
Фазовая диаграмма системы Mg(NO3)2–Н2О, которая свидетельствует о высокой водоотнимающей способности нитрата магния вплоть до температуры 125 С. Из диаграммы можно рассчитать, какое количество плава Mg(NO3)2 необходимо ввести в процесс с тем расчетом, чтобы связать воду из разбавленной НNO3 при определенной температуре. Однако эти выкладки могут носить теоретический характер, на практике же используют избыток водоотнимающего агента с целью более полного проведения процесса и увеличения его скорости. На основании экспериментальных данных были получены зависимости содержания НNO3 в паровой фазе от соотношения Mg(NO3)2 : НNO3 в смеси при различных концентрациях НNO3 и вводимого в систему Mg(NO3)2. Эти зависимости показывают (рис. 37), что необходимо поддерживать соотношение Mg(NO3)2 : НNO3 не менее 2,5 для получения содержания НNO3 в паровой фазе выше 68,4 % мас.
Исходя из этих предварительных посылок, рассмотрим технологическую схему процесса.
8.2.2. Технологическая схема концентрирования азотной кислоты с применением нитрата магния
Настоящий способ концентрирования азотной кислоты находит широкое применение как в нашей стране, так и за рубежом (Англия, Германия и др.)
Наиболее современная схема установки приведена на рис. 38.

Суть метода. В среднюю часть колонны 7 поступает НNO3 с концентрацией 50–70 % мас. и 74–78 %-ный раствор Mg(NO3)2 в соотношении 1:2,6÷7 при температуре 120–170 С. Кислота подается ниже ввода плава.
Из тройной смеси Mg(NO3)2–НNO3–Н2О выделяются пары азотной кислоты сверхазеотропной концентрации, которые поднимаются в ректификационную часть колонны. Здесь происходит обогащение паровой фазы азотной кислотой до 98–100 % мас. за счет стекающей вниз флегмы, которая возвращается из конденсатора при температуре 40–86 С с флегмовым числом 1,1–3, а остальная кислота отбеливается на верхних тарелках колонны и поступает на склад. Нитрозный газ отсасывается газодувкой через промывной абсорбер 1.
Отработанный 59–62 %-ный раствор Mg(NO3)2, содержащий до 1–3 % мас. НNO3 стекает из колонны в кипятильник 8, где упаривается до 64–69 % мас. и направляется на концентрирование в выпарной аппарат 5. Выделяющиеся пары воды и кислоты в кипятильнике 8 направляются в нижнюю часть колонны при температуре 160–175 С. После выпаривания плав имеет концентрацию 74–78 % мас. и направляется в промежуточный бак 6 и затем вновь в колонну.
Соковый пар из выпарного аппарата 5 конденсируется (в нем содержится до 5% мас. НNO3) и направляется на орошение колонн для получения разбавленной кислоты.
Основная часть оборудования схемы изготавливается из титана, ниобия, высококремнистой стали – 02Х8Н22С6 (ЭП-794), кислотостойкой керамики, фторопласта-4.
Проведение процесса в оборудовании из ферросилида ограничено его низкой термостойкостью и сложностью изготовления крупногабаритного литья.
Описанный процесс связан с большим расходом пара, вследствие чего его целесообразно применять в схемах с давлением на стадии абсорбции 1,0-1,5 МПа. (По этой схеме можно получать 65–70 %-ную НNO3, концентрирование которой связано с существенно меньшими затратами пара и электроэнергии).
