
- •8. Концентрирование азотной кислоты
- •Температура кипения водных растворов азотной кислоты
- •8.1. Концентрирование азотной кислоты при помощи водоотнимающих веществ
- •8.1.1. Концентрирование азотной кислоты с помощью серной кислоты
- •8.1.2. Теоретические основы процесса
- •8.1.3. Технологическая схема концентрирования азотной кислоты с помощью серной кислоты
- •8.1.4. Технологический режим процесса концентрирования азотной кислоты с помощью серной кислоты
- •Основная аппаратура отделения концентрирования
- •Факторы, влияющие на работу концентрационной колонны
- •8.2. Концентрирование азотной кислоты с применением нитрата магния
- •8.2.1. Физико-химические основы процесса концентрирования азотной кислоты с применением нитрата магния
- •8.2.2. Технологическая схема концентрирования азотной кислоты с применением нитрата магния
- •9. Прямой синтез концентрированной азотной кислоты
- •9.1. Физико-химические основы процесса
- •9.2. Выделение избыточной реакционной воды
- •9.3. Окисление оксида азота II
- •9.4. Абсорбция оксидов азота концентрированной азотной кислотой
- •9.5. Выделение оксидов азота
8. Концентрирование азотной кислоты
Получить концентрированную азотную кислоту непосредственной перегонкой разбавленной кислоты невозможно. Об этом свидетельствует состав паровой и жидкой фаз, который приведен в табл. 18.
Таблица 18
Температура кипения водных растворов азотной кислоты
и состав жидкости и пара при давлении 0,112 МПа
Температура кипения, С |
Содержание НNO3, % мас. |
Температура кипения, С |
Содержание НNO3, % мас. |
||
жидкость |
пар |
жидкость |
пар |
||
106,5 112,0 118,5 121,5 121,8 121,9 |
24,2 33,0 49,8 61,0 65,21 68,4 |
2,16 5,9 19,85 41,0 65,1 68,4 |
85,8 90,5 99,0 112,0 118,0 121,5 |
96,0 90,2 85,2 80,0 75,6 70,1 |
99,9 99,7 98,0 97,0 92,0 84,0 |
В графическом варианте эти данные выглядят следующим образом (Рис. 30)

Таким образом, при перегонке НNO3 (разб.) ее можно упарить до содержания НNO3 68,4 % мас. при Т=121,9 С при атмосферном давлении. В этой точке (А) образуется азеотропная смесь, после чего она перегоняется без изменения состава. В случае выпаривания НNO3 с содержанием более 68,4% мас. содержание ее в парах будет повышаться, а в кубовом остатке приближаться к 68,4 % мас.
Непосредственная перегонка разбавленных водных растворов НNO3 применяется в промышленности в тех случаях, когда из кислоты, содержащей 40–45 % мас. НNO3, получают НNO3 с концентрацией 59–63 % мас. В связи с этим широкое распространение получил метод концентрирования азотной кислоты с помощью водоотнимающих средств.
8.1. Концентрирование азотной кислоты при помощи водоотнимающих веществ
8.1.1. Концентрирование азотной кислоты с помощью серной кислоты
Для осуществления концентрирования азотной кислоты необходимо в первую очередь снизить парциальное давление паров воды над смесью (вода–азотная кислота). Этого можно достичь в присутствии водоотнимающих веществ (концентрированная серная кислота, фосфорная кислота, нитрат магния и др.).
8.1.2. Теоретические основы процесса
Дегидрирующий агент должен удовлетворять следующим требованиям:
высокая эффективность разделения компонентов при низкой стоимости;
технологичность применения;
термическая стойкость;
низкие токсичность и коррозионная активность.
А.В. Сапожников и П. Паскаль предприняли исследования смеси вода–азотная кислота в присутствии серной кислоты. Результатами этих исследований явились диаграммы, на которых представлены зависимости:
а) температуры кипения от состава тройной смеси (рис.31);
б) состава паров выделяющихся при кипении тройной смеси при атмосферном давлении (рис. 32).
Построение
таких диаграмм основано на том, что
сумма перпендикуляров, опущенных из
любой точки внутри равностороннего
треугольника на его стороны, равна
высоте треугольника (принцип построения
диаграмм).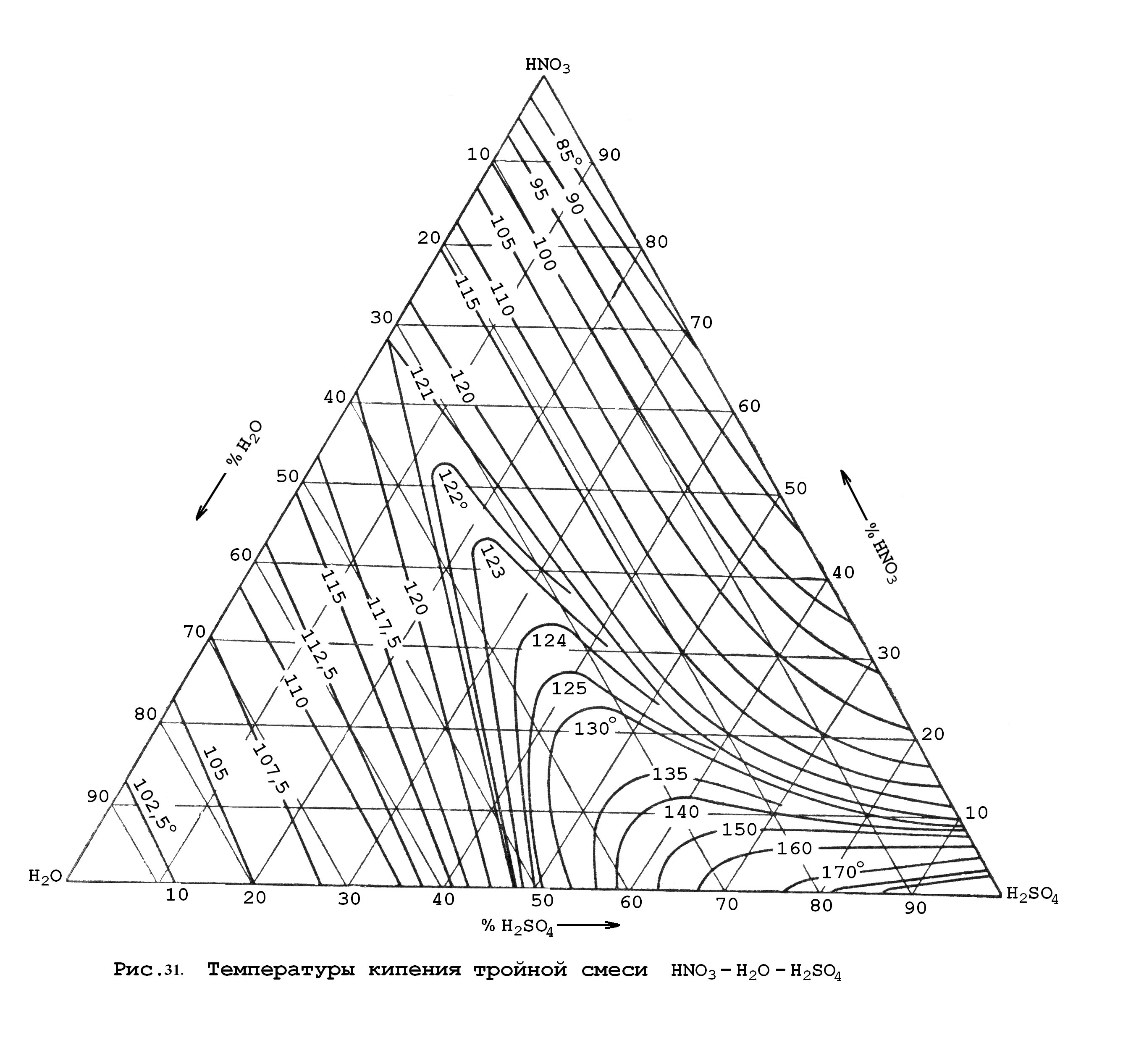

Пользуясь этими диаграммами можно определить состав паровой фазы, состоящей из азотной кислоты и воды, и температуру кипения в зависимости от исходного состава жидкой тройной смеси.
На практике, как правило, приходится решать и другую задачу: определить состав начальной тройной смеси с целью получения конечной заданной концентрации продукционной НNO3. Здесь же реализуется цель уменьшения расхода Н2SO4.
Для осуществления процесса перегонки берут Н2SO4 высокой концентрации, что ведет к улучшению технико-экономических показателей процесса.
Расход Н2SO4 будет тем больше, чем сильнее разбавлена азотная кислота. В основном применяют Н2SO4 с концентрацией 92–93% мас. (такую кислоту в технике называют «купоросным маслом»).
Пример: Определить состав тройной смеси (в %), состоящей из 50 %-ной НNO3 и 100 %-ной Н2SO4, с целью получения 95 %-ной НNO3.
Соединяем прямой линией вершину треугольника (100 %-ная Н2SO4) с противоположной стороной, причем концентрация Н2О в смеси с НNO3 составляет 50 % (100 %общ.–50 % азотная кислота=50 % вода). В точке пересечения прямой с кривой содержания 95 %-ной НNO3 в парах определяем состав тройной смеси. Он будет соответствовать 48 % мас. Н2SO4, 26 % мас. НNO3 и 26 % мас. Н2О.
При перегонке серная кислота разбавляется до 68–70 %-ной концентрации, в которой содержится до 0,03 % мас НNO3 и растворенных оксидов азота. Последние образуют с Н2SO4 нитрозилсерную кислоту (до 0,01 % мас.) НNSO5 по следующим реакциям:
N2O3+2H2SO4=2HNSO5+H2O, (36)
2NO2+2H2SO4=HNSO5+НNO3. (37)
Нитрозилсерная кислота оказывает сильное коррозионное действие на аппаратуру, поэтому на практике стремятся к более полной денитрации отработанной серной кислоты. Этот процесс осуществляют непосредственно в перегонной колонне схемы концентрирования НNO3 путем нагрева смеси острым паром.
При разбавлении Н2SO4 водой происходит гидролиз нитрозилсерной кислоты по реакции:
HNSO5+H2O=Н2SO4+НNO2. (38)
Поскольку гидролиз сопровождается нагревом (острый пар), то получаемая азотистая кислота разлагается:
3НNO2=НNO3+2NO+Н2О. (39)
С увеличением температуры степень гидролиза возрастает для HNSO5. Образующаяся NO незначительно растворяется в Н2SO4, причем при концентрации Н2SO4 равной 68,5 % мас. содержание NO в растворе минимально и составляет ~ 0,001 % мас.
Таким образом, можно констатировать, что для проведения процесса концентрирования НNO3 в оптимальных условиях необходимо:
В колонне для нагрева использовать острый пар в таком количестве, чтобы вводимого с ним тепла хватало для нагрева смеси до 150–160 С (см. диаграмму);
Разбавление Н2SO4 проводить конденсатом этого пара до концентрации 68–70 % мас. Это дает следующие преимущества:
а) легче концентрировать серную кислоту;
б) в системе присутствует наименьшее содержание нитрозилсерной кислоты за счет гидролиза;
в) содержание NO в растворе имеет минимальное значение (0,001 % мас.).
