
- •4. Контакное окисление аммиака
- •4.1. Физико-химические основы процесса
- •4.2. Катализаторы окисления аммиака
- •4.3. Состав газовой смеси. Оптимальное содержание аммиака в аммиачно-воздушной смеси
- •Зависимость степени конверсии аммиака от его содержания в авс
- •Нижний (нпв) и верхний (впв) пределы взрываемости смеси аммиак – кислород – азот
- •4.4. Зависимость степени конверсии аммиака от времени контакта
- •4.5. Окисление аммиака под давлением
Нижний (нпв) и верхний (впв) пределы взрываемости смеси аммиак – кислород – азот
Содержание О2 в смеси кислород-азот, % об. |
Содержание NH3 в смеси аммиак-кислород-азот, % об. |
|
НПВ |
ВПВ |
|
100 80 60 50 40 30 24 |
13,5 18 19 19 18 17 22 |
82 77 69 64 57 46 31 |
При повышении влажности газа пределы взрываемости сужаются, т.е. возможно применить парокислородную конверсию аммиака.
Смеси аммиака с кислородом воспламеняются со взрывом Твоспл=700–800С. В этих температурных пределах самовоспламенение происходит при любом содержании аммиака в аммиачно-кислородной смеси.
Практически применяемые аммиачно-воздушные смеси (концентрация аммиака 9,5–11,5%) не взрывоопасны (табл. 10). Существуют зависимости пределов взрываемости авс от содержания аммиака и кислорода при различных давлениях, описанные в специальной литературе.
Однако следует заметить, что скорость распространения взрыва невелика и для авс составляет 0,3–0,5 м/с. Т.е. для устранения возможности распространения взрыва нужно создать скорость газа больше этого значения (0,5 м/с). Это как раз и достигается использованием в процессе активных платиноидных катализаторов, где время контакта составляет ~10-4 c и, следовательно, линейная скорость более 1,5 м/с.
4.4. Зависимость степени конверсии аммиака от времени контакта
Нахождение кинетического уравнения реакции (1) данного процесса представляет большие трудности. Поэтому часто поступают таким образом: определяют лимитирующую стадию процесса и скорость стадии, считая, что скорость всего процесса и будет определяться скоростью этой стадии.
При атмосферном давлении скорость описывается уравнением первого порядка:
![]() (8)
(8)
или
![]() , (9)
, (9)
где α – степень конверсии.
Таким образом, для решения практических задач пользуются чаще всего эмпирическими уравнениями зависимости степени конверсии от времени контакта.
При длительном контакте газа с катализатором окисление сопровождается выделением большого количества элементарного азота, образующегося при взаимодействии NOх и NH3. Уменьшая время контакта, мы увеличиваем степень конверсии NH3, но только до определенного предела, т.к. при очень маленьком τ (линейная скорость велика и составляет > 10 м/с), может наблюдаться проскок непрореагировавшего аммиака, который частично превращается в элементарный азот. Это хорошо видно из графика (рис. 9).
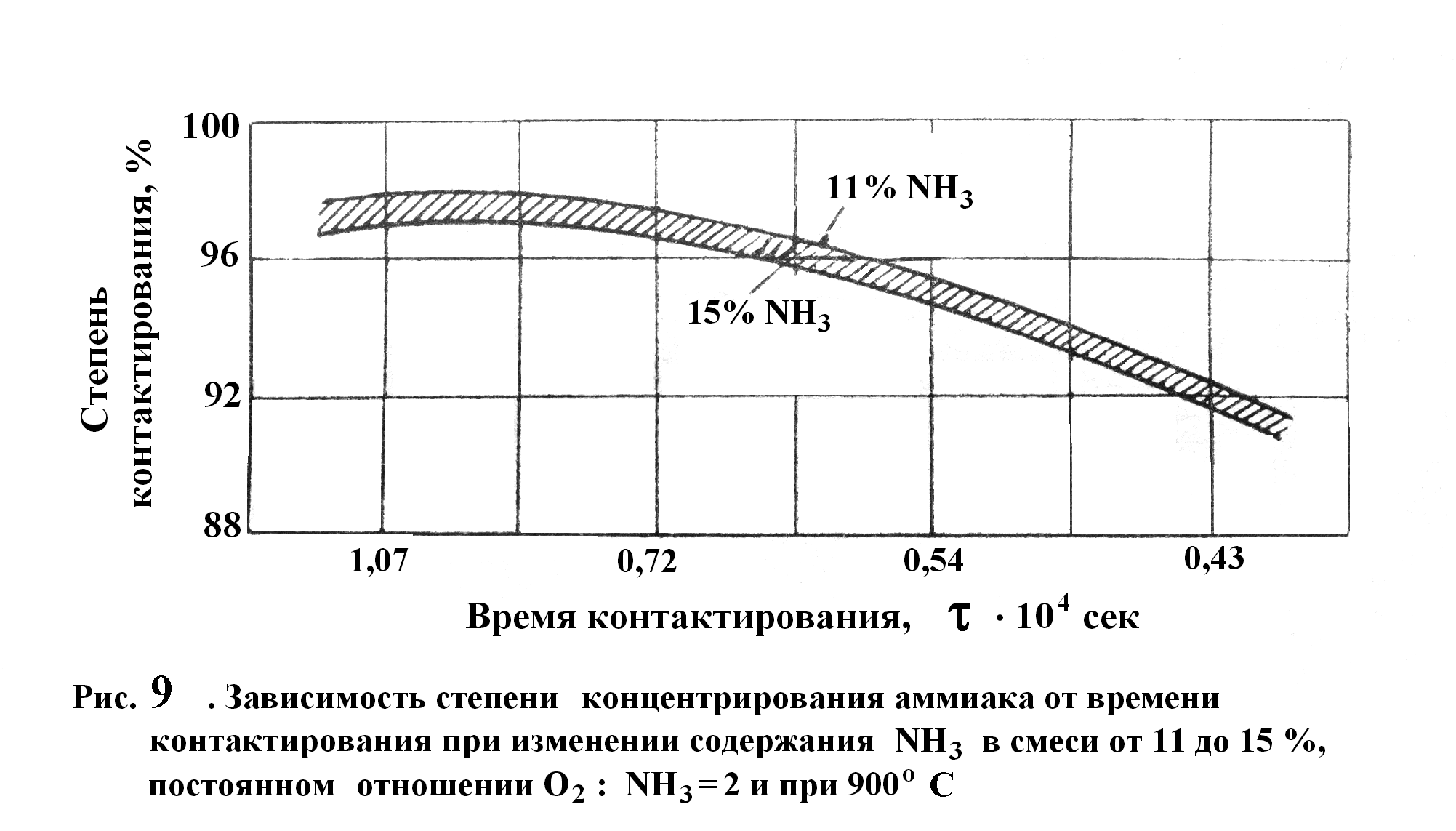
Из рисунка 9 также видно, что степень конверсии от содержания аммиака в газе зависит слабо.
Время конверсии NH3 на платинородиевом контакте при 900 С можно приближенно вычислить (при α=90–98 %) по уравнению 10:
![]() , (10)
, (10)
где τ – время конверсии, с;
α – степень конверсии, %.
Существует большое количество эмпирических уравнений для определения τ, количества прореагировавшего аммиака, напряженности катализатора и т.д., которые приведены в специальной литературе.
Таким образом, в заключении можно сказать, что степень конверсии NH3 зависит от:
температуры;
давления;
содержания NH3 в газе;
времени контактирования;
применяемого катализатора.
