
- •4. Контакное окисление аммиака
- •4.1. Физико-химические основы процесса
- •4.2. Катализаторы окисления аммиака
- •4.3. Состав газовой смеси. Оптимальное содержание аммиака в аммиачно-воздушной смеси
- •Зависимость степени конверсии аммиака от его содержания в авс
- •Нижний (нпв) и верхний (впв) пределы взрываемости смеси аммиак – кислород – азот
- •4.4. Зависимость степени конверсии аммиака от времени контакта
- •4.5. Окисление аммиака под давлением
4. Контакное окисление аммиака
4.1. Физико-химические основы процесса
Современные способы производства азотной кислоты основаны на контактном окислении аммиака. При окислении аммиака на различных катализаторах и в зависимости от условий, протекают следующие реакции (1,2,3):
4NH3+5O2=4NO+6H2O+907,3 кДж; (1)
4NH3+4O2=2N2O+6H2O+1104,9 кДж; (2)
4NH3+3O2=2N2+6H2O+1269,1 кДж. (3)
Кроме реакций (1-3) возможны и другие, протекающие в приповерхностных слоях катализатора. Например, разложение NO, взаимодействие N2O, NO2 и NH3:
2NO![]() N2+O2;
N2+O2;
2NH3+3N2O=4N2+3H2O;
8NH3+6NO2=7N2+12H2O.
Естественно, что реакция (1) будет являться «полезной». Термодинамические расчеты показывают, что реакции (1–3) практически протекают до конца.
Константы равновесия для обратных реакций (1–3) при 900С имеют следующие значения:
![]()



![]() ,
,
где k1 - NO+H2O; k2 - NH3+O2.
При 900 С каталитическое превращение аммиака в конечные продукты достигает 100%, т.е. процесс практически необратим.
Однако, уравнения (1–3) не отражают действительного механизма процесса, т.к. в этом случае в реакции (1) должны были бы одновременно столкнуться 9 молекул; в реакции (3) – 7 молекул. Это практически невероятно (напомнить молекулярность реакций).
Предложено несколько механизмов окисления аммиака на катализаторах. Различия заключаются в следующем:
Образование NO и N2 через промежуточное соединение на катализаторе.
Образование NO происходит на катализаторе, а образование N2 на катализаторе и в объеме газа.
На основании сказанного (о константе равновесия и механизмах окисления) можно констатировать, что выбранный катализатор должен обладать высокой активностью (большая скорость реакции и малое время контакта: при его увеличении возрастает вероятность образования N2) и селективностью по отношению к реакции (1).
Среди нескольких механизмов, предложенных нашими и зарубежными учеными, наибольшее распространение получил, предложенный Л.К. Андросовым, Г.К. Боресковым, Д.А. Эпштейном.
Поэтапно механизм можно представить следующим образом.
1 этап. Окисление поверхности платины. Образуется пероксидный комплекс катализатор–кислород (рис. 6).
![]()

Рис. 6. Структура пероксидного комплекса катализатор–кислород
2 этап. Диффузия и адсорбция аммиака на покрытой кислородом поверхности. Образуется комплекс: катализатор–кислород–аммиак (рис. 7).
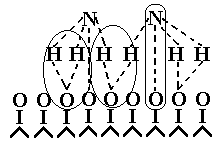
Рис. 7. Структура комплекса катализатор–кислород–аммиак
3 этап. Перераспределение электронных связей, разрыв старых связей и упрочнение новых связей.
4 этап. Десорбция продуктов и диффузия в поток газа (устойчивые соединения NO и Н2О удаляются с поверхности).
Освободившиеся центры вновь адсорбируют кислород, поскольку скорость диффузии кислорода выше, чем у аммиака и т.д. По мнению ученых кислород, входящий в решетку катализатора (неплатиновый контакт) в реакции окисления аммиака не участвует (доказано с помощью метода меченых атомов).
Превращение аммиака в азот, по мнению И.И. Бергера и Г.К. Борескова, может происходить в объеме в результате реакций аммиака как с кислородом, так и с оксидом азота.
Различают кинетическую, переходную и диффузионную области протекания процесса. Кинетическая область свойственна низким температурам: она ограничивается температурой зажигания катализатора, при которой отмечается быстрый самопроизвольный разогрев его поверхности, т.е. до температуры зажигания скорость лимитируется скоростью химической реакции на контакте. При Т>Тзаж. уже диффузия контролирует процесс – химическая реакция быстрая. Процесс переходит в диффузионную область. Именно эта область (600–1000С) характерна для стационарного автотермического процесса в промышленных условиях. Отсюда следует непременное увеличение объемной скорости газа и уменьшение времени контакта.
Реакция окисления аммиака на активных катализаторах начинается раньше: на Рd при 100С, на Pt при 145С, на Fe при 230С; на оксидах металлов температура начала реакции колеблется в широких пределах. Вместе с тем достаточной скорости и степени превращения она достигает при Т>600С.
