
- •Лекция 1. Особенности атомно-кристаллического строения металлов.
- •1. Кристаллическое строение металлов
- •2. Полиморфные и магнитные превращения в металлах
- •Лекция 2. Строение реальных металлов. Дефекты кристаллического строения
- •Лекция 3. Кристаллизация металлов
- •Законы кристаллизации
- •Строение металлического слитка
- •Методы исследования металлов
- •Определение химического состава.
- •Изучение структуры.
- •Физические методы исследования
- •Лекция 4. Общая теория сплавов. Строение, кристаллизация и свойства сплавов. Диаграмма состояния. Строение металлических сплавов
- •Контрольная работа № 1 до этой темы Кристаллизация сплавов
- •Понятие о диаграммах состояния сплавов
- •Количественный структурно-фазовый анализ сплава
- •Лекция 5. Диаграммы состояния двухкомпонентных сплавов
- •5.1 Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (сплавы твердые растворы с неограниченной растворимостью)
- •5.2 Диаграмма состояния сплавов с отсутствием растворимости компонентов в твердом состоянии (механические смеси)
- •5.3 Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии
- •5.4 Диаграмма состояния сплавов, компоненты которых образуют химические соединения
- •5.5 Диаграмма состояния сплавов, испытывающих фазовые превращения в твердом состоянии (переменная растворимость)
- •Связь между свойствами сплавов и типом диаграммы состояния (закон Курнакова)
- •Железоуглеродистые сплавы
- •Компоненты и фазы в сплавах железа с углеродом
- •Диаграмма состояния железо-цементит
- •Сплавы системы железо-углерод и их структура
- •1) С содержанием углерода менее 0,02% (точка р)- техническое железо.
- •2) Содержащие 0,02…2,14 % углерода - углеродистые стали.
- •3) Сплавы, содержащие углерода более 2,14 % (до 6,67 %), заканчивающие кристаллизацию образованием эвтектики (ледебурита), называют чугунами.
- •Превращения, протекающие при охлаждении сплавов
- •Стали. Влияние углерода и примесей на свойства сталей
- •Назначение легирующих элементов.
- •Распределение легирующих элементов в стали.
- •Классификация и маркировка сталей Классификация сталей
- •По химическому: составу: углеродистые и легированные.
- •По содержанию углерода:
- •По способу выплавки:
- •По назначению:
- •Маркировка сталей
- •Качественные углеродистые стали
- •Качественные и высококачественные легированные стали
- •Легированные конструкционные стали
- •Легированные инструментальные стали
- •Быстрорежущие инструментальные стали
- •Шарикоподшипниковые стали
- •Автоматные стали
- •Строение, свойства, классификация и маркировка серых чугунов
- •Технология термической обработки стали
- •1. Отжиг
- •2. Нормализация
- •3. Закалка
- •Способы закалки
- •Дефекты закалки
- •4. Отпуск
- •5. Старение
- •6. Обработка холодом
Контрольная работа № 1 до этой темы Кристаллизация сплавов
Кристаллизация сплавов подчиняется тем же закономерностям, что и кристаллизация чистых металлов. Необходимым условием является стремление системы в состояние с минимумом свободной энергии.
В сплавах в твердых состояниях, имеют место процессы перекристаллизации, обусловленные аллотропическими превращениями компонентов сплава, распадом твердых растворов, выделением из твердых растворов вторичных фаз, когда растворимость компонентов в твердом состоянии меняется с изменением температуры.
Эти превращения называют фазовыми превращениями в твердом состоянии.
При перекристаллизации в твердом состоянии образуются центры кристаллизации и происходит их рост. Обычно центры кристаллизации возникают по границам зерен старой фазы, где решетка имеет наиболее дефектное строение, и где имеются примеси, которые могут стать центрами новых кристаллов. У старой и новой фазы, в течение некоторого времени, имеются общие плоскости. Такая связь решеток называется когерентной связью. В случае различия строения старой и новой фаз превращение протекает с образованием промежуточных фаз.
Процессы кристаллизации сплавов изучаются по диаграммам состояния.
Понятие о диаграммах состояния сплавов
Диаграмма состояния - графическое изображение состояния любого сплава изучаемой системы в зависимости от его концентрации и температуры. Диаграмма состояния показывает равновесные, устойчивые состояния, т е. такие, которые при данных условиях обладают минимальной свободной энергией.
Диаграммы состояния дает возможность изучать фазы и структурные составляющие сплава, устанавливать возможность проведения термической обработки и ее режимы, температуры литья, горячей пластической деформации и т. д.
В любой системе число фаз, находящихся в равновесии, зависит от внутренних и внешних условий. Изменения, происходящие в системе, подчинены общему закону равновесия, который называется правилом фаз или законом Г и б б с а.
Правило фаз выражает зависимость между числом степеней свободы С (вариантностью) системы, числом компонентов К и числом фаз системы Ф, находящихся в равновесии. В общем виде
С = К - Ф + 2,
где 2 — число переменных внешних факторов равновесия (температура и давление).
Вариантность C (число степеней свободы) – это число внутренних и внешних факторов (температура, давление, концентрация), которые можно изменять без изменения количества фаз в системе.
Если вариантность C = 1 (моновариантная система), то возможно изменение одного из факторов в некоторых пределах, без изменения числа фаз.
Если вариантность C = 0 (нонвариантная cистема), то внешние факторы изменять нельзя без изменения числа фаз в системе.
Обычно все превращения в металлах и сплавах происходят при постоянном атмосферном давлении. Тогда правило фаз записывают так:
С = К - Ф + 1
где: С – число степеней свободы, К – число компонентов, Ф – число фаз, 1 – учитывает возможность изменения температуры.
Уравнение правила фаз позволяет корректировать правильность построения диаграмм состояния.
Построение диаграмм состояния осуществляют различными экспериментальными методами. Наиболее часто пользуются методом термического анализа. Сущность этого метода: отбирают несколько сплавов данной системы с различным соотношением масс входящих в них компонентов. Сплавы помещают в огнеупорные тигли и нагревают в печи. После расплавления сплавов тигли со сплавами медленно охлаждают и фиксируют скорость охлаждения. По полученным данным строят термические кривые в координатах время-температура. В результате измерений получают серию кривых охлаждения, на которых при температурах фазовых превращений наблюдаются точки перегиба и температурные остановки.
По полученным кривым охлаждения (критическим точкам) для различных сплавов изучаемой системы строят диаграмму состояния в координатах: по оси абсцисс — концентрация компонентов (компонента В), по оси ординат — температура.
Температуры, соответствующие фазовым превращениям, называются критическими точками.
Точки, отвечающие началу кристаллизации, называют точками ликвидуса, а конца кристаллизации - точками солидуса (в переводе с латинского ликвидус означает жидкий, солидус - твердый).
Линия 1, представляющая собой геометрическое место точек ликвидус, называется линией ликвидуса, выше этой линии все сплавы находятся в жидком состоянии. Линия 2 - геометрическое место точек солидус - называется линией солидуса, ниже этой линии все сплавы находятся в твердом состоянии.
Основные линии (рис.4.5) диаграммы: линии ликвидуса, солидуса, а также линии соответствующие фазовым превращениям в твердом состоянии (3, 4).
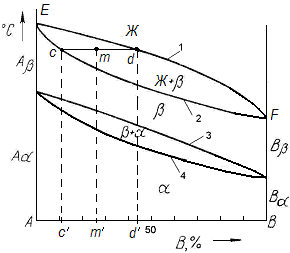 Рис. 4.5. Диаграмма
состояния
Рис. 4.5. Диаграмма
состояния
