
- •Глава 1 Введение
- •Глава 2 Свойства и типы стволовых клеток
- •II фаза терапии – расширение клеточных линий
- •III фаза терапии- дифференцированные предшественники клеток
- •Глава 3 Эмбриональные стволовые клетки
- •Глава 4 Взрослые стволовые клетки
- •Глава 5 Современное лечение
- •Глава 6 Стволовые клетки и тканевая инженерия
- •Глава 7 Стволовые клетки в генной терапии
- •Глава 8 Раковые стволовые клетки
- •Глава 9 Стволовые клетки в зубной ткани
- •Глава 10 Заключение
Глава 6 Стволовые клетки и тканевая инженерия
КЛЕТКИ, ИСПОЛЬЗУЕМЫЕ В ТКАНЕВОЙ ИНЖЕНЕРИИ
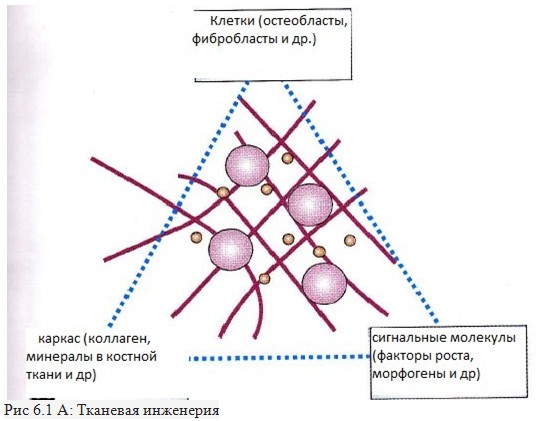

Клетки часто классифицируются по их источнику:
Аутологичные клетки получают от того же индивидуума, которому они будут реимплантированы. Клетки имеют наименьшее количество проблем с отторжением и передачей патогенных микроорганизмов, однако, в некоторых случаях они могут быть недоступны. Например, при генетической болезни соответствующие аутологичные клетки недоступны. Также очень больные или пожилые люди, а также больные с тяжелыми ожогами, могут не иметь достаточного количества клеток, чтобы установить полезные клеточные связи. Более того, так как эта категория клеток должна быть взята у пациента, есть также некоторые проблемы, связанные с необходимостью выполнения таких хирургических операций, которые могут привести к заражению донора или к хронической боли.
Аутологичные клетки должны быть культивированы из образцов, прежде чем они могут быть использованы: это занимает много времени, так как аутологичный раствор готовится очень быстро. В последнее время наблюдается тенденция к использованию мезенхимальных стволовых клеток из костного мозга и жира. Эти клетки могут дифференцироваться в различные типы тканей, в том числе ткани кости, хряща, жира и нерва. Большое количество клеток может быть легко и быстро изолировано от жира, тем самым создавая потенциал для большого количества клеток, чтобы быстро и легко их получить. Несколько компаний было создано, чтобы заработать на этой технологии, самым успешной в это время является Центр терапии.
Аллогенные клетки берут из тела того же донора. Хотя есть некоторые этические ограничения на использование человеческих клеток для исследований в пробирке, применение фибробластов кожи крайней плоти человека показало, чтобы это является иммунологически безопасным и жизнеспособным выбором для тканевой инженерии кожи.
Ксеногенные клетки, выделенные от другого человека. В особенности клетки животных были достаточно широко использованы в экспериментах для создания сердечно-сосудистых имплантатов.
Сингенные или изогенные клетки выделяют из генетически идентичных организмов, таких как близнецов, клонов, или высоко инбредных животных пород.
Первичные клетки от организма
Вторичные клетки от банка клеток
С
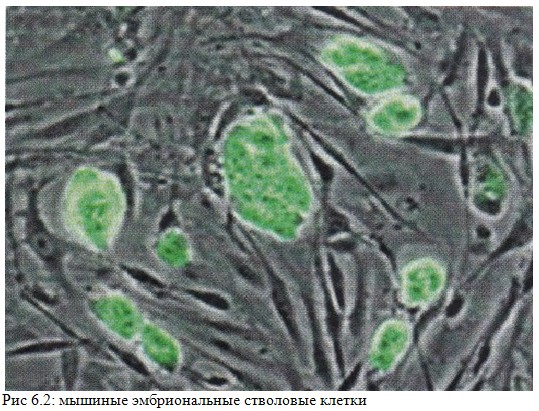 тволовые
клетки
являются недифференцированными клетками
с возможностью разделить в культуре и
создать различные формы специальных
клеток. Согласно источникам, стволовые
клетки делятся на «взрослые» и
«эмбриональные» стволовые клетки,
первый класс мультипотентный, а второй
в основном плюрипотентный; некоторые
клетки тотипотентны, на самых ранних
стадиях развития эмбриона. Пока еще
есть большая этическая дискуссия,
связанная с использованием эмбриональных
стволовых клеток; считается, что
стволовые клетки могут быть полезны
для восстановления больных или
поврежденных тканей, или могут быть
использованы для роста нового организма.
(Рис.6.2)
тволовые
клетки
являются недифференцированными клетками
с возможностью разделить в культуре и
создать различные формы специальных
клеток. Согласно источникам, стволовые
клетки делятся на «взрослые» и
«эмбриональные» стволовые клетки,
первый класс мультипотентный, а второй
в основном плюрипотентный; некоторые
клетки тотипотентны, на самых ранних
стадиях развития эмбриона. Пока еще
есть большая этическая дискуссия,
связанная с использованием эмбриональных
стволовых клеток; считается, что
стволовые клетки могут быть полезны
для восстановления больных или
поврежденных тканей, или могут быть
использованы для роста нового организма.
(Рис.6.2)
ИНЖЕНЕРНЫЕ МАТЕРИАЛЫ
Клетки, о которых говорилось выше, обычно имплантируют или "подсеивают" в искусственную среду, способную поддерживать образование трехмерной ткани. Каркас часто имеет решающее значение, как в искусственных, так и в естественных условиях, так как обобщает условия среды и позволяет клеткам влиять на их собственные микросреды. Такие устройства, как правило, служат по меньшей мере, для одной из следующих целей:
Прикрепление клеток и их миграция
Доставка и сохранение клеток и их биохимических факторов
Распространение жизненно важных питательных веществ клеток и выделение продуктов жизнедеятельности
Оказать определенные механические и биологические влияния, чтобы изменить поведение клеточной фазы
Для достижения цели реконструкции ткани, каркас должен отвечать некоторым требованиям. Высокая пористость с соответствующим размером пор, которые необходимы для содействия посева клеток и распространения по всей структуре клеток питательных веществ. Способность к биологическому разложению является существенной, так как каркас должен быть поглощен окружающими тканями без необходимости хирургического удаления. Скорость, с которой происходит разрушение, должна совпадать как можно больше со скоростью образования ткани: это означает, что в то время как клетки изготовят собственную структуру природной матрицы вокруг себя, каркас способен обеспечить структурную целостность в организме и в конечном итоге он будет оставлять новую ткань, которая будет обеспечивать механическая защиту. Нагнетаемость также важна для клинического использования.
Много различных материалов (натуральных и синтетических, разрушающихся и постоянных) было исследовано. Большинство из этих материалов использовались в области медицины до появления тканевой инженерии в качестве саморассасывающихся швов. Примерами таких материалов являются коллаген или линейный алифатический полиэстер.
Новые биоматериалы были разработаны с целью создания идеальных свойств и функциональных настроек: нагнетаемость, синтетическое производство, биосовместимость, неиммуногенность, прозрачность, наноразмерные волокна, низкая концентрация, ставки резорбции.
PuraMatrix, происходящих из MIT лабораториях Чжан, Рич, Гродзинский и Langer является одним из новых биомиметических семей каркасов, которые в настоящее время внедрены в торговлю и влияют на клиническую инжиниринг тканей.
Обычно используется синтетический материал PLA - полимер молочной кислоты. Это полиэстер, который деградирует в организме человека с образованием молочной кислоты, по природе химическое вещество, которое легко удаляется из организма.
Подобные материалы полигликолевой кислоты и поликапролактона: механизм их деградации аналогичен PLA, но у них медленнее скорость деградации по сравнению с PLA.

 Каркасы также могут
быть изготовлены из натуральных
материалов, в частности
различные производные внеклеточного
матрикса были изучены, чтобы оценить их
способность поддерживать рост клеток.
Белковые материалы, такие как коллаген,
фибрин, полисахаридные материалы, такие
как хитозан или гликозаминогликаны, все
оказалось подходит с точки зрения
совместимости клеток, но некоторые
проблемы с потенциальной иммуногенностью
все еще остались. Среди ГАГ гиалуроновая
кислота в сочетании с сшивающим
агентов является одним из возможных
вариантов каркасного материала.
Функциональные группы каркасов могут
быть полезны в доставке малых
молекул конкретным тканям (Рис.6.4
и 6.5).
Каркасы также могут
быть изготовлены из натуральных
материалов, в частности
различные производные внеклеточного
матрикса были изучены, чтобы оценить их
способность поддерживать рост клеток.
Белковые материалы, такие как коллаген,
фибрин, полисахаридные материалы, такие
как хитозан или гликозаминогликаны, все
оказалось подходит с точки зрения
совместимости клеток, но некоторые
проблемы с потенциальной иммуногенностью
все еще остались. Среди ГАГ гиалуроновая
кислота в сочетании с сшивающим
агентов является одним из возможных
вариантов каркасного материала.
Функциональные группы каркасов могут
быть полезны в доставке малых
молекул конкретным тканям (Рис.6.4
и 6.5).
СИНТЕЗ ТКАНЕВОЙ ИНЖЕНЕРИИ КАРКАСОВ
М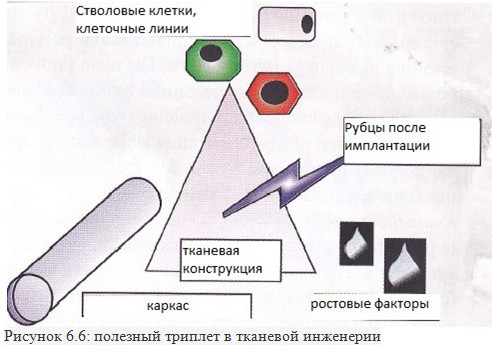 ного
различных методов было описано
в литературе для получения пористых
структур для использования каркасов
в тканевой инженерии. (Рис.6.6)
Каждый из
тех методов имеет свои
преимущества, но никто не лишен
недостатков.
ного
различных методов было описано
в литературе для получения пористых
структур для использования каркасов
в тканевой инженерии. (Рис.6.6)
Каждый из
тех методов имеет свои
преимущества, но никто не лишен
недостатков.
Нановолокон самосборки: Молекулярная самосборка является одним из методов для создания материалов со свойствами, подобными по своим масштабам и химии, что и естественного внеклеточного матрикса в естественных условиях. Кроме того, гидрогелевый каркас показал превосходство в естественных условиях токсикологии и биосовместимости по сравнению с традиционными макрокаркасами и материалами животного происхождения. PuraMatrix синтетические пептидные гидрогели являются примером в этой категории.
Текстильные технологии: эти методы включают все те подходы, которые были успешно использованы для приготовления нетканых сеток различных полимеров. В частности нетканые структуры полигликолида были испытаны для тканевой инженерии: такие волокнистые структуры оказались полезными для роста различных типов клеток. Основные недостатки связаны с трудностями получения высокой пористости и регулярного размера пор.
Растворитель литья и твердые выщелачивания: этот подход позволяет получать пористые структуры с регулярной пористостью, но ограниченной толщины. Первый полимер растворяют в подходящем органическом растворителе, и затем раствор заливают в форму, заполненную порогенными частицами. Таким порогеном может быть неорганическая соль, такая как хлорид натрия, кристаллы сахарозы, желатина, или парафина. Размер частиц порогена влияет на размер пор каркаса, в то время соотношение полимер-пороген напрямую зависит от количества пористости конечной структуры. После раствор полимера бросают в растворитель и дают полностью испариться, составная структура в форму погружется в ванну с жидкостью, пригодной для растворения порогена: вода с хлоридом натрия, сахароза и желатин или алифатический растворитель, такой как гексан в парафин. После того, как пороген полность юрастворяется, получают пористую структуру. Кроме небольшого диапазона толщины, который может быть получен, есть еще один недостаток SCPL, который заключается в использовании органических растворителей, которые должны быть полностью удалены, чтобы избежать возможного повреждения клеток, посеянных на каркас.
Пенообазующий газ: был разработан для использования с органическими растворителями и твердыми порообразователями в технологии с использованием газа в качестве порообразователя. Первый конструкции, образованные из желаемого полимера, получают путем прямого прессования с использованием нагретой формы. Диски помещают в камеру, где они подвергаются воздействию высокого давления СО2 в течение нескольких дней. Давление внутри камеры постепенно восстанавливается до атмосферного уровня. Во время этой процедуры поры, образованые молекулами диоксида углерода, приобретают губчатую структуру. Основные проблемы, связанные с таким методом, вызваны избыточным теплом, используемым во время компрессионного формования и с тем, что поры не образуют взаимосвязанную структуру.
Эмульгирование / сублимационная сушка: Этот метод не требует использования твердого порогена подобно SCPL. Сначала синтетический полимер растворяют в подходящем растворителе затем добавляют воду к полимерному раствору и две жидкости смешиваются, для того чтобы получить эмульсию. Затем эмульсию погружают в литую форму и быстро замораживают путем погружения в жидкий азот. Замороженную эмульсию затем сушат вымораживанием, чтобы удалить диспергированную воду и растворитель, в результате чего получают затвердевшую, пористую полимерную структуру. Хотя эмульгирование и сублимационная сушка позволяют быстрее приготовить препарат по сравнению с SCPL, так как он не требует много времени выщелачивани, он все еще требует использования растворителей, причем размер пор является относительно небольшим и пористость часто бывает неправильной формы. Сам по себе метод сушки вымораживанием используют метод для изготовления строительных каркасов. В частности, он используется для подготовки коллагеновой губки: коллаген растворяют в кислом растворе уксусной кислоты или соляной кислоты, которые отлиты в форму, заморожены в жидком азоте затем их лиофилизируют.
Фазовое разделение жидкость-жидкость: Как и в предыдущем методе, эта процедура требует использования растворителя с низкой температурой плавления, которая легко повышается. Например, диоксан может быть использован для растворения полимолочной кислоты, потом разделяют фазы, путем индуцированного добавления небольшого количества воды: образуются полимер-богатые и полимер-бедные фазы. После охлаждения растворителя ниже точки плавления и несколько дней вакуумной сушки, обеспечивающей сублимацию растворителя, получают пористый каркас. Разделение фаз жидкость-жидкость имеет те же недостатки, что и эмульгирования /сушки вымораживанием.
C
 AD
/ CAM технологии: Поскольку
большинство описанных выше подходов
ограничены, когда дело доходит
до контроля пористости и размера
пор, в тканевую инженерию были введены
автоматизированное проектирование и
технологии изготовления. Во-первых,
трехмерная структура разработан с
использованием системы автоматизированного
проектирования, а затем каркасы
реализуются с помощью струйной печати
полимерных порошков или через
моделирование осаждения расплава
полимера. (Рис.6.7)
AD
/ CAM технологии: Поскольку
большинство описанных выше подходов
ограничены, когда дело доходит
до контроля пористости и размера
пор, в тканевую инженерию были введены
автоматизированное проектирование и
технологии изготовления. Во-первых,
трехмерная структура разработан с
использованием системы автоматизированного
проектирования, а затем каркасы
реализуются с помощью струйной печати
полимерных порошков или через
моделирование осаждения расплава
полимера. (Рис.6.7)
МЕТОДЫ СБОРКИ
Одной из неизменных, постоянных проблем инженерии ткани является ограничения транспорта масс. Инженерии тканей обычно не хватает первоначального кровоснабжения, таким образом, для любых имплантированных клеток затруднено получение кислорода и питательных веществ для выживания и/или функционирования должным образом.
С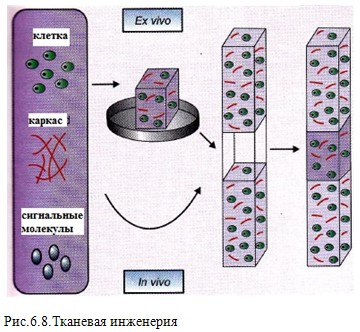 амосборка
может играть здесь важную роль, как от
перспективы инкапсулирования клеток
и протеинов, а также создания каркасов
на правильном физически масштабе для
инженерии тканевых конструкций и
клеточных составов в рост.
амосборка
может играть здесь важную роль, как от
перспективы инкапсулирования клеток
и протеинов, а также создания каркасов
на правильном физически масштабе для
инженерии тканевых конструкций и
клеточных составов в рост.
Это позволило бы печатать органы или, возможно, целый организм. Недавний инновационный метод конструкции использует струйный механизм печати точных слоев клеток в матрице термообратимого геля. Эндотелиальные клетки, клетки выстилающие кровеносные сосуды, были напечатаны в наборе сложенных колец. При инкубации они слились в трубу. (Рис.6.8)
СУБСТРАТЫ БИОМАТЕРИАЛА ДЛЯ КЛОНАЛЬНОЙ ЭКСПАНСИИ ГЕННОЙ ИНЖЕНЕРИИ СТВОЛОВЫХ КЛЕТОК
Важным потенциальным клиническим применением стволовых клеток является использование в клеточной заместительной терапии для ингибирования генетических расстройств. Используя вирусный вектор трансдукции, стволовые клетки могут воздействовать in vitro на коррекцию генетических аберраций или недостатков. При трансплантации пациентам такие клетки могли бы восстановить нормальную функцию ткани. Так как сайты вирусного вектора инверсии широко случайны в распределении, то высок риск неопластических трансформации отдельных трансдуцированных клонов. Этот риск может, по-видимому, быть защитой конструкции вирусного вектора. В качестве альтернативы, этап предварительного отбора клонов, не скрывающих вредоносных инсерций, с последующей тщательной доклинической оценкой этих клонов на животных, может минимизировать риск. Ex vivo распространение предварительно отобранных клонов может быть достигнуто в биореакторе, сделанном из подхлдящих биоматериалов, производимых достаточным количеством клеток, прививаемых пациенту.
БИОМАТЕРИАЛЫ ДЛЯ ДИФФЕРЕНЦИАЦИИ СТВОЛОВЫХ КЛЕТОК
П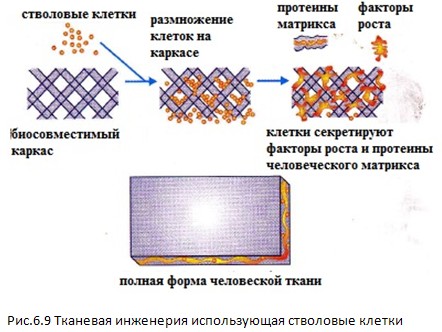 ластичность
эмбриональных стволовых клеток (ЕSC)
представлена вошедшей в поговорку
«палкой о двух концах» за ее использование
в клиническом применении. Хотя чисто
желательным свойством является
представление огромного репертуара
дифференциации, еще существует риск
онкогенности. Недифференцируемые
клетки, сохраняющие плюрипотентность,
дают начало опухолям, известными как
тератомы. Следовательно, это опасность
любой терапевтической стратегии,
использующей стволовой клеточно-основной
подход, гарантирующий полную и необратимую
дифференциацию стволовых клеток в
желаемые предшественники или окончательную
цель типа клеток. Это может быть
осуществлено поддержкой соответствующими
трофическими факторами в средней
культуре, или доставкой их от каркаса
контролируемым способом. (Рис.6.9)
ластичность
эмбриональных стволовых клеток (ЕSC)
представлена вошедшей в поговорку
«палкой о двух концах» за ее использование
в клиническом применении. Хотя чисто
желательным свойством является
представление огромного репертуара
дифференциации, еще существует риск
онкогенности. Недифференцируемые
клетки, сохраняющие плюрипотентность,
дают начало опухолям, известными как
тератомы. Следовательно, это опасность
любой терапевтической стратегии,
использующей стволовой клеточно-основной
подход, гарантирующий полную и необратимую
дифференциацию стволовых клеток в
желаемые предшественники или окончательную
цель типа клеток. Это может быть
осуществлено поддержкой соответствующими
трофическими факторами в средней
культуре, или доставкой их от каркаса
контролируемым способом. (Рис.6.9)
Были
развиты различные технологии включения
функции доставки лекарств в карскас.
Протеины, пептиды или плазмиды ДНК могут
быть погруженными в микросферы и
беспорядочно рассредоточиваться в
макропористый полимерный каркас, или
они могут быть инкапсулированы в нити
перед формированием волокнистого
каркаса. Этот подход, основанный на
биоматериалах, обеспечивающий локальную
и непрерывную доставку факторов роста,
мог быть особенно ценен для развития
обсемененных эмбриональными клетками
каркасов in
vivo.
Механические свойства каркаса или
культуральная поверхность может также
оказывать значительное влияние на
дифференциацию засеянных стволовых
клеток. К оказываемой силе тяги на
субстрат многие зрелые типы клеток,
такие как эпителиальные клетки,
фибробласты, миоциты и нейроны чувствуют
жесткость субстрата и показывают отличия
морфологии и связывающих характеристик.
Эта механочувствительность была недавно
расширена до дифференциации мезенхимальных
стволовых клеток (MSC).
При культивировании в агаровом геле с
увеличением плотности сшивки человеческие
МSC
дифференцируются в нейрональных,
мышечных или костных предшественников
в соответствии с жесткостью матрикса,
приблеженного к мозговой, мышечной или
костной ткани соответственно. Учение
о первостепенной важности эластичности
матрикса в диктовании участи с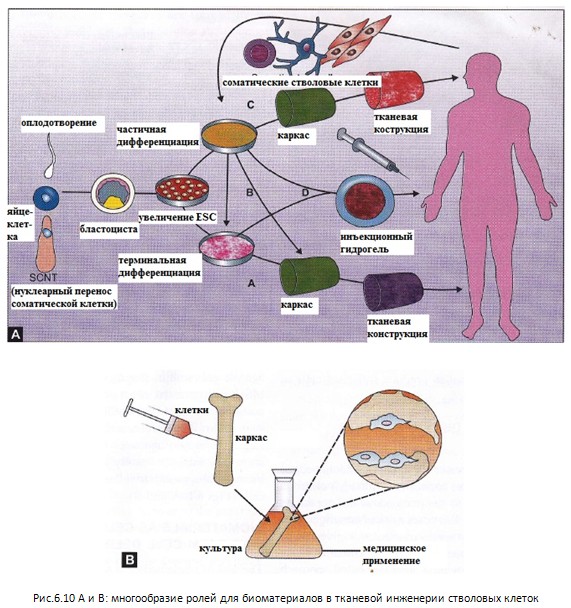 тволовых
клеток также предлагает интересный
подход влияния биоматериала на
дифференциацию стволовых клеток. (рис.
6.10 А и В)
тволовых
клеток также предлагает интересный
подход влияния биоматериала на
дифференциацию стволовых клеток. (рис.
6.10 А и В)
БИОМАТЕРИАЛЫ КАК КЛЕТОЧНЫЕ НОСИТЕЛИ ДЛЯ ДОСТАВКИ СТВОЛОВЫХ КЛЕТОК IN VIVO
Потеря имплантированных клеток может возникнуть в результате цитотоксичности или повреждения клеток при объединении клеток в ткань хозяина, которая представляет собой значительную проблему современных подходов тканевой регенерации. Место травмы или больные органы часто представляют собой агрессивную среду для укрепления и населения их здоровыми клетками в связи с повышенным иммунологическим наблюдением и высокой концентрацией цитокинов воспаления в этих местах. Поэтому дополнительная роль каркасов тканевой инженерии в изоляции клеток от иммунной системы организма-хозяина, избегая необходимый для этого жесткий иммуносупрессивный режим, способствующий выживанию трансплантатов. Были обнаружены биоматериалы, основанные на альгинате, для иммунопротекции инкапсулированных клеток, и предварительные исследования продемонстрировали их возможное использование в качестве транспорта для доставки стволовых клеток. Объединение в иммунномодуляторные молекулы в биоматериальные конструкции может стать решением проблемы иммунноотторжения.
НОВЫЕ ТЕНДЕНЦИИ ТКАНЕВОЙ ИНЖЕНЕРИИ СТВОЛОВЫХ КЛЕТОК
Микро/нанопаттерны: биоматериалы для прямой дифференциации стволовых клеток
У же
давно признано влияние особенностей
поверхности или топографии на клеточный
рост, движение и ориентацию. Базальные
мембраны, которая служит как основной
субстрат для клеточных структур во всем
теле позвоночных, не являются гладкими
структурами, а скорее, покрыты бороздами,
гребнями, ямками, порами, и фибриллярная
сетчатая структура внеклеточного
матрикса (ЕСМ), состоящая преимущественно
из переплетенных нитей коллагена и
эластических волокон диаметром от 10 до
300 нм. Кроме обеспечения прочности на
разрыв и механической прочности базальной
мембраны, фибриллярная сетчатая структура
протеиновых волокон вместе с
глюкозаминогликанами также предоставляет
привязывание к месту для менее
распространенных молекул клеточной
адгезии. Ниши естественных стволовых
клеток, таких как отсек костного мозга,
хорошо снабжаются «поучительными»
молекулами для ЕСМ, секретируемые
стромальными клетками. ЕСМ, по-видимому,
является неполностью аморфным
образованием, но обладающим определенной
степенью четвертичной организации.
Волокна ВКМ выстроены полувыровненной
матрицой, в которой происходит
взаимодействие клеток. На тканевом
уровне упорядоченность топографической
организации более очевидна. Например,
паралелльно выровненные волокна
обнаружены в сухожилиях, связках и
мышцах. Концентрические завитки можно
наблюдать в кости, и похожие на сеть и
ортогональные решетки представлены на
коже и роговице глаза соответственно.
Отсюда, не является неожиданностью то,
что клетки отвечают на топографические
сигналы. (Рис.
6.11)
же
давно признано влияние особенностей
поверхности или топографии на клеточный
рост, движение и ориентацию. Базальные
мембраны, которая служит как основной
субстрат для клеточных структур во всем
теле позвоночных, не являются гладкими
структурами, а скорее, покрыты бороздами,
гребнями, ямками, порами, и фибриллярная
сетчатая структура внеклеточного
матрикса (ЕСМ), состоящая преимущественно
из переплетенных нитей коллагена и
эластических волокон диаметром от 10 до
300 нм. Кроме обеспечения прочности на
разрыв и механической прочности базальной
мембраны, фибриллярная сетчатая структура
протеиновых волокон вместе с
глюкозаминогликанами также предоставляет
привязывание к месту для менее
распространенных молекул клеточной
адгезии. Ниши естественных стволовых
клеток, таких как отсек костного мозга,
хорошо снабжаются «поучительными»
молекулами для ЕСМ, секретируемые
стромальными клетками. ЕСМ, по-видимому,
является неполностью аморфным
образованием, но обладающим определенной
степенью четвертичной организации.
Волокна ВКМ выстроены полувыровненной
матрицой, в которой происходит
взаимодействие клеток. На тканевом
уровне упорядоченность топографической
организации более очевидна. Например,
паралелльно выровненные волокна
обнаружены в сухожилиях, связках и
мышцах. Концентрические завитки можно
наблюдать в кости, и похожие на сеть и
ортогональные решетки представлены на
коже и роговице глаза соответственно.
Отсюда, не является неожиданностью то,
что клетки отвечают на топографические
сигналы. (Рис.
6.11)
Исследования показали, что не только особенности топографии важны, но также важна их конформация – где располагаются гребни, борозды, ямки, завитки, поры, или сайты, и что интригующе – их симметричность. С приходом микро- нанопроизводительных технологий стало возможным их изготовление обособленно и исследуемых независимо от топографических и биохимических влияний на клеточные микросреды ниши. Используя технологии, заимствованных прямо из индустрии полупроводника и микроэлектроники, была развито множество методов для создания паттернов поверхности, чтобы исследовать клеточное поведение, отличающиеся взаимодействием как клетка – матрикс и клетка- клетка, поляризационную клеточную адгезию, клеточную дифференциацию в ответственности за текстуру поверхности, клеточную миграцию, механотрансдукцию, и клеточную реакцию на подъем эффектов поверхностно-связанных лигандов.
Методы паттернирования, такие как химическое осаждение из газовой фазы (CVD), физическое осаждение из газовой фазы (PVD), электрохимическое осаждение, мягкая литография, фотолитография, электрон-лучевая литография, электроспиннинг, послойное микрожидкостное паттернирование, трех объемное (3D) изображение, ионное фрезерирование и реактивное ионное травление были детально проработаны серией авторов. Эти методы, соединенные с компьютером, помогающим моделировать инструменты и быстрые прототипы технологий, помогают открывать возможности изготовления каркасов тканевой инженерии с точно контролируемыми геометрией, текстурой, пористостью и жесткостью.
Микро- и наношкалы методов паттернирования особенно удобны для зондирования взаимодействующих стволовых клеток с их микросредой, потому что они точно по уровням совмещать с деликатным регулированием контроля судьбы стволовых клеток. Остеобласты оказались удобной моделью для изучения клеточно-топографического взаимодействия, так как они открыто реагируют на канавочной топографии биоматериалов. Остеобласты показывают анизотропное поведение при культивировании на нанопаттернированных канавках, созданных на полистериновой поверхности, используемых в комбинации с литографией Langmuir-Blodgett и наноотпечатыванием, или на микропаттернированных канавках, использующих горячее тиснение отпечатков литографии. Клетки наблюдали для выравнивания, элонгации и миграции, параллельно канавкам. Глубина канавок обнаружена к воздействию выравнивания клеток, с 150 нм канавки вызывается статистически высокий уровень выравнивания по сравнению с 50 нм канавки. Экспрессия остеобластического фенотипа была наиболее видной на петтерн-поверхностях, включающих кальция фосфат, придавая значение синергизму между топографией и химией поверхности. Покрытые фибриногеном микроканавочные поверхности, созданные из биоразложения смеси поли(3-гидроксибутират-3-гидроксивалерат) и поли(L-молочная кислота) – повышенное выравнивание остеобластов вдоль канавок. Микропаттернирование повсеместного RGDS адгезивного пептида, известно как остеобласт-специфический KRSR пептид, производимый упорядоченным множеством агрегированных остеобластов. Полученная чувствительность остеобластов к топографии показала, что успех интеграции эндооссальных имплантатов зависит от их поверхностной топографии.
Паттернирование субстрата держит конкретную полезность в нейрональной инженерии тканей, потому что восстановление неврологических травм часто требует направленного управления в условиях роста нейрона, миграции, проекции аксона или формирование синапса. Взрослые гиппокампальные клетки-предшественники (HPCs), культивировали совместно с астроцитами постнатальной крысы типа-1, и микропаттернировали расширенно вдоль канавок полистеринового субстрата, химически модифицированных с ламинином. Прямо выровненные поли (L-молочной кислоты) (PLLA) нановолоконные каркасы, созданные электроспининнгом индуцировали нервные стволовые клетки (NSCs) к самовыравниванию параллельно волокнам. Изображение микроконтакта нейрон-адгезивных пептидов использующей поли(диметилсилоксан) мягкую литографию представляет собой ценный инструмент для изучения управления аксонами и образованием аксонов в нейробиологии. Тканевая инженерия скелетных мышц могла также получать выгоду от технологий микро- и нанопаттернирования. Скелетная мышца представляет собой высокоорганизованную структуру, состоящую из длинных параллельных пучков многоядерных мышечных трубок, которые образуются путем дифференциации и слияния миобластных сателлитных клеток. При нормальных условиях культивирования на обычной тканевой культуре полистерина миобласты растут в монослои с фибробластической морфологией. Однако в присутствии топографических сигналов, таких как выровненные нановолокна или микропаттернированный субстрат, миобласты сливаются в ассамблеи вытянутых мышечных трубок.
ЭШАФОТ НА ОСНОВЕ СИСТЕМЫ ДОСТАВКИ НАНОЧАСТИЦ
Нанотехнологии предоставил новые пути для функционализации ТЕ подмости с биоактивными факторами (препараты белков или нуклеиновых кислот) . Вместо того, легирование факторов непосредственно в сыпучего материала во время изготовления строэшафота, эти факторы первого могут быть инкапсулированы в наночастицах , которые затем диспергируют в объемном материале . Факторы доставляются клеток , когда наночастицы высвобождаются во время деградации эшафота .
Такая система доставки имеет ряд преимуществ:
• К разумного выбора материала оболочки наночастиц, скорость высвобождения фактора может быть более жестко регулируется , потому что инкапсуляция в наночастицах может ограничить диффузию. Скорость высвобождения фактора будет зависеть от скорости разложения на эшафот , размер и плотность наночастиц , а также от характера наночастиц ;
• Факторы, могут быть защищены от внешнего деградации перед поставкой в клетки, что очень важно для лабильных веществ, таких как факторы роста, ДНК плазмиды и миРНК
• Инкапсуляция в наночастицах может решить вопросы, растворителей несовместимости между грузом и леса сыпучих материалов.
РАЗВИТИЕ БИОМАТЕРИАЛОВ ДЛЯ СТВОЛОВЫХ КЛЕТОК
Расширение и дифференциация ЭСК
Расширение ЭСК
До недавнего времени, расширение человеческих ЭСК не проводилось исключительно на слоях фидерных клеток. Однако последние сообщения из определенных , фидерных без препаратов для вывода и поддержания эмбриональных клеток обещаем изменить этот сценарий. Биоматериалы на основе расширения человеческих ЭСК в настоящее время стали различные возможности , как и масштабное культуру эмбриональных клеток в биореакторах . Это мы надеемся, приведет к облегчению , если не устранение , из двух основных препятствий на пути широкого внедрения ЭС технологий в клинике , которые озабоченность воздействием компонентов животных , а также согласованность как в качестве и количестве питания клеток.
Биоматериалы на основе расширения были взяты с мышиных ЭСК . Ряд исследований описано применение гидрогеля полимеров в качестве опорной подложке для основного техобслуживания мышиных ЭСК и эмбриоидного тела (ИС) образования .
Harrison и соавт оценивали влияние модифицирован поли (а- гидроксиэфиров ), такие как поли ( D, L -ta поли ( гликолида ) и PLGA на мышиной ESC | лейкоз ингибирующий фактор кондиционером обработка поверхности подложки , который цепь полиэфира в присутствует карбоксильная и гидро увеличивает гидрофильность и значительно я пролиферацию зрелых ЭСК .
Мышиные ЭСК культивировали на электро развернутой полиамидной матрице (Ultra -Web ) показал большую пролиферацию и самообновление по сравнению с заранее подготовленной мерной культуры ткани поверхности , выделяя из 3D топографии. Молекулярный анализ объявлением показал активацию небольшого GTPase фосфоинозитидного 3- киназы , которая , связанна со стволовмих клетоками к самообновлению и Nanog , в человеческом белке необходимого для ма плюрипотентности . Было сделано предположение, что 3D микро из ультра веб повторил ECM основание , чтобы активировать пролиферацию клеток стволовых и чувство собственного возобновления.
ЭСК человека были расширены в пробирке , как с агрегатов , известных как EB. Культура эмбриональных клеток в тихоходные бокового биореактора дали до трехкратного увеличения образования EB сравнению со статическими культур блюдо . Впоследствии сообщалось формирование человека ЭТ в течение 3D пористых альгината эшафота . Существует, однако , тенденция в культивированных человеческих ЭТ и подвергаются спонтанной дифференцировке , в частности, васкулогенез . Хорошее понимание факторов, влияющих на ESC самообновление , обслуживанию и базовый ген нормативные и сигнальные механизмы трансдукции сыграет свою роль в руководстве будущих конструкций биоматериалов для расширения ES.
Дифференциация эмбриональных стволовых клеток (ЭСК)
Достижение выработку специфических тканей из ЭСК потребует точного управления их дифференциацией. Это будет связано как с физическими, так и с биохимическими сигналами учавствующими в действии . Универсальность такой концепции была продемонстрирована индукцией человека с ESC дифференцировки в различных эмбриональных типов тканей в пределах биоразлагаемого полимера 3D помост , изготовленного из смеси 50:50 PLGA и ПЛМК . Тип ткани производства зависит от фактора роста дифференциации , которая была дополнена . Ретиноевая кислота и трансформирующий фактор ростаиндуцированного ESC дифференциации в 3D- структурах с характеристиками в разработке нервной ткани и хрящей , соответственно, тогда как активин -или инсулин-подобный фактор роста индуцированного печень , как тканей.
Хотя посева клеток проводили в присутствии матригеля или на каркасах , предварительно покрытых фибронектином , было показано, что ни Матригель ни один фибронектина может потенцировать эффекты, наблюдаемые с каркасов PLGA / PLLA . В связи с этим была высказана гипотеза , что механическая жесткость присуждается эшафот действовали синергично с Матригель или фибронектином для повышения дифференциации человеческого ESC и 3D организацию . Кроме того, было показано, что ткани конструкции , сделанные с каркасов хорошо интегрированных в ткани хозяина , когда пересаживают в тяжелого комбинированного иммунодефицита (SCID) мышей. Добавки ретиноевой кислоты , фактор роста нервов , или нейротропин 3 индуцированные нервные розетки -подобные структуры по всей каркасов . Фактор роста нервов и нейротропин 3 индуцированной экспрессии нестина , маркер нейронных клеток-предшественников , а также формирование сосудистых структур . Чистая PLLA эшафот был подходящий носитель для минерализации в естественных человеческих ЭСК в SCID мышей.
Гемопоэтических стволовых клеток (ГСК)
Несмотря на почти три десятилетия обширных исследований в расширении HSC и самообновления , стабильной и надежной системы расширения для человеческого ГСК до сих пор не достигнуто . Это, вероятно, из-за чрезвычайной чувствительности верных ГСК к их немедленного микроокружения . Колебания в минуту в концентрациях цитокинов , напряжения кислорода , температуры и клеток - ECM взаимодействия достаточно, чтобы привести в движение необратимых дифференциации каскадов , которые приводят к истощению ГСК в культуре. Строма - и цитокины без расширения ГСК / кроветворных клеток-предшественников ( HPCS ) с использованием пористого Bio совместимого 3D эшафота был впервые описан Бэгли и др.
Строительные леса , изготовленные из тантала покрытием пористых биоматериалов ( TCPB матричных или сотовых ) представил микроархитектуру напоминающий трабекул костного мозга. Культура HPC костного мозга на TCPB в отсутствие цитокинов увеличения поддерживается фенотип предшественников и мультипотентность до 6 недель ;значительно более длительный период по сравнению их с культур, выращенных на фибронектина покрытием пластиковой посуды , костного мозга стромы совместных культурах и других 3D- устройств. В частности , культура на TCPB матрицы привело к 1,5 -кратному расширению чисел HPC следующее 1 недели в культуре и 6,7 - кратное повышение колониеобразующей способности следующих 6 недель в культуре.
Дополнение с низкой концентрации (нг / мл) фактор стволовых клеток и Flt 3 - лиганда , но не интерлейкин- 3 , заметно повышена эффекты TCPB матрицы в поддержании мультипотентности из HPCS . Использование низких концентраций цитокинов в экс естественных условиях расширения ГСК / HPCS имеет клиническую значимость , как это было показано , что воздействие этих клеток к высоким , нефизиологических уровней цитокинов перед трансплантацией уменьшает их способность привить в костном мозге. Улучшенный результат расширения наблюдался и для пуповинной крови , полученных CD34 клеток, культивированных + на TCPB эшафотах . Культура TCPB эшафот в течение 2 недель дали трехкратное увеличение числа ядерных клеток и в 2,6 раза увеличить в колониеобразующих единиц . Оба CD45 + и CD34 + клеток в три раза увеличилось количество . Кроме того, расширенные клетки были способны к прививке сублетального облучения , без ожирения с диабетом / SCID мышей.
Совсем недавно были исследованы эффекты поверхности с иммобилизованным адгезивных клеток пептиды и полипептиды по пролиферации и дифференцировки мозга очищенного CD34 + клеток крови . Фибронектин-ковалентно привитые на 3D поли ( этилен ) (ПЭТ ) нетканые эшафоты заметно улучшилось содержание CD34 + фенотипа , мультипотентность и без ожирения диабетической / SCID эффективности приживления культурного CD34 пуповинной крови + про- genitor клеток по сравнению с фибронектин -привитой двумерного эшафота или тканевых культур пластиковые элементы управления. Было высказано предположение, что иммобилизованные фибронектин синергисты с 3D топографии модифицированных эшафотов для создания биомиметических микросреду для распространения и обслуживания CD34 + . Очищенный шнур CD34 крови + ГСК , культивированные в восстановленной коллагена I фибриллы в присутствии Flt3 -лиганд , фактор стволовых клеток , и интерлейкин 3 в течение 7 дней в культуре, показало увеличение количества колониеобразующих единиц , хотя общий коэффициент расширения CD34 + клеток слегка ниже по сравнению с контрольными суспензионных культур , предполагая, что коллаген I эшафота выступили лучше на сохранение мультипотентность из CD34 + клеток . Экспрессия генов профилирования из культивируемых клеток показали позитивную регуляцию более чем 50 генов в присутствии коллагена I. Среди них гены нескольких факторов роста, цитокинов и хемокинов , (например, интерлейкин- 8 и макрофагов ингибиторный белок , а) были подтверждены с помощью количественного полимеразная цепная реакция . Кроме того, выше выражение отрицательного клеточного цикла регулятора BTG2/TIS21 и ингибитора митоген-активированной протеинкиназы пути, DUSP2 , подчеркивание регулирующую роль ЕСМ. Итак, эти данные показывают, что расширение CD34 + клеток пуповинной крови в системе культуры , содержащей 3D коллаген I матрицу вызывает качественное изменение в профиле экспрессии генов обрабатываемого ГСК.
Мезенхимальные стволовые клеток ( МСК )
Расширение мезенхимальных стволовых клеток.
Мезенхимальные стволовые клетки были тщательно изучены для ТЕ благодаря их способности дифференцироваться в остеогенные , хондрогенной и адипогенных тканей , которые являются основными целями для репаративной медицины. Кроме того, последние данные показали, их потенциал для нервной трансдифференцировки как в пробирке и в естественных , и для дифференцировки в клетки гладкой мускулатуры . Присоединение к тканевой культуры пластика был использован в качестве критерия для отбора МСК из других типов клеток в процессе их очистки от костного мозга и пуповинной крови. Хотя тканевой культуры пластик может поддержать обширную пролиферацию МСК , продолжающиеся усилия к тому, чтобы разработать оптимальную субстрат для расширения MSC . Клинически масштабное расширение МСК достижимо с помощью биореактора культуры.
MSC Дифференциация
Хотя мы узнали много нового о роли биологических факторов в стимулировании МСК дифференциации , играющая роль физической среды в этом процессе только появляются. Поверхностные химические одних только субстратов появляются достаточно , чтобы изменить дифференциацию МСК . Хотя немодифицированные и модифицированные Силановые поверхности поддерживается обслуживания MSC , - NH2 -и- SH -модифицированные поверхности способствует остеогенной дифференцировки , и -СООН - и -ОН- модифицированные поверхности способствует хондрогенный дифференциации. Механические сигналы, такие как локальных напряжений ( растяжение , сжатие, сдвиг) , геометрии, топографии и межклеточного контакта имеют прямое влияние на дифференциации МСК . Макбет и др. . продемонстрировали , что судьба МСК дифференциации могут быть изменены путем манипулирования форму клетки с использованием микрорисунком клейкую подложку . Насильственные сферическая морфология клеток привело к льготной адипогенной приверженности , тогда как сплющенная морфология индуцированных остеобластов обязательства. Форма клеток показано далее влиять на дифференцировку судьбу с помощью механики цитоскелета , скорее всего, преобразованных с помощью передачи сигналов RhoA .
Биоматериалы для остеогенной дифференцировки МСК
Широкий спектр биоматериалов был протестирован , чтобы использовать остеогенный потенциал МСК для костной ТЕ . Составляющие , имитирующие естественную кость часто были включены в биоматериала дизайна , чтобы стимулировать окостенения . Ионов кальция и фосфата , являются важными компонентами во время фазы минерализации процесса окостенения . Материалы , состоящие из фосфата кальция , такие как гидроксиапатит [НА ; Cа10 ( P04 ) 6 ( OH) 2] и трикальцийфосфат [TCP ; Са3 ( P04 ) 2] являются привлекательными кандидатами для замены костей. HA является естественным компонентом костей и прошел клинические испытания для ортопедических и пародонта приложений. HA покрытие было показано, улучшить исход протезирования имплантатов. Пористой керамики HA поддерживается остеогенез по МСК костного мозга в пробирке и в естественных условиях.
Ряд уникальных особенностей ГК способствовать его имущества остеокондуктивного . HA , как известно, сильно адсорбируют фибронектин и витронектин , лиганды для интегринов семейства рецепторов клеточной адгезии , которые играют ключевую роль в опосредовании адгезию МСК и остеобластов предшественников . Кроме того, при использовании в смеси с другими полимерами , HA частицы подвергаются на поверхности каркасов пользу фокусное контактную формирование остеобластов . Костно - минерального как пленка, состоящая в основном из апатита кальция , при введении на поверхность поли ( лактид-со- гликолида ) подложки , может достичь того же эффекта , что и при HA была включена в объемном материале . Считается также, что HA продукты разложения создать щелочную микросреду и обеспечить электролиты , необходимые для минерализации ECM остеобластами в процессе формирования костной ткани. Это микросреда затем набирает окружающие клетки приобрести остеобластов фенотип и принять участие в процессе окостенения .
Композиты ГК с другими полимерами были оценены как остеокондуктивные субстратов. Эшафот Фабри с лаборантом из композита , состоящего из HA / хитозана желатин способствует начальную адгезию клеток , поддерживает 3.3 раза выше насыщенность клетками и может поддерживать более высокую progenicity МСК по сравнению с только хитозана желатина . Двухфазные фосфата кальция керамика , состоящие из смеси НА и- трикальцийфосфат считаются более биологически активный и более эффективным , чем только HA для ремонта дефектов периодонта и некоторых ортопедических применений. Макропористая форма двухфазной фосфата кальция может способствовать формированию костной ткани и имеет скорость деградации совместимый с костью в кинетики роста . Минерализованные коллагеновые губки , изготовленные из сшитого коллагена -1 волокон , покрытых безкристаллической ГК улучшилось посева клеток и индуцированных остеогенный дифференциальное диференцирование человеческих МСК . Когда затравку фибриногена гидрогеля в поликапролактона -HA композитного эшафот , человека МСК дифференцированы эффективно в остеобласты под остеогенных средних условиях .
Другие формы фосфата кальция материала, содержащего которые были оценены для остеокондуктивности являются фосфат окта- кальция и- трикальцийфосфат . ткань конструкции различных конформаций в том числе двумерных клеточных листов и 3D блоков были достигнуты с крыс МСК , посеянных на Октакальцийфосфат кристально микро- строительных лесов . Макропористый- TCP была продемонстрирована для поддержки остеогенеза из человеческих МСК . Биологически активные стекловолокно обладают несколько характеристик привлекательным для костной ТЕ . Во-первых, они спонтанно инициирования осаждения ГК на их поверхности , что делает их остеокондуктивных . Во-вторых, их фибриллярная природа имитирует пористость костного материала и также фибриллярную организацию коллагеновых волокон , которые ортогонально распределенной в натуральной кости . Биологически активное стекло хорошо интегрировано с окружающей костной тканью при использовании в качестве дефекта наполнителей.
Композиты из биологически активного стекла с других биоразлагаемых полимеров, таких как фосфолипазы , способствовал формированию кристаллической ГК на поверхности , которой была благоприятной для распространения MSC и дифференциации в остеобласты . Компоненты Кость ECM глубоко влиять на активность МСК . Костного матрикса состоит в основном из фибронектин, коллаген типов I и IV, ламинин и сульфат гликозаминогликаны гепарин , хондроитин сульфат и гиалуронан . Последние данные свидетельствуют о том, что разные ответ МСК в различных 3D полимерных каркасов может быть определена путем адсорбционной способности полимера для различных компонентов ECM , присутствующих в культуральной среде. Например, поликапролактон посредником привязанность MSC в первую очередь через адсорбированного витронектин , в то время как ПМГК делает это через адсорбированнаый типа I коллаген. Включение этих компонентов в ТЕ каркасов костных предоставляет способ более точно контролировать поведение MSC. Эшафот , состоящие из гиалуроновой кислоты , одним из основных гликозаминогликанов найдено в костном ECM , были продемонстрированы модулирование экспрессии молекул , связанных с воспалительной реакции , а также , что из костного ремоделирования металлопротеиназ и их ингибиторов человеческими МСК . Этот вывод имеет существенное влияние на строительстве костных трансплантатов для клинического использования . Человеческие МСК культивировали на поли (3- гидроксибутирата ) ткань эшафотов , иммобилизованных с хондроитин сульфатом , отображается фенотип и экспрессию гена в соответствии с обширным остеогенеза . Соты коллагеновых каркасов , изготовленные из коровьего кожного ателоколлагена предоставил превосходную поверхность для распространения MSC и остеобластов дифференциации по сравнению с пластиковой контроля тканевой культуры .
Биоматериалы для хондрогенной дифференциации МСК
Обычные ТЕ хряща страдает от недостаточного количества аутологичных хондроцитов. Получение хондроциты от МСК стала привлекательной альтернативой. Широкий спектр природных и синтетических биоматериалов был исследован для хондрогенной дифференциации MSC. Несколько исследований описали использование природных полимеров, таких как шелк, целлюлоза, гиалуронана, гиалуроновая кислота, агарозы и морской губки волокна скелета. Кроме того, гибридные полимеры, состоящие из синтетических и природных полимерных смесей, или из различных природных полимеров и их производных, были протестированы. Например, (PLGA) - желатин/ хондроитин/ гиалуроната scaffold доказали свое превосходство в качестве носителя аутологичных МСК в восстановлении полной толщины дефектов хряща у кроликов по сравнению с PLGA scaffold. Cho и др. разработали инъекций термочувствительного гидрогеля из сополимера водорастворимого хитозана и поли (7v -изопропилакриламида) (WSC- г - PNIPAAm) для хондрогенной дифференцировки клеток человека MSC. При попадании в подслизистый слой мочевого пузыря кроликов, клетки, задержанные в сополимере, подвергались дальнейшему хондрогенезу и формировали ткани, напоминающие суставной хрящ, состоящий из смеси гиалиновые и волокнистого хряща и других компонентов тканей.
Electrospun поликапролактона нановолоконные scaffold оказалась интересным субстратом для хондрогенной дифференциации МСК. Ричардсон и др. продемонстрировали потенциал биоразлагаемого PLLA scaffold как chondroactive субстрата для МСК основе ТЕ межпозвоночных дисков. Они показали ранее, что контактное сокультивирование хондроцитоподобных клеток из пульпозного ядра человеческой межпозвонкового диска с МСК может набирать МСК дифференцироваться в студенистое ядро клеток. Го и др. сообщили об исправлении больших дефектов суставного хряща с имплантатами аутологичных МСК, засевая на « - ТСР scaffold в овечьей модели».
Нервные стволовые клетки (НСК)
У млекопитающих, взрослые нейроны теряют пролиферативный потенциал. Центральная нервная система, поэтому, имеет ограниченную способность к регенерации, когда нанесены повреждения, связанные с травмой, инсультом или в нейропатологических условиях. Клинические испытания с использованием трансплантации фетальных клеток головного мозга для лечения нейродегенеративных заболеваний, таких как болезнь Паркинсона, был поднят ряд вопросов, касающихся эффективности этой стратегии. Излечение неврологических травм в центральной нервной системе осложняется наличием природных ингибиторов регенерации нерва, особенно аксонов ингибитора роста миелин-ассоциированный гликопротеин. Таким образом, множество терапевтических стратегий для устранения повреждения спинного мозга ориентированы прежде всего на создания среды для регенерации путем захвата этих ингибирующих белков.
Периферическая нервная система сохраняет ограниченные возможности для самостоятельного исправления если травмы малы. Большие повреждения, однако, требуют нервных трансплантатов обычно собранных из других частей тела. ТЕ, используя НСК, обеспечивает жизнеспособную и практическую альтернативу для клеточной терапии центральной нервной системы и периферической нервной системы. Тем не менее, существует острая потребность в технологии, чтобы расширить НСК в больших масштабах, чтобы их использования в клинике стало обычным. В головном мозге млекопитающих, NSCs происходят из двух конкретных мест, субвентрикулярной зоны и зубчатой извилине области гиппокампа. Опыт показывает, что НСК широко распространены во взрослом мозге (рис. 6.12). Кроме того, перепрограммирование олигодендроцитов прекурсоров и астроцитов также могут привести к мультипотентным НСК. В последнее время, руководимая дифференциация эмбриональных клеток и МСК в нейронных линий стала альтернативным источником клеток для нервной ТЕ и исследованиям в области нейронаук.
 Пионерские
работы по крупномасштабной культуре
человеческих НСК проводили в подвесных
биореакторах. Тем не менее, питательные
вещества и перенос кислорода ограничить
размер агрегатов NSC, известных как
нейросферах, которые образуются в
суспензионных культурах. Распространение
НСК в статических культурах была
достигнута в присутствии основного
фактора роста фибробластов и / или
эпидермального фактора роста, но
пассирования клеток необходимость
непрерывную механическую диссоциацию
нейросферах. Многие хирургические
процедуры для лечения поражения головного
мозга, таких как опухоли и сгустки крови,
в результате удаления части объема,
создаются полости, которые в идеале
должны быть заполнены, если желательно
восстановление целостности нейронов.
Кроме того, нейродегенеративные
заболевания и гипоксическо-ишемической
травмы приводят к некротическим
изменениям и / или формированию рубца,
что закупоривает нормальные когнитивные
и моторные функции. Восстановление этих
функций потребует замены некротических
или рубцовых тканей со здоровыми
клетками, футуристическая концепция,
известная как реконструктивной хирургии
мозга.
Пионерские
работы по крупномасштабной культуре
человеческих НСК проводили в подвесных
биореакторах. Тем не менее, питательные
вещества и перенос кислорода ограничить
размер агрегатов NSC, известных как
нейросферах, которые образуются в
суспензионных культурах. Распространение
НСК в статических культурах была
достигнута в присутствии основного
фактора роста фибробластов и / или
эпидермального фактора роста, но
пассирования клеток необходимость
непрерывную механическую диссоциацию
нейросферах. Многие хирургические
процедуры для лечения поражения головного
мозга, таких как опухоли и сгустки крови,
в результате удаления части объема,
создаются полости, которые в идеале
должны быть заполнены, если желательно
восстановление целостности нейронов.
Кроме того, нейродегенеративные
заболевания и гипоксическо-ишемической
травмы приводят к некротическим
изменениям и / или формированию рубца,
что закупоривает нормальные когнитивные
и моторные функции. Восстановление этих
функций потребует замены некротических
или рубцовых тканей со здоровыми
клетками, футуристическая концепция,
известная как реконструктивной хирургии
мозга.
Успешное осуществление и включение НСК для клеточной заместительной терапии мозга распространилось на использовании подходящего материала-носителя. Кроме того, устранение разрыва спинного мозга или периферических нервов с инженерных трансплантатов будет зависеть от правильного выбора идеального канала для нерва для преодоления места повреждения. Из различных видов биоматериалов рассасывающиеся полимеры представляются наиболее подходящими кандидатами для выполнения этих ролей. Обнадеживающие результаты нескольких исследований внушили оптимизм по поводу потенциала нервной ТЕ в клинической практике. Использование биоразлагаемой смеси 50:50 PLGA и блок-сополимера PLGA - полилизином, Дэн и др. сфабриковали дыухслойный scaffold с наружной и внутренней микроархитектурами имитирующие белое и серое вещество спинного мозга, соответственно. Внутренний слой засевали НСК и конструкцию вводили в поперечном направлении неполного повреждения спинного мозга крысы.
Животные с имплантированной конструкцией scaffold - НСК отображается улучшенное восстановление задних конечностей опорно-двигательного аппарата по сравнению с пустой scaffold и стволовыми клетками. Восстановление было связано с сокращением потери ткани от процессов вторичного повреждения, уменьшения глиальных рубцов и, в определенной степени, восстановление поврежденных аксонов через построение поддерживаемого scaffold - НСК. Интересной находкой было то, что имплантированный поли (гликолид) на основе конструкция scaffold - НСК может установить двунаправленное взаимодействие обратной связи с мозгом во взаимном порядке в качестве посредника в устранении в участке ишемии. Стоит отметить, что новый самосборки пептид нановолокна scaffold имплантирован в одиночку, без клеток груза может поддержать регенерацию аксонов через сайт острой травмы мозга и может восстановить функцию нейронов в повреждении зрительного тракта на животных моделях. Самосборки пептид нановолоконные scaffold, функционализированные с высокой плотностью нейритов, способствующих ламинина эпитопа, IKVAV, может быстро индуцировать дифференцировку семенами нейронных клеток-предшественников в нейронах, но в то же время подавить развитие астроцитов. В другом исследовании на крысах нервные клетки -предшественники, захваченные в 3D- матрицы коллагена быстро расширяются и спонтанно дифференцируются в образованных возбудимых нейроны и синапсы. Пористые матрицы пены получали из поли (стирол / дивинилбензол), используя высокие содержания внутренней фазы эмульсии шаблонов и покрытых поли (D -лизин) или ламинин, способствовал рост аксонов из клеток, полученных нейронов человека тератокарциномы.
Эндотелиальная клетки-предшественники
Neovasculogenesis или образование кровеносных сосудов постнатально, в настоящее время относится главным образом к деятельности эндотелиальных клеток-предшественников (ЕРС). С тех пор как их выделение из мононуклеарных клеток периферической крови было впервые сообщено,что ЕРС были идентифицированы из различных источников, включая костный мозг, пуповинную кровь, стенки сосудов и печени плода. Представитель EPC популяции в костном мозге является естественным резервуаром клеток, которые могут быть быстро мобилизованы после серьезного сосудистого повреждения. Потенциал применения ЕРС для терапевтического васкулогенеза широко признается. Прямое вливание эндотелиальных стволовых клеток / клеток-предшественников из различных источников для новых сосудов было оценено широко в доклинических и клинических исследований. Ранние стратегии развития сосудистых протезов, ориентированные на поставку ангиогенных факторов роста, таких как фактор роста эндотелия сосудов, фактор роста фибробластов -2 и ДНК, кодирующей эти факторы, чтобы вызвать рост микрососудов от хозяина на месте. В пробирке предварительно эндотелизации была высказана гипотеза, о создании антитромбогенного барьера для устройств, тем самым предотвращая окклюзию тромбом. Искусственные трансплантаты засевали дифференцированными эндотелиальными клетками (ECS) или ЭК в сочетании с другими типами клеток, таких как клетки гладких мышц.
Благодаря их недифференцированному состоянию, ЕРС сохраняют потенциал, чтобы реконструировать и интегрироваться в месте, в которое они пересажены. Kaushal и его коллег имплантировали трансплантаты, построенные из бесклеточного матрикса подвздошных сосудов автоматизируемых с ЕРС в модели овец. EPC - посеян трансплантаты остался патент на 130 дней, в то время как nonseeded трансплантаты окклюзии в течение 15 дней. Кроме того, эксплантированной EPC трансплантаты выставлены сократительную активность и оксида азота опосредованной релаксации сосудов, которые были похожи на нативные артерии. ЕРС также применялись в просвете для эндотелиализации малого диаметра металлических стентов. В вариантах эксперимента, ЕРС были использованы для поверхностной эндотелизации целых металлических стентов, покрытых слоем фотореакционноспособного желатина или эндотелизации трансплантата совместимой малого диаметра, изготовленного из микропористого сегментированного полиуретана и покрытого фотореакционноспособного желатина. EPC слой отображает антитромбогенные свойства, аналогичные пожилым ЭК. Совместимые трансплантаты малого диаметра EPC - endothelialized, отлитые из коллагена типа I и укрепленные с сегментированной полиуретановой пленки, остался патент на срок до 3 месяцев в собачьей модели имплантации.
Живая ткань патчи, включающая пупочные миофибробласты мозга и ЕРС высевали на поли (гликолида) / P4HB сетки scaffolds были сфабрикованы для потенциального применения в педиатрической сердечно-сосудистой патологии. Фибриновое покрытие из полимерных каркасов, как было показано способствует прикрепление ЕРС. Зрелые ЭК происходят от костного мозга ЕРС также были изучены для эндотелизации сосудистых трансплантатов. Последние методы scaffold изготовления, в частности выровнено, коаксиальный электропрядения проводит наиболее многообещающими в инженерии сосудистых трансплантатов. В дополнение к обеспечению текстурной поверхности идеально подходит для прикрепления клеток и выравнивание, комбинации полимеров могут быть выбраны резюмировать вязкоупругие свойства натуральных сосудов, а также избирательно стимулировать рост ЕРС и клеток гладкой мускулатуры, чтобы генерировать более биомиметических трансплантатов.
Эмбриональные зародышевые клетки, полученные из начальных половых клеток
Человеческие эмбриональные зародыши (EG) - потенциальная альтернатива ESCs как источник плюрипотентных стволовых клеток для терапии клетки и регенеративной медицины. EG клетки получают путем адаптации первичных половых клеток, чтобы выжить и самообновиться в культуре. Несмотря на более низкое этическое принятие EGs вследствие их спорного происхождения и трудности обслуживания скважины определил, например, линии в пробирке, есть доказательства, чтобы предложить, чтобы они следовали различной эпигенетической программе, чем ESCs, и это может подчеркнуть их важность как альтернативный источник стволовой клетки в будущем. До сих пор, только ограниченное число, исследования изучали возможности использования огибающих для ТЕ. Йим и Леонг сообщил свидетельство нейронов дифференциации EG- производных ЭТ культивировали на ацетат целлюлозы нановолокнистого scaffold поверхности украшенной фактора роста нервов.
Культура на биоразлагаемых scaffold, состоящий из поли (эпсилон- капролактон-со -этил этилена фосфат) и неизмененном ацетат целлюлозы, привели к усиленной пролиферации ЭТ. Расширенная культура (10 месяцев) на двух каркасах, полученных клеточных результатов, с ЭТ культивировали на поли (ε- капролактон-со -этил этилен фосфата) scaffold секретирующих обильное количество внеклеточного матрикса, показывая понижающую регуляцию экспрессии нейральных маркеров. Это исследование подчеркнул тот факт, что архитектура и способность к биологическому разложению каркасов играет важную роль в определении судьбы EG клеток в культуре клеток.
Стволовые клетки, полученные из жировой ткани
Полученных из жировой ткани стволовые клетки (ADSCs) дисплей почти такой же, как поверхностных маркеров костного мозга, полученных МСК, за исключением присутствия VLA- 4 выражения и отсутствия экспрессии его рецепторов, CD 106. В соответствии с этой фенотипической схожести, два типа клеток обладают почти неотличимой дифференциальной программой. При подходящих условиях культуры ADSCs дифференцируются вдоль классических мезенхимальных происхождений, а именно, адипогенеза, хондрогенеза, остеогенез, и миогенеза. Интерес к ADSCs состоит прежде всего в их потенциал в качестве альтернативы МСК костного мозга. Хотя они происходят на частотах, сопоставимых с их коллегами костного мозга, протокол экстракции ADSCs считается менее инвазивным, чем для урожаев костного мозга. Кроме того, эти клетки могут оказаться полезными при лечении состояний, связанных с недостаточности костного мозга.
Возможность ADSC дифференцироваться вдоль различных происхождений, когда отобрано в полимерные scaffolds, была оценена и в пробирке и в естественных условиях. В попытке найти минимальную последовательность ламинином достаточной для продвижения привязанности ADSC на ТЕ scaffolds, Сантьяго и др. ковалентно иммобилизованным RGD, YIGSR и IKVAV пептидных последовательностей на поликапролактонтриола поверхности. ADSCs, как находили, придерживались наиболее страстно IKVAV-измененной поверхности. ADSCs культивировали на каркасах, образованных агломерацией частиц хитозана, показали доказательство остеогенного и хондрогенного дифференцирования. Герметизация в гидрогелях агарозы и scaffolds желатина была разрешающей для хондрогенного дифференцирования ADSCs, ADSCs, отобранный в scaffolds НА/TCP или в коллаген/HA-TCP сложной матрице, показал категорический остеогенез, когда внедрено в мышей SCID. В бок о бок сравнении с костным мозгом MSCs, ADSCs в atelo-коллагене, сотовидной формы или (3-TCP scaffolds не показали различимых различий в остеогенном дифференцировании или в пробирке или, когда внедрено в нагих мышей.
Жировая ТЕ помощью ADSCs в настоящее время рассмотрены в качестве жизнеспособной альтернативной стратегии в пластик, корректирующей и реконструктивной хирургии. Испытания используя зрелую взятую у той же особи жирную ткань только встретились с ограниченным успехом из-за всасывания ткани и следующей кальцификации. Отягощающим фактором является то, что зрелые адипоциты неизлечимо дифференцированы и постмитотические. ADSCs предположил обойти некоторые из этих недостатков. Исследования на животных предоставили чек, подтверждающий факт концепции такого подхода. В естественных условиях адипогенеза был продемонстрирован с внедренным ADSCs, отобранным в коллагене, гиалуроновой кислоте, фосфолипазе, PLGA и фосфолипазе /поли (glycolide) сложные scaffolds. Консенсус из этих исследований является то, что полимерный каркас выгодно для формирования жировой ткани от имплантированных ADSCs. В дополнение к классическим мезенхимальным происхождениям ADSCs, как показывали, были способны к пересечению границ связанных с развитием и трансдифференцировались в скелетную мышцу, кардиомиоциты, нейроны и ECs. Хотя некоторые из этих клеток были протестированы в каркасных без клеточной терапии, их использование в биоматериалах на основе ТЕ предлагает участки для разведки.
Другие стволовых/клетки-предшественники с потенциалом для ТЕ -приложений
Ряд недавно выявленных стволовых клеток/клеток-предшественников предоставляет интересные темы для исследований и вероятные кандидаты на орган-специфические ТЕ. Недавний доклад изоляции человесческих почечных клеток-предшественников из взрослых почек готовит к запуску новую ветвь ТЕ. Терминальной стадией почечной недостаточности является катастрофическое заболевание, обычно приводящее к смерти. Традиционные методы лечения, такие как пересадка почки и гемодиализ имеют серьезные ограничения и часто связываются со значительной заболеваемостью. Хотя идея тканевой инженерии почки не нова, использование почечных стволовых клеток может позволить строительство нового органного De Novo, а также для перспектив создания аутологичных органов.
Микропористые scaffolds и внедрение микрожидких технологий могли быть предусмотрены, чтобы взять на себя инициативу в этой области. ТЕ из функциональной поджелудочной железы была область интенсивного исследования в течение нескольких десятилетий. Мультимощные взрослые клетки - предшественники поджелудочной железы, идентифицированные недавно, обеспечат импульс, чтобы сделать эту цель достижимой в ближайшем будущем. Другая недавно обнаруженная основа/клетки - предшественники, которые расширили клеточный арсенал для регенеративной медицины, включает печень, относящуюся к сетчатке глаза, скелетную мышцу, волосяной фолликул и стволовые клетки мякоти дентина.
ПРОБЛЕМЫ СТВОЛОВЫХ КЛЕТОК
Несмотря на оправданный оптимизма, несколько основных проблемы остаются и должны быть разрешены.
• Прежде всего, это проблема массового транспорта клеточных элементов в ткани. Любой ТЕ модален, стремящийся к клиническому распознаванию и васкуляризации. Это препятствие в настоящее время рассматривается как ограничивающий фактор к количеству клеточных элементов, которые реально могут быть достигнуты. Поставка питательных веществ и кислорода к клеткам, расположенных глубоко в объемной ткани или сложных органов должны быть решены для того, чтобы им поддерживать в организме в течение любого вида продолжительности. Тромбообразующий окклюзия microconduits или микропоры , введенных в биоматериала конструкций является общей проблемой сталкиваются в решении этого ограничения . Включение антитромбогенных молекул в биоматериалов является одним из стратегий, используемых для преодоления проблемы . Кроме того, ангиогенные факторы могут быть включены в биоматериалов , чтобы вызвать De Novo васкулогенез и / или ангиогенез от тканей, окружающих имплантаты. Спонтанное развитие сосудов наблюдается при определенных условиях , например, в человеческом ESC ЭТ , растущих в суспензионных культур придает надежду преодоления этой проблемы.
• Еще одной проблемой является требование к иннервации . На самом деле, это требование стало главным препятствием в развитии имплантируемого гибридной печени устройство помощи . Печень богато иннервируется как через симпатической и парасимпатической путей от гипоталамуса и надпочечников , которые регулируют такие функции, как кровотока через печеночных синусоидов , растворенного обмена и функции паренхимы . Иннервация требуется также других органов , таких как мышцы , легочной системы , почек и эндокринных желез . Таким образом, выбор биоматериалов и дизайн ткани конструкции для ремонта этих систем органов придется учитывать положение о иннервации .
• Системы органов не состоят из однородной типа клеток , асборка различных типов клеток либо приобщенных вместе или разбивается на дискретные sublocations . Каждый из этих типов клеток может иметь уникальные требования субстрата. Проектирование сложных органов будет , поэтому , нужно , чтобы угодить каждой компо Nent типа клеток. Задача по-прежнему , чтобы найти правильный баланс между биологическими и физическими свойствами каркасного материала , чтобы удовлетворить каждого типа клеток . В этом отношении ТЕ с использованием стволовых клеток имеет очевидные преимущества , так как пластичность клеток может позволить де ново формирования тканей в зависимости от каркасного композиции. В месте реконструкции на границе между различными типами клеток , сродни событиям, которые происходят между зародышевых листков во время эмбриогенеза , может привести к новым тканям. Это может теоретически ослабить строгость без точной субстрата .
Создание соответствующих моделей заболеваний для оценки эффективности инженерных конструкций ткани так же важно, как преодоление инженерных препятствий. Часто , мелкий грызун модели с механическим или фармакологически индуцированной поражения не точно воспроизводят условия человеческой болезни , в результате чего разрозненные результаты между доклинических и клинических испытаний. Приматов модели могут в теории, обеспечить наиболее релевантные животных моделей , но они не всегда доступны для практических и этических соображений . Создание нечеловеческий был предложен приматов модели для различных заболеваний человека , направляя генов и переноса ядра . Тем не менее, клонирование обезьян остается неудачной на сегодняшний день. Успех в этой области может положительно отразиться на сотовый ТЕ стволовых .
ПРИМАТОВ МОДЕЛИ
Использование человеческих эмбрионов для получения эмбриональных стволовых клеток ( ЭСК ) рассматривается некоторыми секторами нашего общества в этически проблематичной. В приматов , в настоящее время три метода получения плюрипотентных стволовых клеток : из эмбрионов , полученных путем:
1 . Экстракорпоральное оплодотворение
2 . партеногенез
3 . Взрослые тканей, таких как клетки, полученные из костного мозга .
Наконец поле ТЕ вступил новый захватывающий глава, где экспериментальные технологии, которые активно изучаются для клинической перевод , означающий настоящим " зрелого возраста " поля . Конвергенция двух важных дисциплин, что из биоматериалов техники и исследования стволовых клеток , обещает революционизировать регенеративную медицину . Это слияние , несколько концепций , которые были бы сочтены надуманными несколько лет назад, сейчас активно ведется . Среди этих концепций мозг реконструктивной хирургии, индивидуальные аутологичных запасные части тела , и кибернетическое протез . Будущее стволовых клеток ТЕ , несомненно, технологически обусловленный . Новые приложения и усовершенствованием существующих конструкций будет сильно on4innovations зависит в биоматериалов техники. Одновременно с этим, прогресс в биологии стволовых клеток будет необходимо в диктовать достижения в стволовых клеток ТЕ . Лучшее понимание молекулярных механизмов, посредством которых субстрат взаимодействия влияние стволовых клеток самообновлению и дифференциация имеет первостепенное значение для целевой дизайна биоматериалов . Открытия в области развития - психического биологии и функциональной геномики также должны быть превратившая для расширения репертуара биологических молекул , которые могут быть включены в биоматериалов для тонкой настройки деятельности стволовых клеток . С слияния инженерии два мощных дисциплин биоматериалов и клеточной биологии - новый чертежную доску стволовых сейчас лежит перед нами , чтобы разработать методы лечения, которые , как можно надеяться помочь возраст мирового населения более изящно .
ТКАНЕВАЯ ИНЖЕНЕРИЯ И ХАРАКТЕРИСТИКА
Хрящ тканевая инженерия
Б ольшинство
тканей требуют достаточно развитой
сосудистую систему , чтобы кислорода и
питательных веществ . Это делает ткани
трудно инженера , так как они могут
погибнуть в теле пациента , прежде чем
они могут развивать кровоснабжение.
Суставной хрящевой ткани , однако, не
требует кровоснабжение , приобретая
свои питательные вещества и кислород
путем диффузии с его поверхности .
Имплантированных хряща делает, поэтому
, как правило, хорошо выживают в пациента
(рис.
6.13 )
.
ольшинство
тканей требуют достаточно развитой
сосудистую систему , чтобы кислорода и
питательных веществ . Это делает ткани
трудно инженера , так как они могут
погибнуть в теле пациента , прежде чем
они могут развивать кровоснабжение.
Суставной хрящевой ткани , однако, не
требует кровоснабжение , приобретая
свои питательные вещества и кислород
путем диффузии с его поверхности .
Имплантированных хряща делает, поэтому
, как правило, хорошо выживают в пациента
(рис.
6.13 )
.
Хрящ также клинически важных тканей , так как он не восстановиться после травмы, и его ухудшение связано с изнурительных болезней старости , таких как артрит , который является растущее беспокойство в развитых странах мира . Хрящ происходит в трех типов в организме :
Эластичный хрящ , пример которого находится в ушах.
Гипертрофическая хрящ заложены в качестве шаблона для роста костей , и это может служить полезным ткани предшественника к кости (который требует хорошего кровоснабжения ) в тканевой инженерии подходы к ортопедии . Ведутся исследования - пути в Шеффилде , чтобы оценить этот подход к инженерии костной ткани для реконструктивной хирургии .
Гиалиновый хрящ находится в бок , носовой перегородки и покрытия кости концы суставов , таких как колени и бедра В суставах хрящ известен как суставного и имеет жизненно важное значение для смягчения и смазки поверхностей.
Исследования в Шеффилде была сосредоточена на оценке ячейку биологии инженерии хряща, разработаны с использованием множества различных строительных лесов и питательной среды, и сравнивают это с натурального материала. Основной тип клеток в хряща является хондроцитов, это специализированное клеток, которые могут выдержать сжатие и поперечных сил в коллагеновой матрице.
Г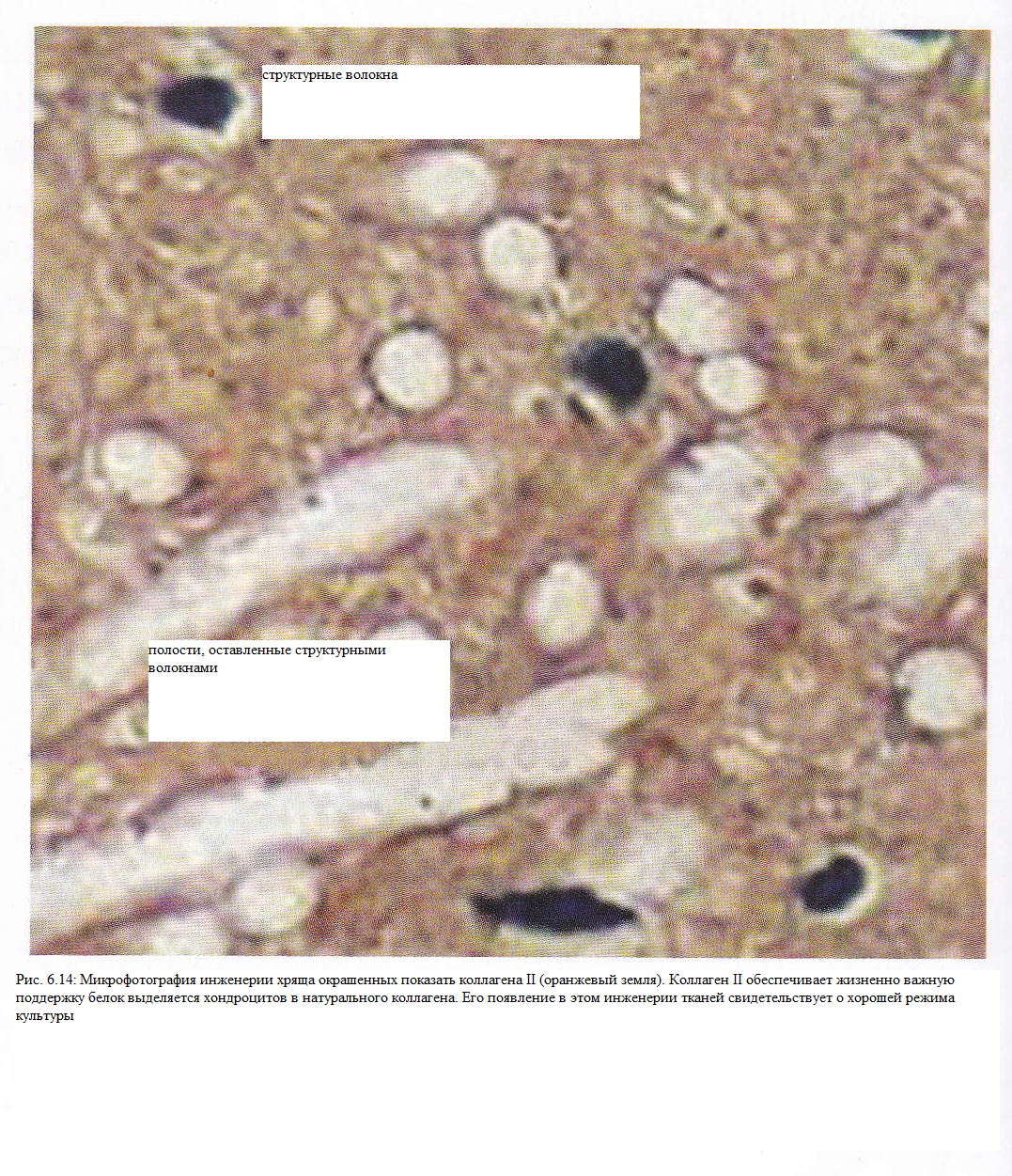 истологические
исследования показали, что хондроцит
встроен в зоне специализированной
матрицы, образуя chondron. Эта структура
имеет важное значение для за выживание
клетки в условиях нагрузки и напряжения
сдвига. Исследования показали, что
больные артритом (хондроциты) развивать
пониженную chondron, и, следовательно, более
подвержены повреждению (рис.
6.14).
истологические
исследования показали, что хондроцит
встроен в зоне специализированной
матрицы, образуя chondron. Эта структура
имеет важное значение для за выживание
клетки в условиях нагрузки и напряжения
сдвига. Исследования показали, что
больные артритом (хондроциты) развивать
пониженную chondron, и, следовательно, более
подвержены повреждению (рис.
6.14).
Инженерии костной ткани
Исследователи Шеффилде преследуют две основные стратегии для решения проблем, возникающих в связи с необходимостью инженер
Т кань
для восстановления костей . Работа с
местной компанией ( Ceramisys ООО ) , мы
оцениваем пористых фосфат кальция
керамики для использования в качестве
поддержки клеток и лесов для инженерии
костной ткани . Пористой керамики
высевают . Vith мезенхимальные стволовые
клетки из костного мозга и культивируют
в остеогенных условиях. Полученные
конструкции оцениваются с использованием
целого ряда методов, включая гистологии,
электронной микроскопии и microCT (в
сотрудничестве с Ральфом Мюллером в
Цюрихе в рамках проекта EXPERTISSUES) (рис.6.15)
. Исследователи также изучают потенциал
гипертрофированных хондроцитов
генерировать ткани инженерии конструкцию
для восстановления костей . Этот подход
является привлекательным как
гипертрофированные хондроциты способны
выжить с относительно небольшим кислорода
(гипоксия) , таких как места повреждения
или раны кровати.
кань
для восстановления костей . Работа с
местной компанией ( Ceramisys ООО ) , мы
оцениваем пористых фосфат кальция
керамики для использования в качестве
поддержки клеток и лесов для инженерии
костной ткани . Пористой керамики
высевают . Vith мезенхимальные стволовые
клетки из костного мозга и культивируют
в остеогенных условиях. Полученные
конструкции оцениваются с использованием
целого ряда методов, включая гистологии,
электронной микроскопии и microCT (в
сотрудничестве с Ральфом Мюллером в
Цюрихе в рамках проекта EXPERTISSUES) (рис.6.15)
. Исследователи также изучают потенциал
гипертрофированных хондроцитов
генерировать ткани инженерии конструкцию
для восстановления костей . Этот подход
является привлекательным как
гипертрофированные хондроциты способны
выжить с относительно небольшим кислорода
(гипоксия) , таких как места повреждения
или раны кровати.
Пародонта тканевая инженерия
П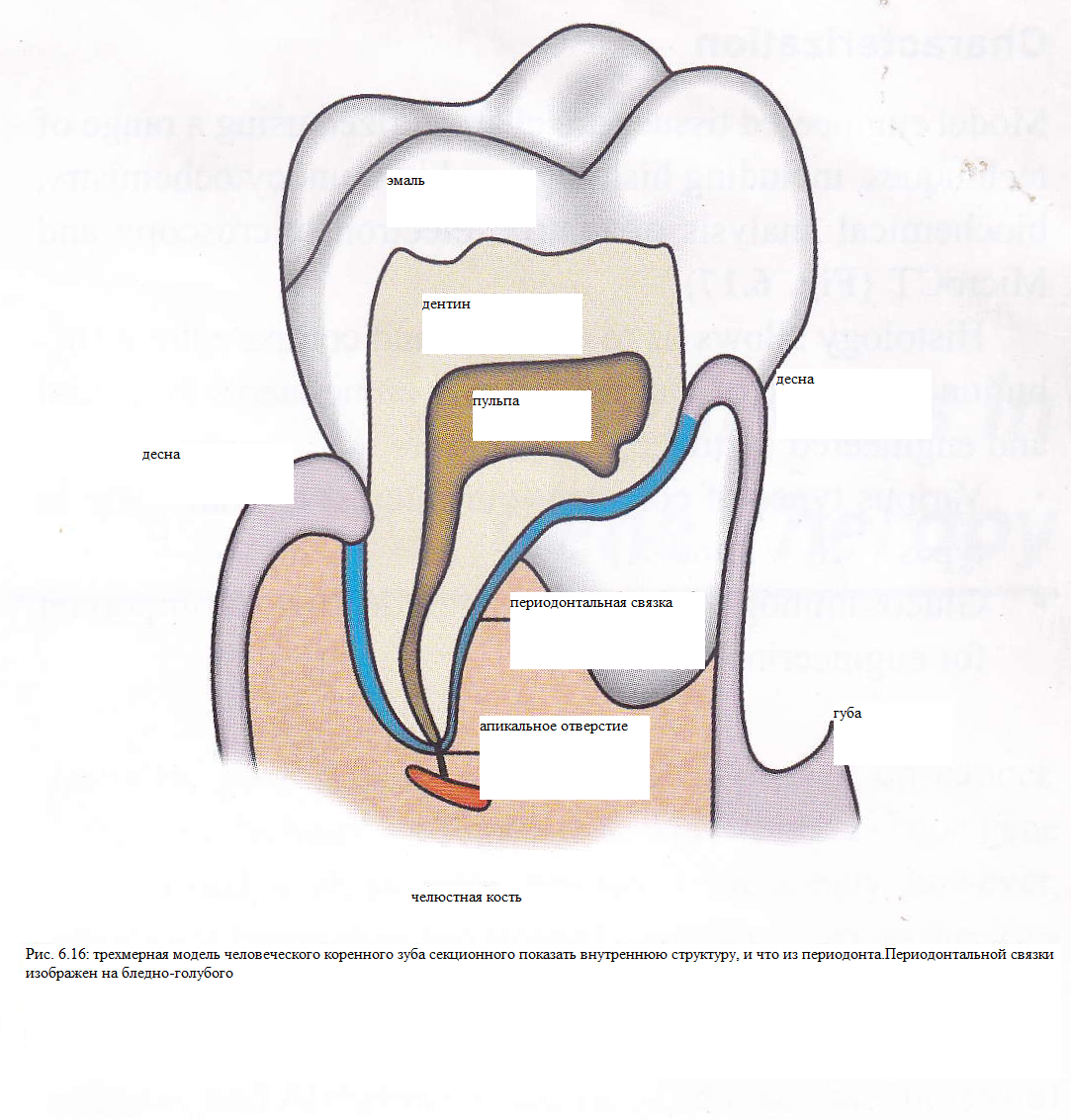 ериодонтальной
связки образует оболочку о корня зуба
. Он действует как амортизатор , а также
проведение зуб твердо на месте . В связи
с эмбрионального развития корня зуба
, однако, клетки в периодонтальной связки
не могут регенерировать (рис.
6.16 )
.
ериодонтальной
связки образует оболочку о корня зуба
. Он действует как амортизатор , а также
проведение зуб твердо на месте . В связи
с эмбрионального развития корня зуба
, однако, клетки в периодонтальной связки
не могут регенерировать (рис.
6.16 )
.
Как следствие связка изнашивается со временем в процессе хронического peridontitis , наиболее распространенной причиной потери зубов , хотя она не часто проявляться до дальнейшей жизни. Исследование направлено на регенерацию утраченной соединительной ткани на рос большое количество связок клеток и пересадкой .
Обычно культивируемые клетки должны придерживаться поверхности , чтобы выжить и продолжить развитие . Если только представлены стволовые клетки.
Х арактеристика
арактеристика
Модель спроектирована ткани характеризуются использованием целого ряда методов, включая гистологии и иммуноцитохимии , биохимического анализа матрицы , электронной микроскопии и MicroCT (рис. 6.17 ) .
Гистология позволяет нам изучить и сравнить распределение целого ряда компонентов матричных индикаторов в натуральном и инженерии хряща , например :
• Различные типы коллагена ( наш интерес в основном в типов I, II, VI и X ) '
• глюкозаминогликанов и минеральные отложения , важно для инженерной кости
• Поверхностные ферменты, такие как щелочной фосфатазы , которая сильно выраженной остеоцитов и гипертрофических хондроцитов "
• Рецепторов клеточной поверхности , например, CD44 , экспрессия которого является мерой клеток продолжающейся полезности для клинических процедур.
Количественный биохимический анализ позволяет оценить абсолютные объемы гликозаминогликанов , и в режиме реального времени метод ПЦР позволяет нам изучить уровни экспрессии для матричных компонентов, таких как aggrican , коллагена I и II.
MicroCT ( microcomputed томография ) является полезным методом для измерения размеров пор и проницаемость твердых носителях для кости.
