
Билет № 1
Строение атома
Модель строения атома: 1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома. 2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре. 3. Ядра атомов состоят из протонов и нейтронов (нуклонов). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов и нейтронов соответствует его массовому числу. 4. Вокруг ядра по замкнутым орбитам вращаются электроны. Их число равно положительному заряду ядра.
Ядро - это центральная положительно заряженная часть атома, в которой сосредоточена его масса. Электрон - частица с отрицательным зарядом, который условно принят за -1. Нейтрон - нейтральная частица, не имеющая электрического заряда. Масса нейтрона равна 1 а. е. м. Протон - положительно заряженная частица, с такой же массой, как и нейтрон. Заряд протона равен заряду электрона и противоположен по знаку. Число протонов в ядре атома равно числу электронов. Это число определяет заряд ядра атома элемента и его порядковый номер элемента в таблице Менделеева.
Понятие о квантовой механике
Квантовая механика - раздел теоретической физики, описывающий квантовые системы и законы их движения.
Под квантовой механикой понимают физическую теорию динамического поведения форм излучения и вещества. Это теоретическая основа, на которой построена современная теория атомных ядер, атомов, физических тел, молекул и элементарных частиц. Вообще, квантовая механика была создана учеными, которые стремились понять строение атома. В течении многих годов легендарные физики изучали особенности и направления химии и следовали историческому времени развития событий.
Двойственная природа электрона
Двойственность свойств электрона проявляется в том, что он, с одной стороны, обладает свойствами частицы (имеет определенную массу покоя), а с другой - его движение напоминает волну и может быть описано определенной амплитудой, длиной волны, частотой колебаний и др. Поэтому нельзя говорить о какой-либо определенной траектории движения электрона - можно лишь судить о той или иной степени вероятности его нахождения в данной точке пространства.
Следовательно, под электронной орбитой следует понимать не определенную линию перемещения электрона, а некоторую часть пространства вокруг ядра, в пределах которого вероятность пребывания электрона наибольшая. Иными словами электронная орбита не характеризует последовательность перемещения электрона от точки к точке, а определяется вероятностью нахождения электрона на определенном расстоянии от ядра.
Волновая функция
Шредингер, основываясь на постулате Де Бройля (Любая движущиеся частица обладает волновыми свойствами и может быть охарактеризована длиной волны и частотой), принципе неопределенности Гейзенберга (Невозможно одновременно с высокой степенью точности устанавливать координаты местоположения и величину скорости движения микрочастицы, для которой присущи корпускулярно-волновые свойства) и законе сохранения энергии электрона (е) в атоме составил уравнение и решил его для простейшего атома H. Решениями уравнения Шредингер являются энергии е в атоме и "волновые" функции, зависящие от координат. Волновая функция (ψi) не имеет определенного физического смысла, но квадрат волновой функции (ψi2) - это плотность вероятности нахождения е в точке с координатами (x,y,z) или плотность отрицательного заряда электронного облака в данной точке ψi2∙ dV - вероятность нахождения e в объеме dV.
Требования: волновая функция непрерывная, однозначная, ограниченная.
В результате точного решения уравнения Шредингера оказалось, что каждой волновой
функции соответствует набор 3х целочисленных параметров - n, l, m –
квантовых чисел. Шредингер рассчитал вероятность (W) нахождения е на
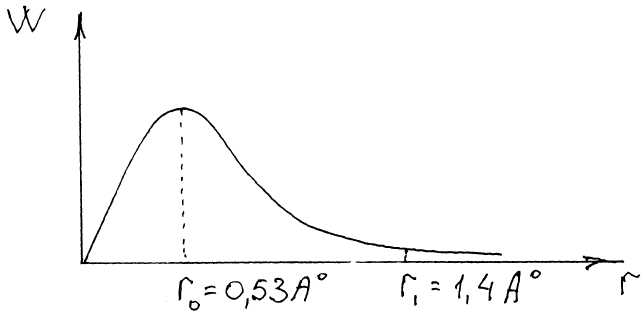 расстоянии
r от ядра в основном состоянии атома
водорода или, иначе,
расстоянии
r от ядра в основном состоянии атома
водорода или, иначе,
распределение электронной плотности в атоме водорода в основном состоянии.
