
- •Фізична хімія
- •1 Хімічна термодинаміка
- •1.1 Застосування 1-го закону термодинаміки. Теплові ефекти ізобарних та ізохорних процесів
- •1.1.1 Розрахунок теплового ефекту хімічної реакції за стандартних умов
- •1.1.2 Зв’язок між тепловими ефектами при постійному тиску і об’ємі Qp і Qv (δн і δu)
- •1.2 Теплоємність
- •1.2.1 Зміна теплоємності речовини з температурою
- •1.2.2 Визначення середньої теплоємності в заданому інтервалі температур
- •1.2.3 Розрахунок теплоємності в результаті перебігу хімічного процесу за стандартних умов
- •1.2.4 Розрахунок теплового ефекту хімічної процесу при будь-якій температурі
- •1.2.5 Залежність теплоти фазових переходів від температури
- •1.3 Другий закон термодинаміки та його застосування до фізико-хімічних процесів
- •1.3.1 Зміна ентропії в фізичних процесах
- •1.3.2 Абсолютна ентропія
- •1.3.3 Розрахунок зміни ентропії при перебігу хімічного процесу за стандартних умов
- •1.3.4 Зміна ентропії хімічного процесу при температурі, що відрізняється від стандартної реакції
- •1.4 Термодинамічні потенціали. Критерії напрямку самочинних процесів
- •1.4.1 Зміна ізобарно-ізотермічного потенціалу в хімічному процесі
- •1.4.2 Розрахунок хімічного процесу при будь-якій заданій температурі
- •2 Хімічні рівноваги
- •2.1 Закон діючих мас. Константи рівноваги гомогенних реакцій
- •2.2 Одиниці виміру констант рівноваг
- •2.3 Зв'язок між та
- •2.4 Хімічна рівновага в гетерогенних реакціях
- •2.5 Вплив вихідного складу системи на напрямок перебігу хімічного процесу. Рівняння ізотерми хімічної реакції
- •2.6 Рівняння ізотерми хімічної реакції для стандартного стану учасників процесу. Розрахунок константи рівноваги процесу за с.У.
- •2.7 Вплив зовнішніх умов на стан хімічної рівноваги. Принцип рухомої рівноваги Ле Шательє – Брауна
- •2.7.1 Вплив тиску на положення рівноваги
- •2.7.2 Вплив інертного газу на хімічну рівновагу
- •2.7.3 Залежність кр і Кс хімічної реакції від температури. Рівняння ізобари та ізохори
- •2.7.4 Вплив тиску на положення рівноваги
- •2.8 Розрахунок теплового ефекту та кр при різних температурах за рівнянням ізобари хімічної реакції
- •2.9 Розрахунок кр за величиною зміни енергії Гіббса
- •3 Фазові рівноваги
- •3.1 Фазові перетворення в однокомпонентних системах. Рівняння Клаузіуса – Клапейрона та його практичне застосування
- •3.2 Двокомпонентні системи
- •3.2.1 Способи виразу складу двокомпонентних систем
- •3.2.2 Рівновага рідина – пара у двокомпонентних системах. Тиск насиченої пари над ідеальним розчином. Закон Рауля
- •3.2.3 Зниження температури кристалізації розплавів
- •4 Хімічна кінетика
- •4.1 Швидкість гомогенної хімічної реакції. Закон діючих мас. Порядок реакції
- •4.2 Вплив температури на швидкість хімічної реакції
- •5. Поверхневі явища. Адсорбція
- •Рекомендована література
1.4.2 Розрахунок хімічного процесу при будь-якій заданій температурі
Виходячи
з рівняння Гіббса - Гельмгольца![]() ,
в
свою чергу
,
в
свою чергу
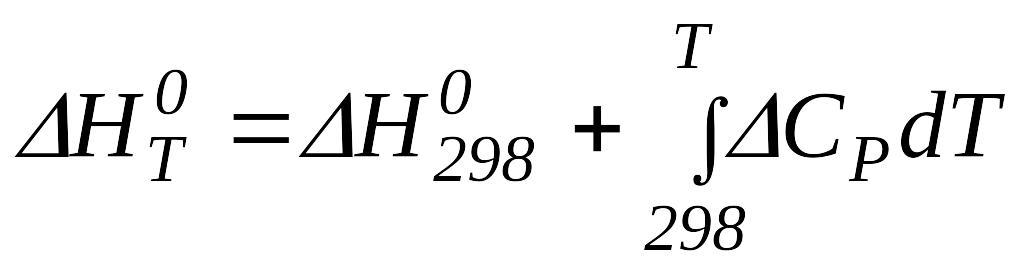 ,
,
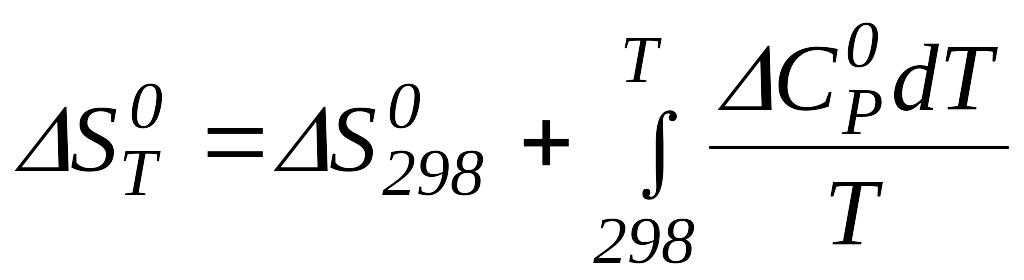 ,
відповідно
,
відповідно
|
(1.41) |
1)
![]() :
:
|
(1.42) |
2.
,
то
![]() (
(![]() – не залежить від температури)
– не залежить від температури)
|
(1.43) |
3. , тоді
|
(1.44) |
Приклад
17.
Для хімічного процесу MnO2(кр.)
+
2C(графіт)
→ 2CO(г.)
+ Mn(α)
визначити
зміну енергії Гіббса за умов, що![]() ,
та Т
= 500 К.
,
та Т
= 500 К.
Розв’язок.
;
![]() ;
;![]() .
.
. Згідно з рівнянням (1.42) запишемо:
![]() .
.
, рівняння (1.43):

2 Хімічні рівноваги
2.1 Закон діючих мас. Константи рівноваги гомогенних реакцій
Якщо
в системі перебігає хімічний процес
(1.1), то при
![]() ,
,
|
(2.1) |
де
![]() – рівноважні концентрації учасників
реакції;
– рівноважні концентрації учасників
реакції;
![]() – константа рівноваги, виражена через
рівноважні концентрації учасників
реакції;
– константа рівноваги, виражена через
рівноважні концентрації учасників
реакції;
![]() – рівноважні тиски учасників процесу;
– константа рівноваги, виражена через
рівноважні парціальні тиски учасників
реакції.
– рівноважні тиски учасників процесу;
– константа рівноваги, виражена через
рівноважні парціальні тиски учасників
реакції.
Ці рівняння є математичним виразом закону діючих мас:
відношення добутку рівноважних концентрацій (парціальних тисків) продуктів реакції, узятих у степенях, що дорівнюють їх стехіометричним коефіцієнтам, до аналогічного добутку для вихідних речовин при даній температурі є величина стала.
2.2 Одиниці виміру констант рівноваг
У системі СГС: →
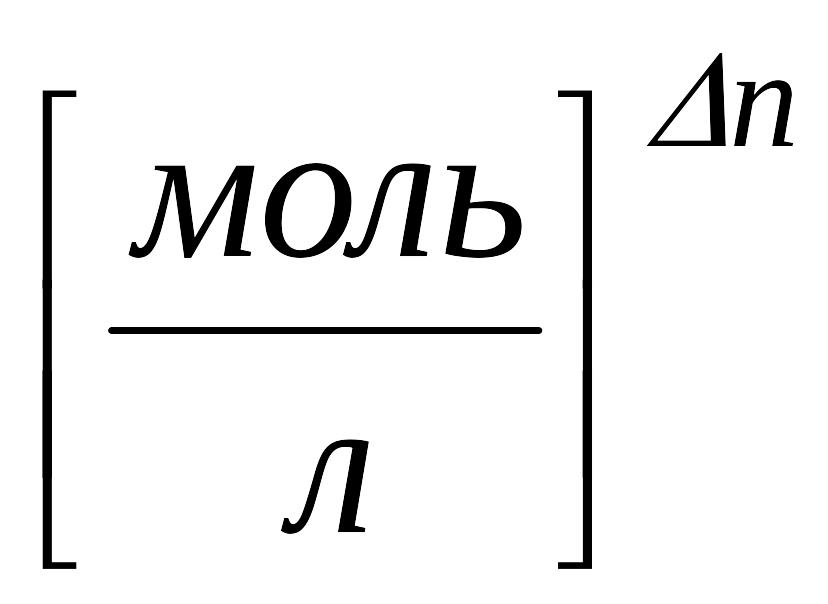 ;
;
у системі
СІ:
![]() →
→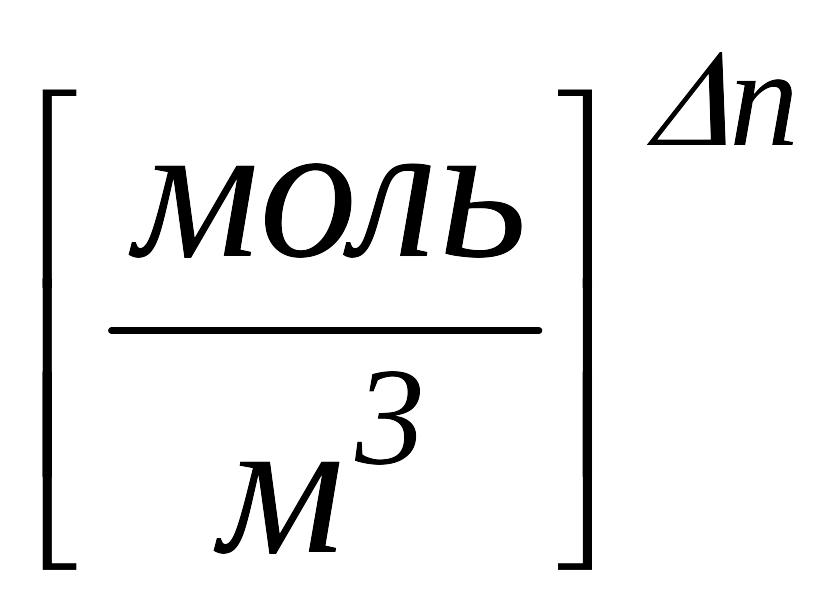 ,
,
Оскільки
![]() ,
то
,
то
|
(2.2) |
.
Якщо
![]() ,
то
,
то![]() і є безрозмірними величинами.
і є безрозмірними величинами.
У системі СГС: →
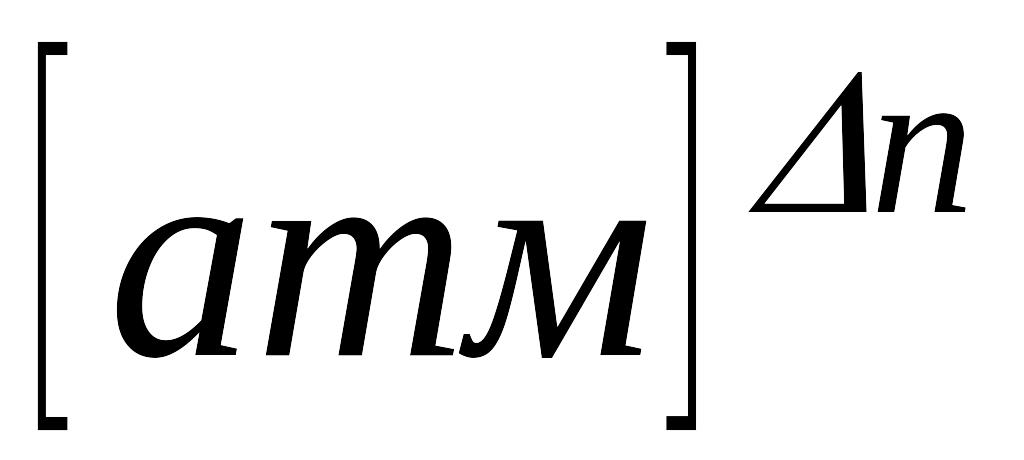 ;
;
у системі
СІ:
![]() →
→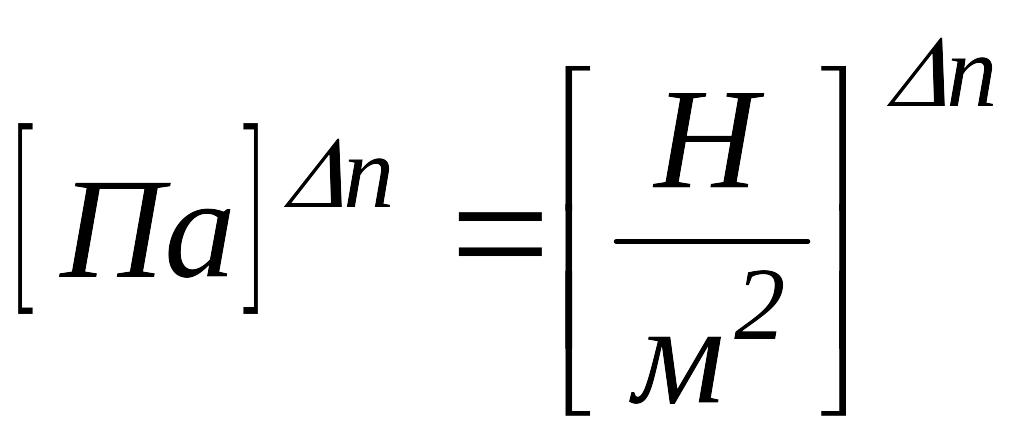 .
.
Оскільки
![]() ,
то
,
то
|
(2.3) |
Якщо
,
то
![]() і є безрозмірними величинами.
і є безрозмірними величинами.
2.3 Зв'язок між та
|
(2.4) |
де
![]() - зміна кількості молів газоподібних
речовин в результаті перебігу хімічного
процесу.
- зміна кількості молів газоподібних
речовин в результаті перебігу хімічного
процесу.
У системі
СГС:
![]() ,
тоді
,
тоді
|
(2.5) |
де у , у .
У системі
СІ:
![]() ,
тоді
,
тоді
|
(2.6) |
де у , у .
Зауважимо,
що при
![]() всі константи, незалежно від способу
вираження складу рівноважної системи,
будуть однаковими і не матимуть
розмірності.
всі константи, незалежно від способу
вираження складу рівноважної системи,
будуть однаковими і не матимуть
розмірності.
Аналіз рівняння (2.4) свідчить, якщо:
> 0, то >
< 0, то <
= 0, то = .
2.4 Хімічна рівновага в гетерогенних реакціях
Гетерогенними називаються процеси, в яких учасники перебувають у різних фазах (рідини, гази, кристали).
Якщо в реакції беруть участь конденсовані фази (кристали, рідини), то при постійній температурі парціальні тиски пар учасників процесу, що перебувають у конденсованому стані, постійні. Ці постійні величини можна ввести в константу рівноваги, і тоді вона визначатиметься рівноважними парціальними тисками газоподібних учасників реакції.
Наприклад:
![]() .
.
У цій
хімічній системі присутні три фази: дві
кристалічні
![]() і одна газоподібна (суміш газів
і одна газоподібна (суміш газів
![]() ).
).
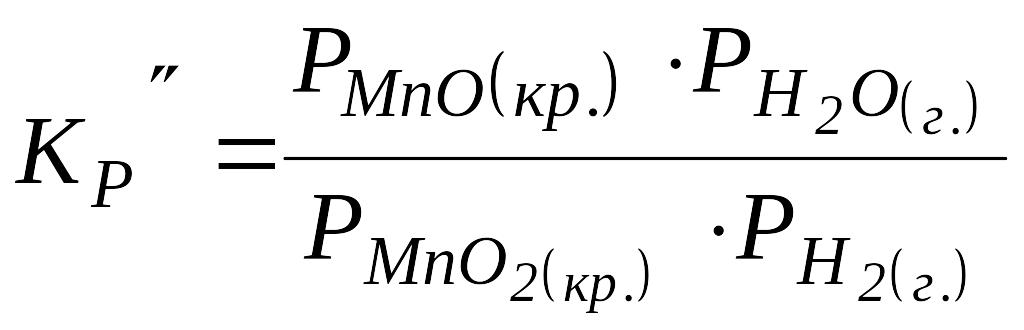 ,
оскільки
,
оскільки
![]() ,
то вони включаються у константу рівноваги:
,
то вони включаються у константу рівноваги:
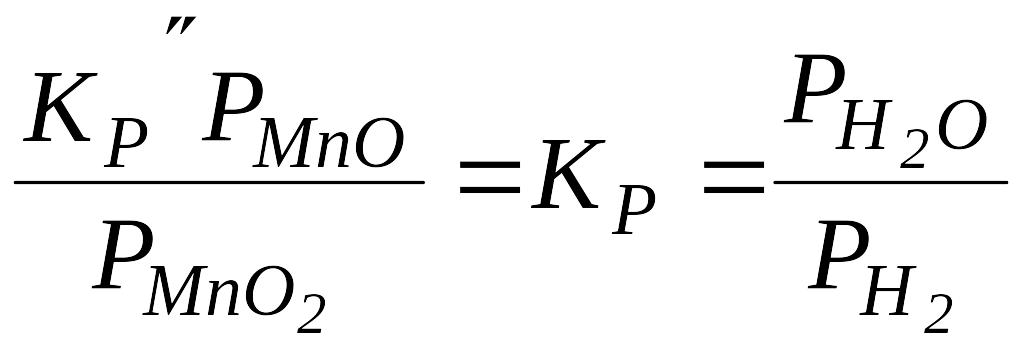 .
.
Отже, у рівняння для гетерогенних реакцій входять парціальні тиски тільки газоподібних учасників процесу.
Приклад 18.
У хімічній системі у стані рівноваги відбувається реакція при
![]() .
Визначити константу рівноваги
,
якщо загальний тиск газів у системі
.
Визначити константу рівноваги
,
якщо загальний тиск газів у системі
![]() .
.
Розв’язок.![]() ,
,
![]() .
Відповідно до стехіометрії
.
Відповідно до стехіометрії
![]() ,
тоді
,
тоді
![]() ,
звідси
,
звідси
![]() ,
отже
,
отже
![]() .
.
![]()
Приклад 19.
Знайти константу рівноваги хімічного процесу
FeO(кр.)
+CO(г.)→Fe(α)+
СO2(г.),
який
знаходиться у рівновазі при
![]() ,
якщо
,
якщо
![]() ,
а рівноважна суміш газів містить 7%
,
а рівноважна суміш газів містить 7%
![]() .
.
Розв’язок.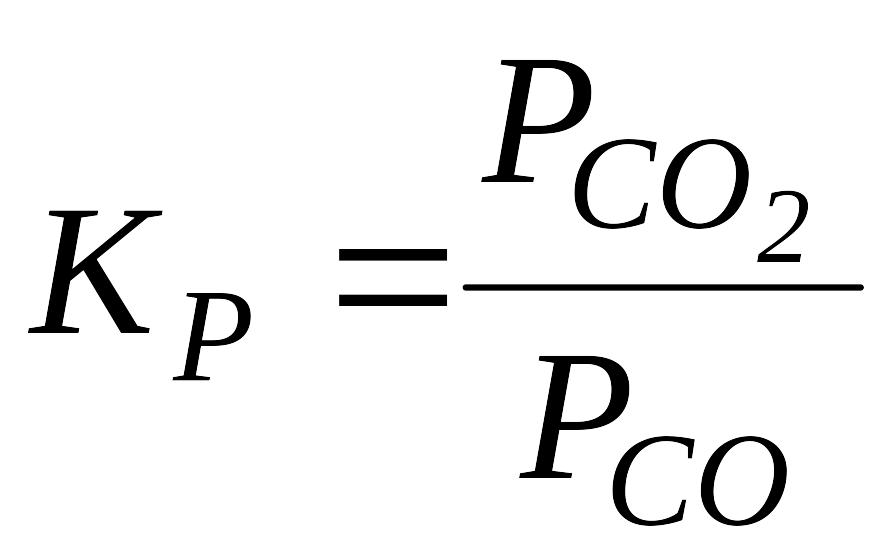 ,
в свою чергу
,
в свою чергу
![]() ,
звідки
,
звідки
![]() ,
а
,
а
![]() ,
тоді
,
тоді
![]() ,
а
,
а
![]() ,
звідси
,
звідси
![]() .
.
Приклад
20. Для
хімічного процесу H2O(г.)
+ Fe(α)
↔ FeO(кр.)
+ H2(г.),
який перебуває у рівновазі при Т
= 1200
К
![]() ,
а
,
а
![]() . Знайти рівноважні парціальні тиски
. Знайти рівноважні парціальні тиски
![]() та
та
![]() .
.
Розв’язок.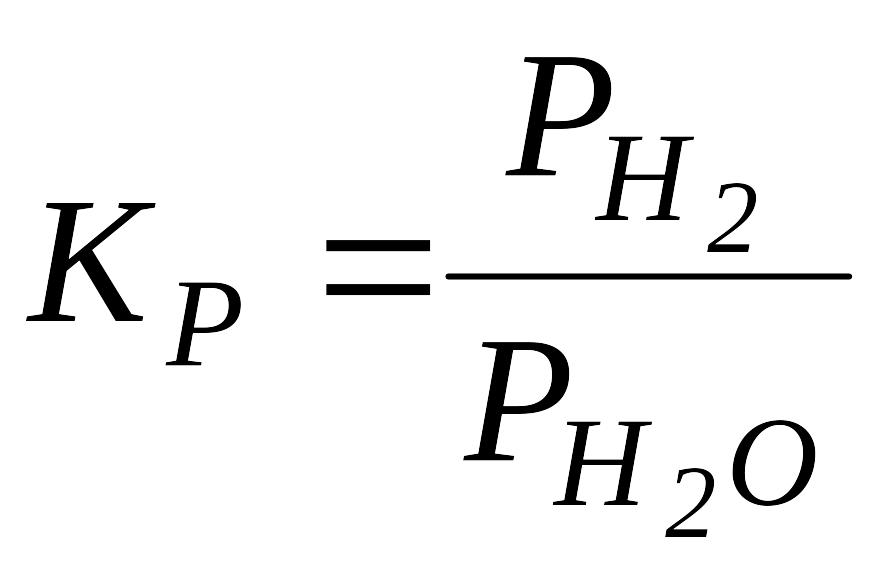 ,
,
![]() ,
тоді
,
тоді
![]() ,
звідки
,
звідки
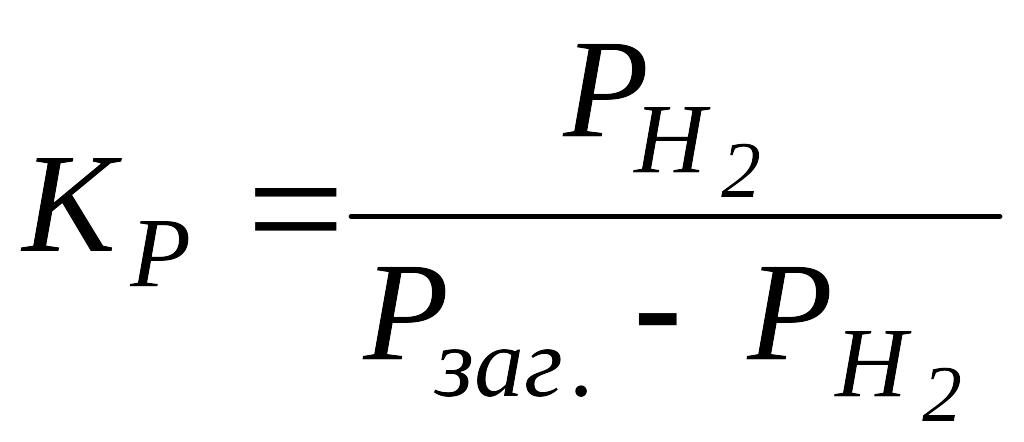 ,
,
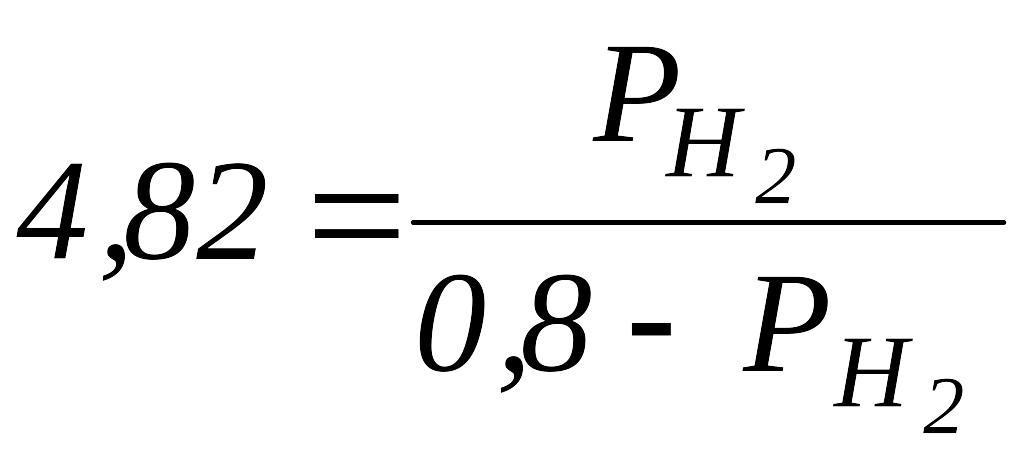 →
→
![]() ,
відповідно
,
відповідно
![]() .
.

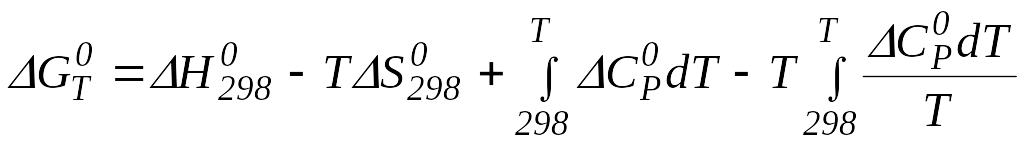 .
.
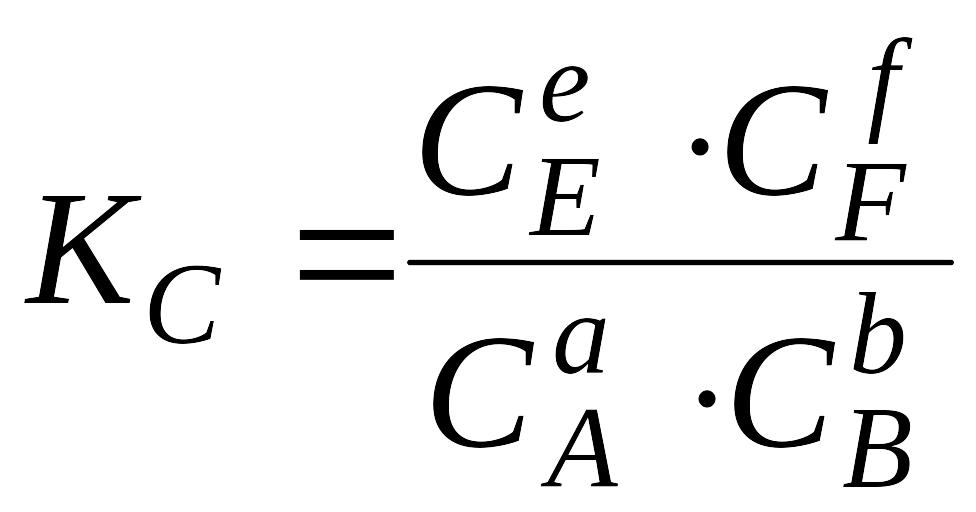 ,
,