
Витамин рр (никотинамид)
Никотинамид – компонент двух близких по структуре коферментов – никотинамидадениндинуклеотида (NAD) и никотинамидадениндинуклеотидфосфата (NADP). Строение этих коферментов показано на рис.8.
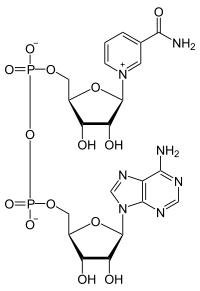
Никотинамидадениндинуклеотид
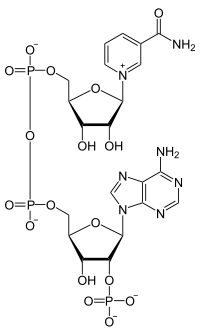
Никотинамидадениндинуклеотидфосфат
Никотинамид

Никотиновая кислота (ниацин)
Рис.8. Две формы витамина, предотвращающего пеллагру и строение активных коферментных форм этого витамина.
NADP отличается от NAD наличием в молекуле фосфатной группы. Эти коферменты могут находиться как в окисленной (NAD+ и NADP+), так и в восстановленной (NADH и NADPH) формах. Никотинамидный компонент этих коферментов играет роль промежуточного переносчика гидрид-иона, который ферментативно отщепляется от молекулы субстрата под действием специфических дегидрогеназ. В качестве примера можно привести реакцию, катализируемую малатдегидрогеназой, которая дегидрирует малат , превращая его в оксалоацетат; эта реакция представляет собой один из этапов окисления углеводов и жирных кислот. Малатдегидрогеназа катализирует также обратимый перенос гидрид-иона от малата к NAD+, в результате чего образуется NADH; второй атом водорода отщепляется от гидроксильной группы молекулы малата в виде свободного иона Н+:
L-малат + NAD+ ↔ Оксалоацетат + NADH + Н+.
Известно большое число дегидрогеназ такого типа, из которых каждая обладает специфичностью по отношению к какому-нибудь определённому субстрату. Одни из этих ферментов используют в качестве кофермента NAD+, другие – NADP+, а третьи могут функционировать с любым из этих двух коферментов. У большинства дегидрогеназ NAD (или NADP) связывается с белковой частью фермента только во время каталитического цикла, однако известны и такие ферменты, с которыми эти коферменты связаны очень прочно и постоянно присутствуют в активном центре.
Пантотеновая кислота (витамин в5)
Пантотеновую кислоту (рис.10) впервые выделил из дрожжей и экстрактов печени в 1938 г. Роджер Уильямс (брат Роберта Уильямса, установившего структуру тиамина). Пантотеновая кислота (приставка пан- означает “повсеместно”) обнаружена во всех исследованных тканях растений и животных, а также у микроорганизмов. Однако лишь через двенадцать лет после того, как пантотеновая кислота была получена в чистом виде, Фритц Липманн и Натан Каплан показали, что она является коферментом. Сначала они обнаружили термостабильный фактор, необходимый для ускорения АТР-зависимого ферментативного ацетилирования спиртов и аминов. Затем, очистив и изучив свойства этого фактора, получившего название кофермент А (кофермент ацетилирования), они установили, что в нём содержится прочно связанная пантотеновая кислота. Сейчас мы знаем, что кофермент А выполняет значительно более широкие функции: он участвует во многих ферментативных реакциях, в которые вовлечены не только ацетильные, но и любые другие ацильные группы. Кофермент А (-СоА или СоА-SH) выполняет функции промежуточного переносчика ацильных групп.
Молекула кофермента А (рис.9) содержит реакционноспособную тиоловую (-SH) группу, с которой ковалентно связываются переносимые коферментом ацильные группы, в результате чего образуются тиоэфиры. Тиоэфиры представляют собой сложные эфиры тиолов, или тиоспиртов (общая формула R-SH).


Рис.9. Кофермент А и пантотеновая кислота.
В ходе реакции, показанной на рисунке 10, окислительное декарбоксилирование пирувата под действием пируватдегидрогеназного комплекса приводит к образованию ацетил-СоА.

Рис.10. Работа пируватдегидрогеназного комплекса.
В ходе второй реакции ацильная группа ацетил-СоА под действием цитратсинтазы переносится на оксалоацетат, который превращается при этом в цитрат (Рис.11).
ацетил-CoA + оксалоацетат + H2O → цитрат + CoA-SH
Рис.11. Работа цитратсинтазы.
Этой реакцией начинается лимонный цикл – центральный путь окислительного расщепления углеводов и жирных кислот в аэробных условиях.
