
- •4. Электрохимические процессы
- •4.1. Электрохимические процессы. Основные понятия, определения
- •4.2. Электродные потенциалы металлических и газовых электродов
- •4.3. Потенциалы газовых электродов
- •4.4. Потенциалы окислительно-восстановительных электродов
- •4.5. Кинетика электродных процессов. Электрохимическая поляризация. Перенапряжение
- •Cхемы щелочных аккумуляторов:
- •На катоде – восстановление кислорода
- •4.7. Вопросы для самоконтроля.
- •Устройство щелочных (Fe – Ni, Cd - Ni) аккумуляторов. Литература
- •4.8. Примеры решения задач
- •4.9. Задачи для домашнего задания
- •4.10. Варианты домашнего задания
- •Стандартные окислительно-восстановительные потенциалы (Ео298) в водных растворах
4.3. Потенциалы газовых электродов
Газовые электроды могут быть обратимыми относительно анионов (кислородный) или относительно катионов (водородный). Газовые электроды состоят из металлического проводника, контактирующего одновременно с газом и раствором, содержащим ионы этого газа. Металлический проводник служит для подвода и отвода электронов и, кроме того, является катализатором электродной реакции (ускоряет установление равновесия на электроде). Металлический проводник не должен посылать в раствор собственные ионы, т.е. быть инертным, а также обладать хорошей адсорбционной способностью, так как в электродном процессе участвуют адсорбированный газ и его ионы в растворе. Всем этим требованиям удовлетворяют платина, покрытая электролитическим способом платиновой чернью, и металлы платиновой группы, поэтому они чаще всего используются при создании газовых электродов.
Так как в равновесных электродных реакциях газовых электродов участвуют газообразные компоненты, то потенциалы этих электродов зависят от парциальных давлений газов.
Равновесие на водородном электроде выражается уравнением 2Н+ + 2 Н2 . Уравнение Нернста для расчета потенциала водородного электрода имеет следущий вид:
Е2Н![]() Н
=
Н
=
 (4.16)
(4.16)
или для 298 К
Е2Н
Н
=
 ,
(4.17)
,
(4.17)
где аН - активность ионов Н+ в электролите; рН - парциальное давление водорода.
Учитывая,
что
![]() = - рН, получаем при 298 К
= - рН, получаем при 298 К
Е2Н
Н
=
![]() (
4.18)
(
4.18)
при рН = 1 и 298 К уравнение (4.18) приобретает вид:
Е2Н Н = - 0,059 рН (4.19)
Кислородный электрод состоит из платиновой пластины, контактирующей с кислородом и раствором, содержащим ионы, которые образуются при восстановлении кислорода (ионы ОН-):
О2, Pt │ОН-
Если на кислородном электроде протекает реакция по уравнению:
2 Н2О + О2 + 4 4 ОН-
то выражение равновесного потенциала для 298 К имеет вид:
Е2Н
О
+О
/
4ОН![]() = Е02Н
О
+О
/
4ОН-
+
= Е02Н
О
+О
/
4ОН-
+
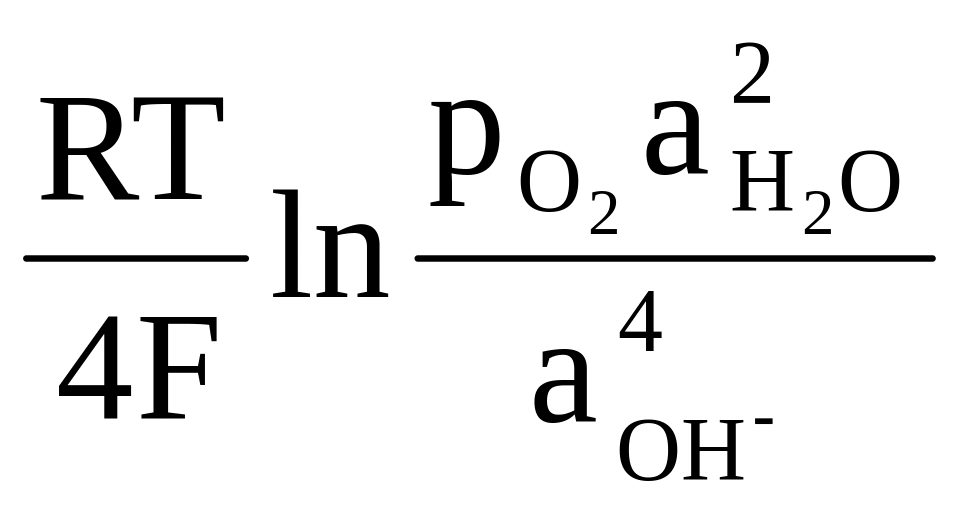 (4.20)
(4.20)
Так
как активность воды в ходе реакции
меняется мало, то ее считают величиной
постоянной и значение
![]() вводят в Е
02Н
О
+О
/
4ОН
:
вводят в Е
02Н
О
+О
/
4ОН
:
Е2Н
О
+О
/
4ОН
= Ео2Н
О
+О
/
4ОН
+ 0,0147
 , (4.21)
, (4.21)
где Ео2Н О +О / 4ОН - стандартный потенциал кислородного электрода, равный 0,401 В (при аОН- = 1 моль/л).
Подставляя в уравнение (4.21) значение а ОН- = КН О/ аН+ , где КН О - ионное произведение воды, и = -рН, получаем
Е2Н
О
+О
/
4ОН
= 1,23 + 0,0147
![]() -
0,059 рН (4.22)
-
0,059 рН (4.22)
Учитывая,
что
![]() =
- рОН,
=
- рОН,
![]() О
=
1атм, аН
О
= 1моль/л и Т=298 К уравнение ( 4.20)
приобретает вид:
О
=
1атм, аН
О
= 1моль/л и Т=298 К уравнение ( 4.20)
приобретает вид:
Е2Н
О
+О
/
4ОН
= Ео2Н
О
+О
/
4ОН
+
0,059
![]() (4.23)
(4.23)
Зависимости потенциалов водородного и кислородного электродов от рН раствора приведены в таблице.
Таблица. Газовые электроды
Уравнение |
Электрод и его обозначения |
|||
водородный |
кислородный |
|||
2Н+/Н2 ,Pt |
2H2O/H2,2OH-,Pt |
Pt,O2,4H+/2H2O |
Pt,O2,2H2O/4OH- |
|
pH < 7 |
pH
|
pH < 7 |
pH 7 |
|
электродного процесса |
2Н+
+2 |
2 Н2О +2 Н2 + 2ОН- |
О2+ 4Н+ + 4 2Н2О |
2Н2О +О2 + 4 4 ОН- |
Ео, В |
0,000 |
-0,828 |
1,229 |
0,401 |
уравнение Нернста |
|
|
|
|
Для расчета электродного потенциала:
а) при Т=298К
б) при Т=298К и
|
=-0,059 рН
|
|
-0,059рН + 0,0147
|
= 1,229-0,059рН |




