
294. Розчин йоду забарвлює крохмаль у:
A. Рожевий колір
B. Жовтий колір.
C. Червоний колір;
D. Зелений колір;
E. *Синій колір;
295. Кінцевий продукт гідролізу крохмалю - це:
A. Целюлоза
B. *Глюкоза.
C. Фруктоза;
D. Сахароза;
E. Декстрин;
296. При нагріванні з кислотами крохмаль, як і всі складні вуглеводи:
A. Конденсується
B. Полімеризується
C. *Гідролізує
D. Відновлюється
E. Окислюється
297. Із наведених формул виберіть ту, що відповідає крохмалю:
A. (С5Н10О12)n
B. C12H22O11
C. C2H5OH
D. C6H12O6;
E. *(C6H10O5)n;
298. Реакція між якими речовинами належить до оборотних реакцій?
A. NaOH, HCl
B. Al, HCl.
C. KOH, CuCl2;
D. K2O, HCl;
E. *N2, O2;
300. Який каталіз називається позитивним?
A. що супроводиться збільшенням об’єму реакційної суміші
B. що супроводиться зміщенням рівноваги праворуч
C. який супроводиться зміщенням рівноваги ліворуч
D. що супроводиться зменшенням швидкості реакції
E. *що супроводжується збільшенням швидкості реакції
301. Що таке каталіз?
A. зміна швидкості реакції в присутності індикаторів
B. зміна швидкості реакції в присутності активаторів.
C. зміна швидкості реакції в присутності газів
D. зміна швидкості реакції в присутності промоторів
E. *зміна швидкості реакції в присутності каталізаторів
302. Каталізатор впливає на:
A. Підвищення температури
B. Підвищення тиску
C. Зниження температури
D. *Швидкість реакції
E. Розчинність речовин
303. Як називаються речовини, які сповільнюють швидкість хімічних реакцій?
A. Індикатори
B. Активатори.
C. Промотори
D. *Інгібітори
E. Каталізатори
304. Яке твердження неправильне?
A. *Каталізатор не відновлюється по завершенні реакції.
B. Каталізатор характеризується селективністю.
C. Каталізатор не впливає на константу рівноваги.
D. Каталізатор зменшує енергію активації реакції.
E. Каталізатор не впливає на загальну стехіометрію реакції.
305. Яка з нижченаведих схем відповідає паралельній реакції:
A. AВ+О· → АО·+В; СD+AO·→CO·+AD
B. А+В→ М; А+С→N
C. *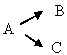
D. А→ В→ С→ Д
E. А+В ↔ С+Д
306. Реакції, які перебігають за участю хімічно-активних частинок називаються:
A. *Ланцюговими
B. Спряженими
C. Паралельними
D. Послідовними
E. Оборотніми
307. Який закон пояснює залежність швидкості хімічної реакції від концентрації реагуючих речовин:
A. *Закон діючих мас
B. Закон Гесса
C. Закон Вант-Гоффа
D. 2й закон термодинаміки
E. 1-й закон термодинаміки
308. Основою якої з теорій каталізу є твердження, що адсорбція реагуючих молекул на каталізаторі залежить від розподілу електронних рівнів всередині кристалів каталізатора і на їх поверхні:
A. Адсорбційна
B. *Електронно-хімічна
C. Теорія активних ансамблів
D. Утворення проміжного комплексу
E. Мультиплетна
309. Яке твердження є правильне?
A. Каталізатор не відновлюється по завершенні реакції.
B. Швидкість реакції не залежить від концентрації
C. Ферменти не є каталізаторами
D. *Каталізатор зменшує енергію активації реакції.
E. Константа швидкості реакції залежить від концентрації речовин
310. Взаємодяї каталізатора і реагентів, при якій швидкість реакції зменшується, називається:
A. Автокаталізом
B. *Негативним каталізом
C. Позитивним каталізом
D. Гомогенним каталізом
E. Гетерогенним каталізом
311. Яка з нижченаведих схем відповідає ланцюговій реакції (беруть участь вільні радикали)
A. *AВ+О· → АО·+В; СD+AO·→CO·+AD
B. А+В→ М; А+С→N
C. 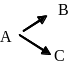
D. А→ В→ С→ Д
E. А+В ↔ С+Д
312. Складні реакції, одна з яких може йти самостійно, а друга перебігає лише, коли проходить перша, називаються:
A. Ланцюговими
B. *Спряженими
C. Паралельними
D. Послідовними
E. Оборотніми
313. Основою якої з теорій каталізу є твердження що поодинокі атоми каталізатора неактивні, але коли вони об’єднуються в невеликі групи, утворюються активні центри:
A. Адсорбційна
B. Електронно-хімічна
C. *Теорія активних ансамблів
D. Утворення проміжного комплексу
E. Мультиплетна
314. Особливість ферментативних реакцій є:
A. Оборотність реакції
B. Випадання осаду
C. *Висока специфічність ферменту
D. Зміна ступеня окиснення ферменту
E. Мала швидкість реакції
315. Взаємодія каталізатора і реагентів, при якій швидкість реакції збільшується, називається:
A. Автокаталізом
B. Негативним каталізом
C. *Позитивним каталізом
D. Гомогенним каталізом
E. Гетерогенним каталізом
316. Яка з нижченаведих схем відповідає послідовній реакції:
A. AВ+О· → АО·+В; D+AO·→CO·+AD
B. А+В→ М; А+С→N
C. 
D. *А→ В→ С→ Д
E. А+В ↔ С+Д
317. Реакції, в яких вихідна речовина одночасно реагує в двох напрямках, називається:
A. Ланцюговими
B. Спряженими
C. *Паралельними
D. Послідовними
E. Оборотніми
318. Утворення комплексу ферменту з інгібітором відбувається не на тій ділянці ферменту, з яким зв’язується субстрат, називається :
A. *Неконкурентним інгібуванням
B. Поліконкурентним інгібуванням
C. Конкурентним інгібуванням
D. Безконкурентним інгібуванням
E. Автоконкурентним
319. Речовини, які гальмують дію каталізатора, називаються:
A. Ферментами
B. Індикаторами
C. Гормонами
D. *Інгібіторами
E. Промоторами
320. Bзаємодія каталізатора і реагентів на поверхні каталізатора називається:
A. Автокаталізом
B. Негативним каталізом
C. Позитивним каталізом
D. Гомогенним каталізом
E. *Гетерогенним каталізом
321. Яка з нижченаведих схем відповідає спряженій реакції:
A. AВ+О· → АО·+В; СD+AO·→CO·+AD
B. *А+В→ М; А+С→N
C.
D. А→ В→ С→ Д
E. А+В ↔ С+Д
322. Реакції, що одночасно відбуваються у прямому та протилежному напрямках, називаються:
A. Ланцюговими
B. Спряженими
C. Паралельними
D. Послідовними
E. *Оборотніми
323. Явище, коли інгібітор зв’язується з активним центром ферменту і конкурує з субстратом за активний центр, називається:
A. Неконкурентним інгібуванням
B. Поліконкурентним інгібуванням
C. *Конкурентним інгібуванням
D. Безконкурентним інгібуванням
E. Автоконкурентним інгібуванням
324. Основою якої з теорій каталізу є твердження,"каталізатор в процесі реакції бере участь в утворенні нестійкої проміжної сполуки з реагентами":
A. Адсорбційна
B. Електронно-хімічна
C. Теорія активних ансамблів
D. *Утворення проміжного комплексу
E. Мультиплетна
325. Речовини, які підсилюють дію каталізатора, називаються:
A. Ферментами
B. Індикаторами
C. Гормонами
D. Інгібіторами
E. *Промоторами
326. Явище взаємодії каталізатора і реагентів в одній фазі називається:
A. Автокаталізом
B. Негативним каталізом
C. Позитивним каталізом
D. *Гомогенним каталізом
E. Гетерогенним каталізом
327. Прилад, який використовують для вивчення впливу ступеня дисперсності реагентів речовин на швидкість хімічних реакцій називають:
A. Термометр.
B. Фотоелектроколориметр
C. Вольтметр
D. рН- метр
E. *Манометр
328. Манометр використовують для вимірювання:
A. *Тиску газу
B. Концентрації
C. Ступеня дисоціації
D. Температури
E. Густини
329. Для вивчення впливу ступеня дисперсності реагуючих речовин на швидкість хімічних реакцій використовують:
A. Термометр
B. Фотоелектроколориметр
C. *Манометр
D. Вольтметр
E. рН- метр
330. Фізичний зміст константи швидкості хімічної реакції:
A. Константа швидкості - це швидкість реакції при концентраціях 0,1 моль/л
B. Константа швидкості - це швидкість при кімнатній температурі
C. Маса речовин, що вступили в реакцію дорівнює масі речовин, що утворилася після реакції
D. Тепловий ефект реакції не залежить від проміжних стадій процесу
E. *Константа швидкості - це швидкість реакції, якщо концентрації реагуючих речовин 1 моль/л
331. При підвищенні температури швидкість хімічних реакцій:
A. Не змінюється
B. Значно зменшується
C. *Значно збільшується
D. Зменшується в незначній мірі
E. Зменшується
332. Закон діючих мас формулюється так:
A. Тепловий ефект реакції не залежить від проміжних стадій процесу, а тільки від початкового та кінцевого стану реагуючих речовин
B. Властивості елементів, а також форми і властивості їхніх сполук перебувають у періодичній залежності від заряду ядер атомів
C. Енергія не виникає з нічого і не зникає безслідно, а перетворюється з одного виду в інший в еквівалентних кількостях.
D. Маса речовин, що вступили в реакцію = масі речовин, що утворилися внаслідок реакції
E. *Швидкість реакції прямо пропорційна концентрації реагуючих речовин у даний момент часу в ступені, що дорівнює їх стехіометричним коефіцієнтам
333. На швидкість гетерогенних реакцій не впливає:
A. *Об’єм компонентів
B. Природа розчинника
C. Температура, тиск
D. Концентрація реагентів
E. Природа реагуючих речовин
334. Константа швидкості хімічної реакції залежить:
A. Від концентрації
B. Від тиску реагента
C. Від маси регента
D. Від атмосферного тиску
E. *Від температури
335. Фактори, що не впливають на швидкість реакції між розчинами речовин:
A. Кількість речовини
B. *Ступінь дисперсності реагуючих речовин
C. Природа реагуючих речовин
D. Температура
E. Концентрація
336. Яким законом підтверджується залежність швидкості хімічної реакції від концентрації реагуючих речовин:
A. Законом Гесса
B. Законом Фарадея
C. Закон Нютона
D. Законом збереження маси
E. *Основним законом хімічної кінетики (закон діючих мас)
337. На швидкість гомогенних реакцій не впливає:
A. *Поверхня поділу фаз
B. Природа розчинника
C. Температура, тиск
D. Концентрація реагентів
E. Природа реагуючих речовин
338. Який з факторів не впливає на швидкість реакції в газових системах:
A. Тиск
B. *Ступінь дисперсності реагуючих речовин
C. Природа реагуючих речовин
D. Температура
E. Концентрація
339. Правило Вант-Гоффа:
A. Тепловий ефект реакції не залежить від проміжних стадій процесу, а тільки від початкового та кінцевого стану реагуючих речовин
B. Властивості елементів, а також форми і властивості їхніх сполук перебувають у періодичній залежності від заряду ядер атомів
C. Енергія не виникає з нічого і не зникає безслідно, а перетворюється з одного виду в інший в еквівалентних кількостях.
D. Маса речовин, що вступили в реакцію = масі речовин, що утворилися внаслідок реакції
E. *Підвищення температури на 100С призводить до збільшення швидкості гомогенної хімічної реакції у два-чотири рази
340. Якщо реагуючі речовини перебувають у різних фазах, то така реакція називається:
A. Однорідна
B. Неоднорідною
C. Однофазною
D. *Гетерогенною
E. Гомогенною
341. Гомогенна система - це:
A. Система в склад якої входить вода і пісок
B. Система, що складається з двох і більше фаз
C. Сукупність рідкої і твердої фази
D. Система, що складається з однієї фази
E. Система, що складається з двох фаз
342. Швидкість і механізм хімічної реакції вивчає:
A. Неорганічна хімія
B. Теорія електролітичної дисоціації
C. Аналітична хімія
D. *Хімічна кінетика
E. Термодинаміка
343. Швидкість хімічної реакції - це:
A. Здатність реагуючих речовин проводити електричний струм
B. Здатність зберігати стале значення рН
C. Одночасне збільшення концентрації вихідних речовин і продуктів реакції
D. Зміна забарвлення індикатора при закінченні реакції
E. *Зміна концентрації реагуючих речовин за одиницю часу
344. Залежність константи швидкості хімічної реакції від температури виражає рівняння:
A. Стану ідеальних газів
B. Клапейрона
C. *Арреніуса
D. Нернста
E. Менделєєва - Клапейрона
345. Не є гетерогенною така система:
A. Система в склад якої входить вода і тверда фаза
B. Система, що складається з трьох фаз
C. Сукупність рідкої і твердої фази
D. *Система, що складається з однієї фази
E. Система, що складається з двох фаз
346. Константа швидкості хімічної реакції зростає:
A. При збільшенні тиску
B. При збільшенні концентрації реагуючих речовин
C. При зменшенні концентрацій
D. При зниженні тиску
E. *При підвищенні температури
347. Швидкість хімічних реакцій не залежить від:
A. Ступеня дисперсності реагуючих речовин
B. *Об’єму реагуючих речовин
C. Природи реагуючих речовин
D. Дії каталізатора
E. Температури
348. Згідно з правилом Вант-Гоффа: при підвищенні температури швидкість хімічних реакцій:
A. Не змінюється
B. Температура не впливає на швидкість реакції
C. *Значно збільшується
D. Зменшиться в 2 рази
E. Зменшується в 1,5 раза
349. Основний постулат хімічної кінетики виражається рівнянням:
A. V=nVm
B. *ύ= kCaACBb
C. m=Eqq
D. E=∆mC2
E. PV=RT
350. Якщо реагенти і продукти реакції знаходяться в одній фазі, то реакцію називають:
A. Різнофазною
B. Неоднорідною
C. Багатофазною
D. Гетерогенною
E. *Гомогенною
351. Хімічна кінетика вивчає:
A. Окисно-відновні реакції, що лежать в основі роботи гомологічних елементів
B. Визначення рН розчинів
C. Буферні системи крові
D. *Швидкість хімічних реакцій і її залежність від різних факторів
E. Розчини
352. При незмінності яких параметрів системи зменшення енергії Гіббса визначає напрямок процесу?
A. *Температури і тиску.
B. Тиску і об’єму.
C. Об’єму і температури.
D. Тиску.
E. Маси і теплоємності.
353. Термодинамічний процес при постійній температурі називають
A. *Ізотермічний.
B. Ізохорний.
C. Адіабатичний.
D. Ендотермічний.
E. Ізобарний.
354. У деяких системах, що застосовуються в хімічній технології, не спостерігаються зміни об’ємів. В якому співвідношенні знаходиться внутрішня енергія та ентальпія в таких системах?
A. U = 2H.
B. 2U = H;
C. *U = H;
D. U < H;
E. U > H;
355. Основний закон термохімії (закон Гесса) встановлює, що тепловий ефект хімічної реакції
A. Не залежить від природи реагуючих речовин
B. Залежить від природи продуктів реакції.
C. Не залежить від природи продуктів реакції.
D. Залежить від природи вихідних речовин.
E. *Не залежить від шляху перебігу реакції.
356. Ентальпійний фактор позитивний, а ентропійний - негативний. Який напрям і умови процесу ?
A. *Реакція не відбувається взагалі
B. Реакція може відбуватись тільки при низьких температурах
C. Реакція може відбуватись тільки при високих температурах
D. Реакція відбувається при будь-яких температурах
E. Реакція може відбуватись при температурі абсолютного нуля
357. Стан системи, який не змінюється в часі при незмінних зовнішніх факторах, називається…
A. Ізохорним
B. Ізобарним
C. Ізотермічним
D. Нерівноважним
E. *Рівноважним
358. Який термодинамічний потенціал треба вибрати як критерій самочинного перебігу реакції, якщо вона відбувається в закритому автоклаві при сталій температурі?
A. Ентальпію
B. Ентропію
C. Внутрішню енергію
D. Енергію Гіббса
E. *Енергію Гельмгольца
359. В технології синтезу фармацевтичних препаратів багато процесів відбувається при сталих температурі і тиску. Яку термодинамічну функцію треба обрати як критерій перебігу самочинного процесу в цих умовах?
A. Ентальпія.
B. Ентропія.
C. Внутрішня енергія.
D. *Енергія Гіббса.
E. Енергія Гельмгольца.
360. Кількість зв’язаної енергії, віднесена до температури, це…
A. Внутрішня енергія.
B. Енергія Гельмгольца.
C. Енергія Гіббса.
D. Ентальпія.
E. *Ентропія.
361. Для обчислення теплових ефектів реакцій синтезу речовин при нестандартній температурі застосовують
A. Рівняння ізохори
B. *Закон Кірхгофа
C. Рівняння ізотерми
D. Закон Кольрауша
E. Рівняння ізобари
362. Ентропія S - критерій межі перебігу хімічних процесів в ізольованій системі. У рівноважному стані
A. *S=Smax.
B. S>0
C. S=0
D. S=Smin
E. S<0
363. При складанні теплових балансів хімічних процесів у виробництві часто неможливо експериментально визначити тепловий ефект процесу. В такому випадку для розрахунків застосовують закон:
A. Нернста.
B. Рауля.
C. Вант-Гофа.
D. *Гесса.
E. Фарадея.
364. Важливе значення в термодинамічних розрахунках надається обчисленню вільної енергії Гіббса G. Довільне протікання процесу за ізобарно-ізотермічних умов можливе при:
A. G>0
B. *G<0.
C. G=0.
D. G0.
E. G0.
365. У фармацевтичній промисловості широко застосовується оцінка можливості самочинного перебігу хімічних процесів. За ізохорно-ізотермічних умов критерієм напряму реакції є зниження:
A. Внутрішньої енергії.
B. Енергії Гіббса.
C. *Енергії Гельмгольца.
D. Ентропії.
E. Ентальпії.
366. Теорія хімічної рівноваги широко використовується у виробництві ліків. Для якого з процесів підвищення температури збільшує вихід продуктів реакції?
A. Ізобарного
B. Ізохорного.
C. Адіабатного
D. Екзотермічного
E. *Ендотермічного.
367. Стан невпорядкованості у системі характеризує:
A. Енергія Гібса.
B. Внутрішня енергія.
C. Ентальпія.
D. *Ентропія.
E. Тепловий ефект.
368. З точки зору термохімії реакції, які супроводжуються поглинанням теплоти, називаються:
A. Бітермічними.
B. Ізотермічними.
C. *Ендотермічними.
D. Екзотермічними.
E. Політермічними.
369. Термодинамічний ста, при якому Т = const, називається:
A. Немає правильної відповіді.
B. Ізобарний.
C. Адіабатичний.
D. *Ізотермічний.
E. Ізохорний.
Тіло, або сукупність тіл, які мають реальну або уявну межу від навколишнього середовища і характеризуються певними властивостями, називаються:
Розчином.
*Термодинамічною системою.
Фазою.
Речовиною.
Термодинамічними параметрами.
Функцією, яка відображає вплив ентропії та ентальпії на напрямок перебігу хімічної реакції називається:
*Енергія Гібса
Внутрішня енергія
Тепловий ефект
Теплота згорання
Теплота утворення
.З точки зору термодинаміки процеси, які супроводжуються поглинанням теплоти, називаються:
Електролітичними
Ізотермічними.
*Ендотермічними.
Екзотермічними.
Політермічними.
Який з нижче наведених виразів відповідає математичному виразу ентальпії:
Н=∆U-A.
*Н=U+pV.
Н=p∆U.
Н=∆U+A.
Н=TS.
З точки зору термодинаміки реакції, які супроводжуються виділенням теплоти, називаються:
A. Ендергонічні.
B. Ізотермічними.
C. Ендотермічними.
D. *Екзотермічними.
E. Політермічними.
. Який з виразів відповідає математичному виразу першого закону термодинаміки:
A. Q=∆U-S.
B. Q=U+G.
C. Q= p∆U.
D. *Q=∆U+A.
E. Q=TS.
. Система, в якій всі її компоненти знаходяться в одній фазі і в ній відсутні поверхні розділу, називається:
A. *Гомогенною.
B. Ізольованою.
C. Відкритою.
D. Закритою.
E. Гетерогенною.
. Термодинамічний стан, при якому V = const, називається:
A. Немає правильної відповіді.
B. Ізобарний.
C. Адіабатичний.
D. Ізотермічний.
E. *Ізохорний.
Сума кінетичної та потенціальної енергії всіх мікрочастинок, якою володіє система- це :
A. Енергія Гібса.
B. *Внутрішня енергія.
C. Ентальпія.
D. Ентропія.
E. Теплота утворення.
Термодинамічний стан системи,при якому р = const, називається:
A. Немає правильної відповіді.
B. *Ізобарний.
C. Адіабатичний.
D. Ізотермічний.
E. Ізохорний.
Кількість теплоти, яка виділяється або поглинається в необоротному процесі при сталому тиску, називається:
A. Енергія Гібса
B. Внутрішня енергія
C. *Ентальпія
D. Ентропія
E. Тепловий ефект
. Тепловий ефект, який складається з теплоти, що витрачається на руйнування кристалічної решітки і теплоти, виділеної при сольватації іонів та молекул, називається:
A. Стандартною теплотою розкладу.
B. Теплотою реакції нейтралізації;
C. *Теплотою розчинення
D. Стандартною теплотою згорання;
E. Стандартною теплотою утворення;
. З точки зору термохімії реакції нейтралізації називаються:
A. Ізохорними.
B. Ізотермічними
C. Ендотермічними
D. *Екзотермічними
E. Політермічними
383. Тепловміст, яким володіє система при сталому тиску, це:
A. Енергія Гібса
B. Внутрішня енергія
C. *Ентальпія
D. Ентропія
E. Теплота утворення
384. Система, компоненти якої знаходяться в різних фазах, називається:
A. Гомогенною
B. Ізольованою
C. Відкритою
D. Закритою
E. *Гетерогенною
385. Система, яка обмінюється з довкіллям енергією, але не обмінюється масою називається:
A. Гомогенною.
B. Ізольованою.
C. Відкритою
D. *Закритою.
E. Гетерогенною.
386. Система, яка не обмінюється з довкіллям ні масою, ні енергією, називається:
A. Гомогенною.
B. *Ізольованою.
C. Відкритою.
D. Закритою.
E. Гетерогенною.
387. Який закон визначає ентропію правильно утвореного кристалу чистої речовини при температур1 абсолютного нуля?
A. Закон Кірхгоффа.
B. Закон Гіббса-Гельмгольца.
C. *Третій закон термодинаміки.
D. Другий закон термодинаміки.
E. Перший закон термодинаміки.
388. У самочинних процесах при сталих температурі і тиску зміна енергії Гібса досягає...
A. Стандартного значення.
B. Від’ємного значення.
C. *Мінімального значення.
D. Нуля.
E. Максимального значення.
389. Не проводячи розрахунків, визначити, в результаті якої реакції ентропія збільшується?
A. *2 СН4 = 3 Н2 + С2Н2
B. 2 SO2 + O2 = 2 SO3
C. 3 Н2 + N2 = 2 NH3
D. Н2 + Сl2 = 2 HCl
E. С2Н2 + Н2 = С2Н4
390. Яка з перерахованих функцій не є термодинамічним потенціалом?
A. Внутрішня енергія.
B. Енергія Гельмгольца.
C. Енергія Гіббса.
D. Ентальпія.
E. *Теплота.
391. Формула dS Q/T є виразом:
A. Рівняня Кірхгоффа.
B. Рівняння Гіббса-Гельмгольца
C. Третього закону термодинаміки.
D. *Другого закону термодинаміки.
E. Першого закону термодинаміки.
392. Не проводячи розрахунків, визначити, в результаті якої реакції ентропія не змінюється?
A. N2O4= 2 NO2
B. 2 SO2 + O2 = 2 SO3
C. *Н2 + Сl2 = 2 HCl
D. 3 Н2 + N2 = 2 NH3
E. 2 СО + О2 = 2 СО2
393. Максимальна корисна робота в ізобарно-ізотермічному процесі дорівнює:
A. Зменшенню ентальпії.
B. Зменшенню енергії Гельмгольца.
C. Збільшенню енергії Гельмгольца.
D. *Зменшенню енергії Гіббса.
E. Збільшенню енергії Гіббса.
394. Стандартний потенціал Гіббса знаходять при умовах:
A. 50 кПа, 298 К.
B. 50 кПа, 273 К.
C. *101,3 кПа, 298 К.
D. 101,3 кПа, 273 К.
E. 101,3 кПа, 0 К.
395. Формула ΔG = ΔH-TΔS є виразом:
A. Рівняня Кірхгоффа.
B. *Ізобарно-ізотермічного потенціалу.
C. Третього закону термодинаміки.
D. Другого закону термодинаміки.
E. Першого закону термодинаміки
396. Ентропія правильно утвореного кристалу чистої речовини при абсолютному нулі є
A. *Дорівнює нулю.
B. Дорівнює одиниці
C. Від’ємна.
D. Мінімальна.
E. Максимальна
397. Який термодинамічний потенціал є критерієм перебігу самочинного процесу при сталих температурі і тиску ?
A. Внутрішня енергія
B. *Енергія Гіббса
C. Енергія Гельмгольца
D. Ентропія
E. Ентальпія.
398. Стандартну ентропію знаходять при умовах:
A. 150 кПа, 298 К.
B. 50 кПа, 273 К.
C. *101,3 кПа, 298 К
D. 101,3 кПа, 273 К
E. 101,3 кПа, 0 К
399. Функцією невпорядкованості (хаотичності руху) системи є:
A. Внутрішня енергія
B. Робота
C. Теплота
D. *Ентропія
E. Ентальпія
400. “Теплота не може самочинно переходити від холодного тіла до гарячого” - це формулювання закону термодинаміки:
A. Постулат Карно.
B. Постулат Томпсона
C. *Другого закону
D. Другий постулат Планка.
E. Першого закону
401. Який з записів найбільш точно відбиває фізичний зміст формули ΔG = ΔH - TΔS:
A. Зменшення вільної енергії залежить від зміни ентальпії в системі
B. Вільна енергія системи дорівнює різниці ентропійного і ентальпійного факторів
C. Тепловий ефект ізобарного процесу менший теплового ефекту ізохорного на величину роботи розширення
D. Тепловий ефект ізобарного процесу залежить від корисної роботи [роботи розширення
E. *Зміна вільної енергії Гіббса в термодинамічній системі дорівнює різниці ентальпійного і ентропійного факторів
402. Енергія Гіббса - це термодинамічний потенціал, який визначається в ... умовах.
A. Ізохорно-ізотермічних
B. *Ізобарно-ізотермічних
C. Ізохорних
D. Ізобаричних
E. Ізотермічних
403. Невпорядкованість і хаос системи характеризує:
A. *Ентропія
B. Внутрішня енергія
C. Ентальпія
D. Енергія Гельмгольца.
E. Енергія Гіббса.
404. Тепловий ефект реакції нейтралізації кислоти HCl основою NaOH:
A. Залежить від послідовності зливання компонентів
B. Визначається окисними властивостями
C. Залежить від природи кислотного залишку
D. Залежить від їх основності
E. *Постійний.
405. Другий закон термодинаміки визначає:
A. *Можливість і напрямок перебігу самочинного процесу
B. Роботу при перебігу самочинного процесу
C. Зміну внутрішньої енергії
D. Тепловий ефект процесу
E. Зміну енергії системи в різних процесах
406. Тепловий ефект, що супроводжує синтез 1 моля складної речовини з простих речовин при стандартних умовах, це
A. Ентальпія
B. Теплота згоряння
C. *Теплота утворення
D. Теплота нейтралізації
E. Теплота розчинення
407. Використовуючи який закон можна розрахувати тепловий ефект реакції, не проводячи безпосередніх вимірювань?
A. *Закон Гесса
B. Закон Кірхгофа
C. Третій закон термодинаміки
D. Другий закон термодинаміки
E. Перший закон термодинаміки
408. Для ізотермічного процесу зміна внутрішньої енергії дорівнюе:
A. Зміні вільної енергії Гібса
B. Зміні ентропії системи
C. Зміні внутрішньої енергії
D. Зміні ентальпії процесу
E. *Нулю
409. Для яких речовин стандартні теплоти утворення ΔН°f рівні нулю?
A. *H2, S
B. NO2, N2H4
C. P2O3, PH3
D. NO, NH3
E. СО2, Н2О
410. Стан системи, який не змінюється в часі при незмінних зовнішніх факторах, називається...
A. Ізохорним.
B. Ізобаричним
C. Ізотермічним
D. Нерівноважним.
E. *Рівноважним.
411. Який з перерахованих параметрів стану є функцією стану?
A. Теплоємність
B. *Внутрішня енергія
C. Температура
D. Об’єм
E. Маса
412. Який з перерахованих параметрів стану є інтенсивним?
A. *Температура
B. ентальпія
C. ентропія
D. енергія Гібба
E. внутрішня енергія
413. Як називається процес, що проходить при незмінних об’ємі і температурі?
A. Ізотермічний.
B. Ізохорний
C. Ізобарний
D. Ізобарно - ізотермічний
E. *Ізохорно - ізотермічний
414. Відкриті термодинамічні системи обмінюються з навколишнім середовищем:
A. Нічим не обмінюються
B. Компонентами.
C. Речовиною і енергією
D. *Енергією.
E. Речовиною
415. Яке твердження відображає закон Гесса?
A. Тепловий ефект реакції не залежить від шляху проходження реакції, а визначається лише початковим і кінцевим станами системи.
B. Тепловий ефект реакції визначається шляхом проходження реакції.
C. Тепловий ефект реакції залежить від проміжних стадій.
D. Тепловий ефект реакції не залежить від кінцевого стану системи.
E. Тепловий ефект реакції не залежить від початкового стану системи.
416. В якому законі стверджується, вічний двигун першого роду неможливий?
A. В законі Кірхгофа
B. В законі Гесса
C. *В третьому законі термодинаміки
D. В другому законі термодинаміки
E. В першому законі термодинаміки.
417. Робота ізотермічного розширення ідеального газу розраховується за рівнянням:
A. A=nRT(V2/V1)
B. A=nRTln(V2/V1)
C. *A=p.V
D. A=p.V
E. A= V.p
418. Для якої речовини стандартна теплота згоряння ΔН°с рівна нулю?
A. NO
B. *P2O5
C. S
D. Н2
E. СО
419. Форма передачі енергії внаслідок невпорядкованого руху молекул - це:
A. Внутрішня енергія.
B. *Теплота
C. Ентальпія.
D. Робота.
E. Випаровування.
420. За яких умов визначають стандартну ентальпію утворення?
A. 50 кПа, 298 К.
B. 150 кПа, 273 К
C. *101,3 кПа, 298 К
D. 101,3 кПа, 273 К
E. 101,3 кПа, 0 К.
421. Як називається процес, що проходить при незмінному об’ємі?
A. Ізотермічний.
B. *Ізохорний
C. Ізобарний
D. Ізобарно - ізотермічний
E. Ізохорно - ізотермічний
422. Закриті термодинамічні системи обмінюються з навколишнім середовищем:
A. Нічим не обмінюються.
B. Компонентами.
C. Речовиною і енергією.
D. *Енергією.
E. Речовиною.
423. Тепловий ефект розчинення 1 моль речовини у великій кількості чистого розчинника, це:
A. Ентальпія.
B. Теплота згоряння.
C. Теплота утворення.
D. Теплота нейтралізації.
E. *Теплота розчинення.
424. Для ізобарного процесу тепловий ефект дорівнюе
A. Зміні вільної енергії Гібса.
B. Зміні ентропії системи.
C. Зміні внутрішньої енергії.
D. *Зміні ентальпії процесу
E. Нулю
425. Для яких речовин стандартні теплоти утворення ΔН°f рівні нулю?
A. NO2, N2H4
B. P2O3, PH3
C. NO, NH3
D. *О2, N2
E. СО, Н2O
426. Кількісна міра хаосу в системі - це
A. Внутрішня енергія.
B. *Ентропія.
C. Ентальпія.
D. Робота.
E. Теплота.
427. Нормальні умови визначаються такими значеннями тиску та температури (параметрами стану):
A. 150 кПа, 298 К.
B. 50 кПа, 273 К.
C. *101,3 кПа, 273 К.
D. 101,3 кПа, 298 К.
E. 101,3 кПа, 0 К.
428. Як називається процес, що проходить при постійній температурі?
A. *Ізотермічний.
B. Ізохорний
C. Ізобарний
D. Ізобарно - ізотермічний
E. Ізохорно - ізотермічний
429. Залежно від кількості фаз термодинамічні системи поділяють на:
A. Рівноважні і нерівноважні.
B. Ізольовані, відкриті, закриті
C. *Гомогенні і гетерогенні.
D. Тверді, рідкі, газоподібні.
E. Екзогенні і ендогенні.
430. Тепловий ефект, що супроводжує окиснення 1 моль речовини газоподібним киснем до оксидів за стандартних умов, це...
A. Ентропія згоряння.
B. *Теплота згоряння.
C. Теплота утворення.
D. Теплота нейтралізації.
E. Теплота розчинення.
431. Якщо реагуючі речовини перебувають у різних фазах, то така реакція:
A. Гомогенна
B. *Гетерогенна
C. Однофазна
D. Ланцюгова
E. Однорідна
432. В якому законі стверджується, що загальний запас енергії залишається незмінним у будь-якій ізольованій системі?
A. В законі Кірхгофа.
B. В законі Гесса.
C. В третьому законі термодинаміки.
D. В другому законі термодинаміки.
E. *В першому законі термодинаміки.
433. Який з записів відображає перший закон термодинаміки?
A. S=dG+A
B. Q=dH+A
C. *Q=U+A
D. Q=A+W
E. dU=dQ+dFA
434. Для ізохорного процесу тепловий ефект рівний:
A. Зміні вільної енергії Гібса.
B. Зміні ентропії системи.
C. *Зміні внутрішньої енергії.
D. Зміні ентальпії процесу
E. Нулю.
435. Для яких речовин стандартні теплоти утворення рівні нулю?
A. NO2, N2H4
B. P2O3, PH3
C. NO, NH3
D. СО2, Н2О.
E. *O2, Н2.
436. Стан системи, який не змінюється в часі при незмінних зовнішніх факторах, називається.
A. *Рівноважним.
B. Ізобарним.
C. Ізотермічним.
D. Нерівноважним.
E. Ізохорним.
437. Стандартні умови визначаються такими значеннями тиску та температури (параметрами стану):
A. 50 кПа, 298 К.
B. 50 кПа, 273 К.
C. *101,3 кПа, 298 К
D. 101,3 кПа, 273 К.
E. 101,3 кПа, 0 К.
439. Залежно від характеру взаємодії з навколишнім середовищем термодинамічні системи поділяють на:
A. Рівноважні і нерівноважні.
B. *Ізольовані, відкриті, закриті
C. Гомогенні і гетерогенні.
D. Одно-, дво-, трикомпонентні
E. Екзогенні і ендогенні.
440. Як змінюється розчинність твердих речовин у воді:
A. Зі зниженням тиску збільшується
B. Зі зниженням температури збільшується
C. Зі збільшенням об'єму знижується
D. З підвищенням температури знижується
E. *З підвищенням температури збільшується
441. Активоване вугілля добре адсорбує
A. Полярні речовини з органічних розчинників
B. Полярні речовини з водних розчинів
C. Неполярні речовини з органічних розчинників
D. *Неполярні речовини з водних розчинів
E. Немає правильної відповіді
442. Силікагель краще адсорбує
A. *Полярні речовини з органічних розчинників
B. Полярні речовини з водних розчинів
C. Неполярні речовини з органічних розчинників
D. Неполярні речовини з водних розчинів
E. Немає правильної відповіді
443. Стосовно води поверхнево-неактивною речовиною є:
A. Валеріанова кислота
B. Пропанова кислота
C. Пропанол
D. *Натрій сульфат
E. Нічого з переліченого
444. Метод сорбційної детоксикації оганізму, в якому адсорбція токсичних речовин відбувається при проходженні сорбенту через відділи системи травлення
A. Лікворосорбція
B. Лімфосорбція
C. Гемосорбція
D. *Ентеросорбція
E. Аплікаційна терапія
445. Метод адсорбційної терапії, що грунтується на очистці крові хворого від токсичних речовин шляхом її пропускання через колонку з адсорбентом, підключену до системи кровообігу
A. Лікворосорбція
B. Лімфосорбція
C. *Гемосорбція
D. Ентеросорбція
E. Аплікаційна терапія
446. У скільки разів поверхнева активність кислоти С3Н7СООН більша, ніж у кислоти С2Н5СООН?
A. 5,5
B. 6
C. 4
D. *3,5
E. 10
447. Яка з кислот має найбільшу поверхневу активність: С5Н11СООН, С3Н7СООН, НСООН,СН3СООН?
A. *С5Н11СООН
B. С3Н7СООН
C. НСООН
D. СН3СООН
E. Немає правильної відповіді
448. У скільки разів поверхнева активність кислоти С4Н9СООН більша, ніж у кислоти С3Н7СООН?
A. 2
B. 4
C. 5
D. *3
E. 9
449. Особливістю будови молекул поверхнево-активних речовин є:
A. Гідрофільність
B. Полярність
C. Гідрофобність
D. Немає правильної відповіді
E. *Дифільність
450. В яких одиницях виражається коефіцієнт Rf у методі розподільчої хроматографії?
A. Cм
B. Cм2
C. Cм3
D. Мм
E. *Безрозмірна величина
451. Онкотичний тиск крові зумовлений:
A. *Високомолекулярними сполуками
B. Натрій хлоридом
C. Глюкозою
D. Сахарозою
E. Кальцій хлоридом
452. При зануренні срібної пластинки у розчин аргентум нітрату переважає процес осадження катіонів металу на пластині. Якого заряду набуває пластинка?
A. Негативного
B. Рівного нулю
C. - 10 В
D. *Позитивного
E. - 2,0 В
453. У стандартному водневому електроді газоподібний водень знаходиться під тиском:
A. 10,13 кПа
B. 101,3 Па
C. *101,3 кПа
D. 1013 Па
E. 1,013 кПа
454. Як зміниться поверхнева активність в гомологічному ряді спиртів, якщо довжину вуглеводневого радикала збільшити на одну групу -СН2- ?
A. Зменшиться у 3 рази
B. *Збільшиться у 3 рази
C. Збільшиться у 5 разів
D. Зменшиться у 2 рази
E. Не зміниться
455. Яка з кислот має найбільшу поверхневу активність?
A. *Пентанова
B. Бутанова
C. Ацетатна
D. Пропіонова
E. Метанова
456. Який з спиртів має найбільшу поверхневу активність?
A. Бутанол
B. Пропанол
C. *Пентанол
D. Етанол
E. Пропанол
457. Золь аргентум йодиду одержано при надлишку калій йодиду. Який з наведених коагулюючих електролітів матиме найменший поріг коагуляції?
A. Калій нітрат
B. Натрій нітрат
C. Цинк нітрат
D. Калій сульфат
E. *Ферум (ІІІ) хлорид
458. Золь цинк сульфіду одержали при надлишку цинк хлориду. Який заряд матимуть гранули цього золю?
A. Негативний
B. Нульовий
C. *Позитивний
D. Немає правильної відповіді
E. Гранул немає
459. При зануренні мідної пластини у розчин CuSO4 переважає процес осадження катіонів металу на пластині. Якого заряду набуває пластинка?
A. Негативного
B. Рівного нулю
C. *Позитивного
D. – 10 мВ
E. – 100 мВ
460. Електрорушійну силу, що виникає між двома електродами, вимірюють за допомогою:
A. Полярографа
B. Міліамперметра
C. *Потенціометра
D. Манометра.
E. Ареометра.
461. Величина електродного потенціалу не залежить від:
A. Стандартного електродного потенціалу
B. Активності іонів металу
C. Температури розчину
D. *Об’єму розчину
E. Кількості іонів металу
462. У стандартному водневому електроді газоподібний водень знаходиться під тиском:
A. 10,13 кПа
B. 101,3 Па
C. *101,3 кПа
D. 1013 Па
E. 1,013 кПа
463. До електродів другого роду належать електрод:
A. *Ag, AgCI / KCI
B. Ag / AgNO3;
C. Cu/ CuSO4
D. Ag/ AgCl
E. Cu/ Cu(ОН)2
464. Величину електродного потенціалу розраховують за рівнянням:
A. Вант-Гоффа
B. Ареніуса
C. Менделєєва – Клайперона
D. *Нернста
E. Бойля – Маріотта
465. Система, в якій хімічна енергія окисно-відновного процесу перетворюється в електричну, називається.
A. Кріоскопом
B. Термостатом
C. *Гальванічним елементом
D. Поляриметром
E. Хімічним елементом
.При якій температурі вимірюється стандартний електродний потенціал?
300 К
273 К
293 К
*298 К
278 К.
. Електрорушійна сила, що виникає між двома електродами, дорівнює:
A. Добутку двох електродних потенціалів
B. Логарифму двох електродних потенціалів
C. *Різниці двох електродних потенціалів
D. Відношенню двох електродних потенціалів
E. Диференціалу електродних потенціалів
. Величина електродного потенціалу дорівнює стандартному електродному потенціалу при активності іонів металу, що дорівнює:
A. *1 моль/л;
B. 0,1 моль/л;
C. 10 моль/л;
D. 0,01 моль/л.
E. 0,001 моль/д
. До електродів першого роду належить електрод:
A. Ag, AgCI/KCI
B. Ag/AgNO3
C. *Ag /AgCl
D. Cu/Cu(ОН)2
E. Ag /KCI
. До електродів 2-го роду належить електрод:
A. *Хлорсрібний
B. Срібний
C. Мідний
D. Залізний
E. Хлормідний
. У склад водневого електрода входить:
A. *Платинова пластина, занурена в розчин сульфатної кислоти
B. Платинова пластина, занурена в розчин хлориду натрію
C. Платинова пластина, занурена в розчин сульфату цинку
D. Платинова пластина, занурена в розчин власних іонів
E. Платинова пластина, занурена в розчин хлоридної кислоти
. Потенціал хлорсрібного електрода залежить від концентрації
A. *Хлорид-іонів
B. Сульфат-іонів
C. Нітрат-іонів
D. Фосфат-іонів
E. Калій-катіонів
. Стандартний електродний потенціал, Е0 вимірюється при умовах:
A. *Концентрація іонів металу 1моль/л при 250С
B. Концентрація іонів металу 0,1моль/л при 250С
C. Концентрація іонів металу 1моль/л при 200С
D. Концентрація іонів металу 1моль/л при 00С
E. Концентрація іонів металу 0,1моль/л при 00С
. До якого типу електродів належить скляний електрод?
A. До електродів 3-го роду
B. До електродів 2-го роду
C. *До мембранних електродів
D. До газових електродів
E. До інертних електродів
. Для вимірювання рН складають гальванічне коло з таких електродів:
A. Срібного і хлорсрібного
B. Платинового і водневого
C. *Скляного і хлорсрібного
D. Мідного і хлорсрібного
E. Залізного і мідного
. Для вимірювання рН забарвлених розчинів найбільш підходить метод
A. Колориметричний
B. Індикаторний
C. *Потенціометричний
D. Кінетичний
E. Термодинамічний
. рН розчину дорівнює 3. Яка концентрація катіонів гідрогену в цьому розчині (моль/л)
A. 0,03
B. 0,1
C. *0,001
D. 0,01
E. 0,3
. рН розчину дорівнює 1. Яка концентрація катіонів гідрогену в цьому розчині
A. *0,1 моль/л
B. 0,02 моль/л
C. 0,01моль/л
D. 0,001 моль/л
E. 0,2 моль/л
. Схематичний запис водневого електрода
A. *Pt, H2/2H+
B. Ме/Меn+
C. Zn/Zn2+
D. H2/2H+
E. Hg/Hg2Cl2, KCl
. Газовим електродом є
A. *Pt, H2/2H+
B. Ag/Ag+
C. Zn/Zn2+
D. Ag/AgCl, KCl
E. Hg/Hg2Cl2, KCl
. Для вимірювання рН каламутних розчинів найбільш підходить метод
A. Колориметричний
B. Індикаторний
C. *Потенціометричний
D. Кінетичний
E. Термодинамічний
. Схематичний запис срібного електрода
A. Pt, Zn/Zn2+
B. *Ag/Ag+
C. Pt/Zn2+
D. Ag/AgCl, KCl
E. Hg/Hg2Cl2, KCl
. Потенціометрія - це:
A. *Фізичний метод дослідження, що ґрунтується на вимірюванні електрорушійної сили
B. Злиття частинок дисперсної фази при втраті агрегатної стійкості
C. Підвищення темп. кипіння розчинів
D. Зниження темп. замерзання розчинів
E. Вимірювання густини розчинів
. Якщо реагенти і продукти реакції знаходяться в одній фазі, то реакція ...
A. *Гомогенна
B. Гетерогенна
C. Багатофазна
D. Неоднорідна
E. Різнофазна
. За правилом Вант-Гоффа: при підвищенні температури швидкість хімічних реакцій:
A. Зменшується
B. Немає правильної відповіді
C. Збільшується
D. *Значно зменшується
E. Не змінюється
. Швидкість хімічних реакцій не залежить від:
A. Температури
B. Дії каталізатора
C. Природи реагуючих речовин
D. *Атмосферного тиску
E. Ступеня дисперсності реагуючих речовин
. Гомогенна система - це:
А. Система, що складається з двох фаз
B. Система, що складається з трьох фаз
C. Сукупність рідкої і твердої фази
D. *Система, що складається з однієї фази
E. Система в склад якої входить вода і лід
. Залежність константи швидкості хімічної реакції від температури виражає рівняння:
A. Менделєєва
B. Нернста
C. *Арреніуса
D. Клапейрона
E. Стану ідеальних газів
. Швидкість хімічної реакції - це:
A. *Зміна концентрації реагуючих речовин за одиницю часу
B. Зміна забарвлення індикатора
C. Виділення теплоти
D. Здатність зберігати стале значення рН
E. Здатність реагуючих речовин проводити електричний струм
. Гетерогенна система - це:
A. Система, що складається з повітря
B. *Система, що складається з двох фаз
C. Система, що складається з газу
D. Система, що складається з однієї фази
E. Система в склад якої входить тільки вода
