
- •Элементы кинематики поступательного и вращательного движения.
- •Динамика поступательного движения.
- •Динамика вращательного движения
- •Элементы специальной теории относительности.
- •Пусть в начальный момент времени начала координат обеих систем и направления соответствующих осей совпадают. Тогда:
- •Основы мкт.
- •Явления переноса. Теплоемкость.
- •30.Среднее число столкновений и средняя длина свободного пробега молекул. Вакуум.
- •Основы термодинамики.
- •Реальные газы.
Основы термодинамики.
33.Термодинамическая система и термодинамические параметры. Равновесные состояния и процессы. Обратимые и необратимые процессы. Изопроцессы и их изображение на термодинамических диаграммах.
Термодинамическая система – часть пространства, выделенная для рассмотрения и отделенная от окружающей среды реальной (межфазовой) или условной границей. Системы могут быть изолированными, закрытыми (замкнутыми) и открытыми. Изолированная система характеризуется постоянством массы m, объема V, энергии U (m=соnst, V= соnst, U= соnst) она не обменивается с окружающей средой ни веществом, ни энергией. Закрытая система обменивается с окружающей средой только энергией и не обменивается веществом (m= соnst, V не соnst, U не соnst). В открытой системе осуществляются оба указанных вида обмена с окружающей средой (m не const, V не соnst, U не соnst).
Состояние системы определяется ее физическими и химическими свойствами (объем, давление, температура, химический состав, внутренняя энергия, энтальпия, энтропия и др.), которые подразделяются на параметры состояния и функции состояния. Параметры состояния – свойства системы, выбранные в качестве независимых переменных. (объем, давление, температура).
Равновесный тепловой процесс — тепловой процесс, в котором система проходит непрерывный ряд бесконечно близких равновесных термодинамических состояний. Равновесный тепловой процесс называется обратимым, если его можно провести обратно и в телах, окружающих систему, не останется никаких изменений. Примеры равновесных процессов(изотермический процесс, изохорный процесс, изобарный процесс, адиабатический процесс).
Обратимыми называются термодинамические процессы, осуществление которых возможно в прямом и обратном направлениях, при том так, что в обратном процессе термодинамическая система проходит через те же равновесные промежуточные состояния, что и в прямом процессе, но только в обратной последовательности. Обязательным условием для протекания обратимых процессов является соблюдение механического равновесия (равенство давлений), теплового равновесия (равенство температур), и отсутствие трения.
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы. Примеры необратимых процессов: диффузия, термодиффузия, теплопроводность, вязкое течение и др.
Изобарный
процесс -
процесс изменения состояния
термодинамической системы при постоянном
давлении (![]() )
)
![]()
Зависимость объёма газа от температуры при неизменном давлении была экспериментально исследована в 1802 году Жозефом Луи Гей-Люссаком. Закон Гей-Люссака: При постоянном давлении и неизменных значениях массы газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
Изохорный
процесс -
процесс изменения состояния
термодинамической системы при постоянном
объёме (![]() ).
Для идеальных газов изохорический
процесс описывается законом
Шарля: для данной массы газа при
постоянном объёме, давление прямо
пропорционально температуре:
).
Для идеальных газов изохорический
процесс описывается законом
Шарля: для данной массы газа при
постоянном объёме, давление прямо
пропорционально температуре:
![]()
Линия, изображающая изохорный процесс на диаграмме, называется изохорой.
Изотермический
процесс -
процесс изменения состояния
термодинамической системы при постоянной
температуре (![]() )().
Изотермический процесс описывается
законом
Бойля - Мариотта:
)().
Изотермический процесс описывается
законом
Бойля - Мариотта:
![]()

34.Работа в термодинамике (работа газа в различных процессах).
Найдем работу, совершаемую газом при изменении его объема. Рассмотрим газ, находящийся под поршнем в цилиндрическом сосуде.
Е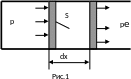 сли
газ, расширяясь, передвигает поршень
на расстояние dx,
то он производит работу против сил
внешнего давления ре:
сли
газ, расширяясь, передвигает поршень
на расстояние dx,
то он производит работу против сил
внешнего давления ре:
 ,где
S
площадь поршня, dV
изменение объема газа. Полная работа
А12,
совершаемая газом при изменении его
объема от V1
до V2:
,где
S
площадь поршня, dV
изменение объема газа. Полная работа
А12,
совершаемая газом при изменении его
объема от V1
до V2:
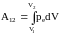 .
.
Если процесс расширения газа является равновесным, т.е. идущим без перепадов давлений и температур, то работа может быть вычислена через давление самого газа (ре=р). Графически работа газа равна площади под кривой процесса на диаграмме PV (рис.2). Если газ совершает круговой процесс (цикл), то работа будет равна площади цикла.
Работа газа при изопроцессах:
1) изохорический
V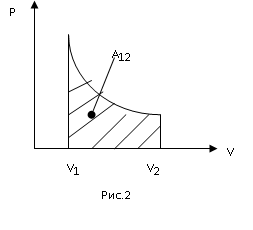 =const,
dV=0,
A12=0;
=const,
dV=0,
A12=0;
2) изотермический T=const,
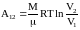 ;
;
3) изобарический р=const,

35.Способы изменения внутренней энергии. Первое начало термодинамики. Применение первого начала термодинамики к изопроцессам и адиабатическому процессу идеального газа.
Способы изменения внутренней энергии - теплопередача и работа.
Первое начало термодинамики - количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы против внешних сил.
 .
.
Для
элементарного количества теплоты,
элементарной работы и малого приращения
(полного дифференциала) внутренней
энергии первый закон термодинамики
имеет вид:
 .
.
Изохорический
процесс (V
= const).
Газ не совершает работу, т.е. A=0.
Из первого начала термодинамики следует,
что вся теплота, сообщаемая газу, идет
на увеличение его внутренней энергии: .
.
Изобарический процесс (p = const). Теплота, сообщаемая газу, идет на приращение внутренней энергии и на совершение работы над внешними телами:
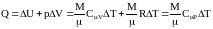 .
.
Изотермический процесс (T = const). Внутренняя энергия газа не изменяется и все количество тепла, сообщаемое газу, расходуется на совершение им работы против внешних сил:
 .
.
Адиабатическим называется процесс, при котором отсутствует теплообмен
(Q
= 0) между физической системой и окружающей
средой. Из первого начала термодинамики
для адиабатического процесса следует,
что
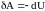 ,
т.е. работа совершается за счет убыли
внутренней энергии системы.
,
т.е. работа совершается за счет убыли
внутренней энергии системы.
 .
.
36.Зависимость теплоёмкости идеального газа от вида процесса.
Теплоемкость тела
В
изотермическом процессе
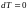 ,
тогда
,
тогда
 .
.
В
изохорном
процессе постоянен объём, то есть
![]() .
Элементарная работа газа равна
произведению изменения объёма на
давление, при котором происходит
изменение (
.
Элементарная работа газа равна
произведению изменения объёма на
давление, при котором происходит
изменение (![]() ).
Первое начало термодинамики для
изохорного процесса имеет вид:
).
Первое начало термодинамики для
изохорного процесса имеет вид:
![]()
А для идеального газа
![]()
Таким образом,
 -
молярная теплоемкость газа при постоянном
объеме.
-
молярная теплоемкость газа при постоянном
объеме.
где
![]() —
число степеней
свободы частиц газа.
—
число степеней
свободы частиц газа.
В изобарном процессе постоянно давление, то есть р=соnst. Первое начало термодинамики для изобарного процесса имеет вид:
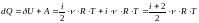 .
.
 -
молярная теплоемкость газа при постоянном
давлении.
-
молярная теплоемкость газа при постоянном
давлении.
где — число степеней свободы частиц газа.
В
адиабатическом
процессе теплообмена с окружающей
средой не происходит, то есть
![]() .
Однако, объём, давление
и температура меняются, то есть
.
Однако, объём, давление
и температура меняются, то есть
![]() .
.
Следовательно,
теплоёмкость идеального газа в
адиабатическом процессе равна нулю:
 .
.
37.Круговой процесс (цикл). Тепловые двигатели и холодильные машины. Цикл Карно и его КПД для идеального газа. Независимость КПД цикла Карно от природы рабочего тела.
К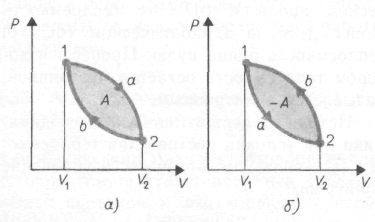 руговым
процессом (или
циклом)
называется
процесс, при котором система, пройдя
через ряд состояний, возвращается в
исходное. На диаграмме процессов цикл
изображается замкнутой кривой (см.рис.
a). Цикл, совершаемый идеальным газом,
можно разбить на процессы расширения
(1–2) и сжатия (2–1) газа. Работа расширения
A1
(определяется площадью фигуры 1 a 2 V1
V2 2)
положительна
(dV>0)), работа сжатия A2
(определяется площадью фигуры 1 a 2 V1
V2 2)
отрицательна
(dV<0), Следовательно, работа A= A1+
A1,
совершаемая газом за цикл, определяется
площадью, охватываемой замкнутой кривой.
Если за
цикл совершается
положительная работа A>0 (цикл протекает
по часовой стрелке), то он называется
прямым (рис.,
а), если за цикл совершается отрицательная
работа A<0 (цикл протекает против часовой
стрелки), то он называется обратным
(рис. b).
руговым
процессом (или
циклом)
называется
процесс, при котором система, пройдя
через ряд состояний, возвращается в
исходное. На диаграмме процессов цикл
изображается замкнутой кривой (см.рис.
a). Цикл, совершаемый идеальным газом,
можно разбить на процессы расширения
(1–2) и сжатия (2–1) газа. Работа расширения
A1
(определяется площадью фигуры 1 a 2 V1
V2 2)
положительна
(dV>0)), работа сжатия A2
(определяется площадью фигуры 1 a 2 V1
V2 2)
отрицательна
(dV<0), Следовательно, работа A= A1+
A1,
совершаемая газом за цикл, определяется
площадью, охватываемой замкнутой кривой.
Если за
цикл совершается
положительная работа A>0 (цикл протекает
по часовой стрелке), то он называется
прямым (рис.,
а), если за цикл совершается отрицательная
работа A<0 (цикл протекает против часовой
стрелки), то он называется обратным
(рис. b).
Прямой цикл используется в тепловых двигателях – периодически действующих двигателях, совершающих работу за счет полученной извне теплоты. Обратный цикл используется в холодильных машинах -периодически действующих установках, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой.
В результате кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии газа равно нулю ( U = 0). В общем случае при протекании кругового процесса система может теплоту как получать Q1, так и отдавать Q2, поэтому теплота, полученная системой Q равна
Q=Q1–Q2
Поэтому из первого начала термодинамики для кругового процесса (когда U= 0) получаем, что работа за цикл равна
А=Q1–Q2 т. е. работа, совершаемая за цикл, равна разности количества полученной извне теплоты Q1 и отданной системой Q2. Поэтому коэффициент полезного действия для кругового процесса (к. п. д.)
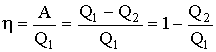
П ринцип
действия теплового двигателя приведен
на рисунке. От термостата с более высокой
температурой Т1,
называемого
нагревателем,
за цикл
отнимается количество теплоты Q1,
а термостату с более низкой температурой
T2 ,
называемому
холодильником,
за цикл
передается количество теплоты Q2,
при этом совершается работа A = Q1
- Q2.
ринцип
действия теплового двигателя приведен
на рисунке. От термостата с более высокой
температурой Т1,
называемого
нагревателем,
за цикл
отнимается количество теплоты Q1,
а термостату с более низкой температурой
T2 ,
называемому
холодильником,
за цикл
передается количество теплоты Q2,
при этом совершается работа A = Q1
- Q2.
Чтобы коэффициент полезного действия теплового двигателя = 1-Q2/Q1 был равен единице ( = 1), должно быть выполнено условие Q2 = 0, т. е. тепловой двигатель должен иметь один источник теплоты, а это невозможно. Так, французский физик и инженер Н. Л. С. Карно (1796—1832) показал, что для работы теплового двигателя необходимо не менее двух источников теплоты с различными температурами.Этот результат положен в основу одной из формулировок второго начала термодинамики по Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу.
Из формулировки второго начала термодинамики по Кельвину следует, что вечный двигатель второго рода – периодически действующий двигатель, совершающий работу за счет охлаждения одного источника теплоты,— невозможен. Процесс, обратный происходящему в тепловом двигателе, используется в холодильной машине, принцип действия которой представлен на рисунке выше. Системой за цикл от термостата с более низкой температурой Т2 отнимается количество теплоты Q2 и отдается термостату с более высокой температурой Т1количество теплоты Q1. Для кругового процесса, согласно 1), Q = А, но, по условию, Q = Q2 - Q1 <0, поэтому А < 0 и Q2 - Q1 = – А, или Q1 = Q2+A, т.е. количество теплоты Q1, отданное системой источнику теплоты при более высокой температуре Т1, больше количества теплоты Q2, полученного от источника теплоты при более низкой температуре Т2 , на величину работы, совершенной над системой. Следовательно, без совершения работы нельзя отбирать теплоту от менее нагретого тела и отдавать ее более нагретому.
Основываясь на втором начале термодинамики, Карно вывел теорему, носящую теперь его имя: из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей (Т1) и холодильников (Т2), наибольшим к. п. д. обладают обратимые машины; при этом к. п. д. обратимых машин, работающих при одинаковых температурах нагревателей (Т1) и холодильников (Т2), равны друг другу и не зависят от природы рабочего тела (тела, совершающего круговой процесс и обменивающегося энергией с другими телами).
К арно
теоретически проанализировал обратимый
наиболее экономичный цикл, состоящий
из двух изотерм и двух адиабат, и
называемый циклом
Карно. Рассмотрим
прямой цикл
Карно, в
котором в качестве рабочего тела
используется идеальный газ, заключенный
в сосуд с подвижным поршнем.
арно
теоретически проанализировал обратимый
наиболее экономичный цикл, состоящий
из двух изотерм и двух адиабат, и
называемый циклом
Карно. Рассмотрим
прямой цикл
Карно, в
котором в качестве рабочего тела
используется идеальный газ, заключенный
в сосуд с подвижным поршнем.
Цикл Карно изображен на рисунке, где изотермические расширение и сжатие заданы соответственно кривыми 1–2 и 3–4, а адиабатические расширение и сжатие – кривыми 2–3 и 4-1.
К.п.д. цикла Карно определяется только температурами нагревателя и холодильника.

Из последнего выражения следует, что КПД тепловой машины, работающей по циклу Карно, зависит только от температур нагревателя и холодильника, но не зависит ни от устройства машины, ни от вида или свойств её рабочего тела. Этот результат составляет содержание первой теоремы Карно. Кроме того, из него следует, что КПД может составлять 100 % только в том случае, если температура холодильника равна абсолютному нулю. Это невозможно, но не из-за недостижимости абсолютного нуля (этот вопрос решается только третьим началом термодинамики, учитывать которое здесь нет необходимости), а из-за того, что такой цикл или нельзя замкнуть, или он вырождается в совокупность двух совпадающих адиабат и изотерм. Поэтому максимальный КПД любой тепловой машины не может превосходить КПД тепловой машины Карно, работающей при тех же температурах нагревателя и холодильника. Это утверждение называется второй теоремой Карно. Оно даёт верхний предел КПД любой тепловой машины и позволяет оценить отклонение реального КПД от максимального, то есть потери энергии вследствие неидеальности тепловых процессов.
38.Энтропия. Принцип возрастания энтропии. Выражение энтропии системы через термодинамически вероятность состояния (формула Больцмана).
Энтропия системы – функция ее состояния. Приращение энтропии равно приведенному количеству тепла, которое нужно сообщить системе, чтобы перевести ее из начального состояния в конечное по любому обратимому процессу.
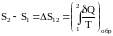 ,
,
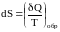 .
.
Важной особенностью энтропии является ее возрастание в изолированных системах (закон возрастания энтропии): «Энтропия теплоизолированной (адиабатической) системы не может убывать; она возрастает, если в системе идет необратимый процесс, и остается постоянной при обратимом процессе в системе».
Необратимые процессы в системе приводят к установлению равновесного состояния. В этом состоянии энтропия изолированной системы достигает максимума и в дальнейшем никакие макроскопические процессы в системе невозможны.
Изменение энтропии при наличии теплообмена с окружающей средой, может быть каким угодно: как больше нуля, так и меньше нуля.
Cогласно Больцману, энтропия cиcтемы и термодинамическая вероятность связаны между собой следующим образом:
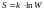
где
 — постоянная Больцмана. Таким образом,
энтропия определяется логарифмом числа
микросостояний, с помощью которых может
быть осуществлено данное макросостояние.
Значит, энтропия может рассматриваться
как мера вероятности состояния
термодинамической системы. Формула
Больцмана позволяет дать энтропии
следующее статистическое толкование:
энтропия является мерой неупорядоченности
системы. Действительно, чем больше число
микросостояний, которые реализуют
данное макросостояние, тем больше
энтропия. В состоянии равновесия -
наиболее вероятного состояния системы
- число микросостояний максимально, при
этом также максимальна и энтропия.
— постоянная Больцмана. Таким образом,
энтропия определяется логарифмом числа
микросостояний, с помощью которых может
быть осуществлено данное макросостояние.
Значит, энтропия может рассматриваться
как мера вероятности состояния
термодинамической системы. Формула
Больцмана позволяет дать энтропии
следующее статистическое толкование:
энтропия является мерой неупорядоченности
системы. Действительно, чем больше число
микросостояний, которые реализуют
данное макросостояние, тем больше
энтропия. В состоянии равновесия -
наиболее вероятного состояния системы
- число микросостояний максимально, при
этом также максимальна и энтропия.
Так как реальные процессы необратимы, то можно говорить, что все процессы в замкнутой системе ведут к увеличению ее энтропии — принцип возрастания энтропии. При статистическом толковании энтропии это означает, что процессы в замкнутой системе идут в направлении увеличения числа микросостояний, другими словами, от менее вероятных состояний к более вероятным, до тех пор, пока вероятность состояния не станет максимальной.
