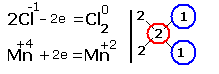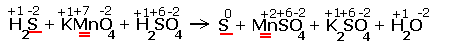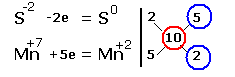- •12 Значение периодической системы
- •Главное квантовое число
- •19 Орбитальное квантовое число
- •Закрепление
- •50 Константа диссоциации
- •Определение
- •[Править]Диссоциация электролитов с многовалентными ионами
- •[Править]Связь константы диссоциации и степени диссоциации
- •История
- •[Править]Уравнения, связывающие pH и pOh [править]Вывод значения pH
- •[Править]pOh
- •[Править]Значения pH в растворах различной кислотности
- •Степень гидролиза
- •Восстановление
- •[Править]Окислительно-восстановительная пара
- •[Править]Виды окислительно-восстановительных реакций
- •[Править]Примеры [править]Окислительно-восстановительная реакция между водородом и фтором
- •[Править]Окисление, восстановление
- •57 Составление уравнений окислительно-восстановительных реакций.
- •58 Важнейшие окислители и восстановители. Классификация окислительно-восстановительных реакций
- •60 Электролиз
[Править]Примеры [править]Окислительно-восстановительная реакция между водородом и фтором
![]()
Разделяется на две полуреакции:
1) Окисление:
![]()
2) Восстановление:
![]()
[Править]Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
![]()
![]()
![]()
![]()
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
![]()
![]()
![]()
![]()
![]()
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
57 Составление уравнений окислительно-восстановительных реакций.
Существуют два метода составления окислительно - восстановительных реакций - метод электронного баланса и метод полуреакций. Здесь мы рассмотрим метод электронного баланса. В этом методе сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, приэтом руководствуемся правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Рассмотрим этот метод на примере.
Расставить
коэффициенты в реакции, схема
которой:
HCl
+ MnO2 |
Алгоритм расстановки коэффициентов |
1.Указываем степени окисления химических элементов.
Подчёркнуты химические элементы, в которых изменились степени окисления. |
2.Составляем электронные уравнения, в которых указываем число отданных и принятых электронов.
За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное ( взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок). Значит перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl2тоже -1. Перед HCl коэффициент 2 не ставим, а считаем число атомов хлора в продуктах реакции. Оно равно - 4.Следовательно и передHCl ставим - 4,уравниваем число атомов водорода и кислорода справа, поставив перед H2O коэффициент - 2. В результате получится химическое уравнение:
|
Рассмотрим более сложное уравнение: |
H2S + KMnO4 + H2SO4 S + MnSO4 + K2SO4 + H2O |
Расставляем степени окисления химических элементов:
|
Электронные уравнения примут следующий вид
Перед серой со степенями окисления -2 и 0 ставим коэффициент 5, перед соединениями марганца -2, уравниваем число атомов других химических элементов и получаем окончательное уравнение реакции |
|
58 Важнейшие окислители и восстановители. Классификация окислительно-восстановительных реакций
Пределы окисления и восстановления элемента выражаются максимальным и минимальным значениями степеней окисления *. В этих крайних состояниях, определяемых положением в таблице Менделеева, элемент имеет возможность проявить только одну функцию – окислителя или восстановителя. Соответственно и вещества, содержащие элементы в этих степенях окисления, являются только окислителями (HNO3, H2SO4, HClO4, KMnO4, K2Cr2O7 и др.) или только восстановителями (NH3, H2S,галогеноводороды, Na2S2O3 и др.). Вещества, содержащие элементы в промежуточных степенях окисления, могут быть как окислителями, так и восстановителями (HClO, H2O2, H2SO3 и др.).
Окислительно-восстановительные реакции разделяются на три основных типа: межмолекулярные, внутримолекулярные и реакции диспропорционирования.
К первому типу относятся процессы, в которых атомы элемента-окислителя и элемента-восстановителя входят в состав разных молекул (примеры см. в разделе 6.1).
Внутримолекулярными называются реакции, в которых окислитель и восстановитель в виде атомов разных элементов находятся в составе одной и той же молекулы. Например, термическое разложение хлората калия по уравнению:
2 KClO3 → 2 KCl + 3 O2
Реакциями диспропорционирования называют процессы, в которых окислителем и восстановителем является один и тот же элемент в одной и той же степени окисления, которая в реакции одновременно как снижается, так и повышается, например:
3 HClO → HClO3 + 2 HCl
Возможны также реакции обратного диспропорционирования. К ним относятся внутримолекулярные процессы, в которых окислителем и восстановителем является один и тот же элемент, но в виде атомов, находящихся в разной степени окисления и выравнивающих ее в результате реакции, например:
NH4NO2 → N2 + 2 H2O.
59 Окислительно-восстановительная двойственность. Внутримо-
лекулярное окисление-восстановление. Соединения высшей степени
окнсленности, присущей данному элементу, могут в окислительно-
восстановительных реакциях выступать только в качестве окисли-
телей, степень окнсленности элемента может в этом случае только
понижаться. Соединения низшей степени окнсленности могут быть,
наоборот, только восстановителями; здесь степень окнсленности
элемента может только повышаться. Если же элемент находится
в промежуточной степени окнсленности, то его атомы могут, в за-
висимости от условий, как принимать, так и отдавать электроны.
В первом случае степень окнсленности элемента будет понижаться,
во втором — повышаться. Поэтому соединения, содержащие эле-
менты в промежуточных степенях окислениости, обладают окис-
лительно-восстановительной двойственностью —
способностью вступать в реакции как с окислителями, так и с вос-
становителями. ?
Так, азот образует соединения, в которых степень его окислениости изменяется от —3 (аммиак и соли аммония) до +5 (азот^ иая кислота и ее соли). Азот, входящий в состав аммиака, может выступать только в качестве восстановителя, азот азотной кислоты— только в качестве окислителя. Азотистая же кислота HNO2 и ее соли, где степень окнсленности азота равна +3, вступают в реакции как с сильными окислителями, так и с сильными восстановителями. В первом случае HNO2 окисляется до азотной кислоты, во втором — восстанавливается обычно до оксида азота NOa
В качестве примеров окислительно-восстановительной двойственности азотистой кислоты можно привести реакции:
5KN02 + 2KMn04 + 3H2S04 ~ 5KN03 + 2MnS04 + K2S04 + 3H20 2HN02 + H2S = 2NO + S + 2H20
Кроме азотистой кислоты окислительно-восстановительной двойственностью обладают сера, иод, пероксид водорода и ряд других веществ.
Вещества, срдержащие элемент в промежуточной степени окисленности, обладают в ряде случаев еще одним характерным свойством. Оно состоит в том, что в определенных условиях такое вещество претерпевает процесс, в ходе которого часть элемента окисляется, а часть — восстанавливается. Этот процесс называется самоокислением-самовосстановлением. Так, при взаимодействии хлора с водой получается смесь соляной и хлорноватистой (НСЮ) кислот:
С1Я + Н20 = НС1 + НСЮ
Здесь и окисление, и восстановление претерпевает хлор; CI2 + 2Н20 = 2НСЮ + 2Н+ + 2е~ (окисление) CI2 -f- 2е~~ = 2СГ (восстановление)
Самоокисление-самовосстановление называют также диспро-» порционированием.
Некоторые сложные вещества в определенных условиях (обычно при нагревании) претерпевают внутримолекулярное окисление-восстановление. При этом процессе одна составная часть вещества служит окислителем, а другая — восстановителем. Примерами внутримолекулярного окисления-восстановления могут служить многие процессы термической диссоциации.