
- •12 Значение периодической системы
- •Главное квантовое число
- •19 Орбитальное квантовое число
- •Закрепление
- •50 Константа диссоциации
- •Определение
- •[Править]Диссоциация электролитов с многовалентными ионами
- •[Править]Связь константы диссоциации и степени диссоциации
- •История
- •[Править]Уравнения, связывающие pH и pOh [править]Вывод значения pH
- •[Править]pOh
- •[Править]Значения pH в растворах различной кислотности
- •Степень гидролиза
- •Восстановление
- •[Править]Окислительно-восстановительная пара
- •[Править]Виды окислительно-восстановительных реакций
- •[Править]Примеры [править]Окислительно-восстановительная реакция между водородом и фтором
- •[Править]Окисление, восстановление
- •57 Составление уравнений окислительно-восстановительных реакций.
- •58 Важнейшие окислители и восстановители. Классификация окислительно-восстановительных реакций
- •60 Электролиз
50 Константа диссоциации
[править]
Материал из Википедии — свободной энциклопедии
Константа
диссоциации —
вид константы
равновесия,
которая показывает склонность большого
объекта диссоциировать(разделяться)
обратимым образом на маленькие объекты,
как например когда комплекс распадается
на составляющиемолекулы,
или когда соль разделяется
в водном растворе на ионы.
Константа диссоциации обычно
обозначается ![]() и обратнаконстанте
ассоциации.
В случае с солями, константу диссоциации
иногда называют константой
ионизации.
и обратнаконстанте
ассоциации.
В случае с солями, константу диссоциации
иногда называют константой
ионизации.
В общей реакции
![]()
где
комплекс ![]() разбивается
на x единиц
A и y единиц
B, константа диссоциации определяется
так:
разбивается
на x единиц
A и y единиц
B, константа диссоциации определяется
так:
![]()
где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
Определение
Электролитическая диссоциация слабых электролитов, согласно теории Аррениуса, является обратимой реакцией, то есть схематически её можно представить уравнениями (для одновалентных ионов:):
KA ↔ K+ + A−,
где:
KA — недиссоциированное соединение;
K+ — катион;
A− — анион.
Константу равновесия такой реакции можно выразить уравнением:
|
(1) |
где:
[KA] — концентрация недиссоциированного соединения в растворе;
[K+] — концентрация катионов в растворе;
[A−] — концентрация анионов в растворе.
Константу равновесия применительно к реакции диссоциации называют константой диссоциации.
[Править]Диссоциация электролитов с многовалентными ионами
В случае диссоциации электролитов с многовалентными ионами, диссоциация происходит по ступеням, причём для каждой ступени существует собственное значение константы диссоциации.
Пример: Диссоциация многоосновной (борной) кислоты[источник не указан 713 дней]:
I стадия: H3BO3 ↔ H+ + H2BO3−,
II стадия: H2BO3− ↔ H+ + HBO32−,
III стадия: HBO32− ↔ H+ + BO33−,
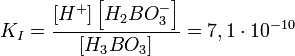
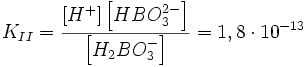
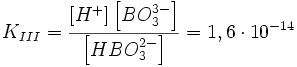
Первая степень диссоциации для таких электролитов всегда много больше последующих, что означает, что диссоциация таких соединений идёт главным образом по первой стадии.
[Править]Связь константы диссоциации и степени диссоциации
Исходя из определения степени диссоциации, для электролита КА в реакции диссоциации [A−] = [K+] = α·c, [KA] = c — α·c = c·(1 — α), где α — степени диссоциации электролита.
Тогда:
|
(2) |
Это выражение называют законом разбавления Оствальда. При очень малых α (α<<1) K=cα² и
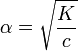 ,
,
таким образом, при увеличении концентрации электролита степень диссоциации уменьшается, при уменьшении — возрастает. Подробнее связь константы диссоциации и степени диссоциации описана в статье Закон разбавления Оствальда.
51
52 Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в егонасыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесиемежду твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
![]()
Константа этого равновесия рассчитывается по уравнению:
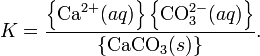
В приближении идеального раствора с учётом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
![]()
Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению:
![]()
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
53 Водоро́дный показа́тель, pH (произносится «пэ аш», английское произношение англ. pH — piː'eɪtʃ «Пи эйч») — мераактивности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активностиводородных ионов, выраженной в молях на литр:
![]()
