- •Химический состав клеток
- •Неорганические вещества и их роль в клетке
- •Углеводы
- •Нуклеиновые кислоты
- •Биологические мембраны, их свойства и функции
- •Цитоплазма
- •Органеллы клетки и их функции
- •Пластический обмен
- •Энергетический обмен
- •Воспроизведение клетки
- •Индивидуальное развитие организмов
- •Особенности метода генетического анализа Менделя
- •Генотип как целостная система
- •Наследственная изменчивость
Предмет, задачи и методы цитологии
Цитология (греч. kytos — ячейка, клетка) — наука о клетке.
Предметом ее изучения является клетка как структурная и функциональная единица жизни.
В задачи цитологии входит изучение строения и функционирования клеток, их химического состава, функций отдельных клеточных компонентов, познание процессов воспроизведения клеток, приспособления к условиям окружающей среды, исследование особенностей строения специализированных клеток, этапов становления их особых функций, развития специфических клеточных структур и др. Для решения этих задач в цитологии используются различные методы.
Основным методом изучения клеток является световая микроскопия. Человеческий глаз обладает разрешающей способнос-тьюоколо 100мкм(1 мкм = 0,001 мм). Это означает, что две точки, расположенн ые на расстоянии менее чем 100 мкм друг от друга, кажутся одной расплывчатой точкой. Чтобы различить более мелкие структуры, применяют оптические приборы, в частности микроскопы. Разрешающая способность микроскопов составляет 0,13—0,20 мкм, т. е. примерно в тысячу раз превышает разрешающую способность человеческого глаза. С помощью световых микроскопов, в которых используется солнечный или искусственный свет, удается выявить многие детали внутреннего строения клетки — отдельные органеллы, клеточную оболочку. Создать световой микроскоп с большим разрешением невозможно, потому что разрешающая способность связана с длиной волны световых лучей, а не только с качеством увеличительных стекол.
Для изучения ультратонкого строения клеточных структур прибегают к методу электронной микроскопии. В электронных микроскопах вместо световых лучей используется пучок электронов. Разрешающая способность современных электронных микроскопов составляет 0,1 нм, поэтому с их помощью выявляют очень мелкие детали. В электронном микроскопе видны биологические мембраны (толщина 6—10 нм), рибосомы (диаметр около 20 нм), микротрубочки (толщина около 25 нм) и другие структуры.
Для исследования химического состава, выяснения локализации отдельных химических веществ в клетке широко используются методы цито- и гистохимии, основанные на избирательном воздействии реактивов и красителей на определенные химические вещества цитоплазмы. Метод дифференциального (разделительного) центрифугирования позволяет разделить с помощью центрифуги содержимое клетки на отдельные разные по массе составляющие и затем детально изучить их химический состав. Метод рентгеноструктурного анализа дает возможность определять пространственное расположение и физические свойства молекул (например, ДНК, белков), входящих в состав клеточных структур.
Для выявления локализации мест синтеза биополимеров, определения путей переноса веществ в клетке широко используется метод авторадиографии — регистрации веществ, меченых радиоактивными изотопами. Многие процессы жизнедеятельности клеток, в частности деление клетки, фиксируют с помощью кино-и фотосъемки.
Изучение клеток разных органов и тканей растений и животных, процессов деления клетки, их дифференцировки и специализации проводят методом клеточных культур — выращиванием клеток (и целых организмов из отдельных клеток) на питательных средах в стерильных условиях.
При исследовании живых клеток, выяснении функций отдельных органелл применяют методы микрохирургии — оперативного воздействия на клетку, связанного с удалением или имплантированием отдельных органелл, их пересаживанием из клетки в клетку, введением в клетку крупных макромолекул и т. д.
Клеточная теория
Клеточная теория была сформулирована в 1839 г. немецким зоологам и физиологом Т. Шванном. Согласно этой теории, всем организмам присуще клеточное строение.Клеточная теория утверждала единство животного и растительного мира, наличие единого элемента тела живого организма — клетки. Как и всякое крупное научное обобщение, клеточная теория не возникла внезапно: ей предшествовали отдельные открытия различных исследователей.
Открытие клетки принадлежит английскому естествоиспытателю Р. Гуку, который в 1665 г. впервые рассмотрел тонкий срез пробки под микроскопом. На срезе было видно, что пробка имеет ячеистое строение, подобно пчелиным сотам. Эти ячейки Р. Гук назвал клетками. Вслед за Гуком клеточное строение растений подтвердили итальянский биолог и врач М. Мальпиги (1675) и английский ботаник Н. Грю (1682). Их внимание привлекли форма клеток и строение их оболочек. В результате было дано представление о клетках как о «мешочках» или «пузырьках», наполненных «питательным соком».
Значительный вклад в изучение клетки внес голландский натуралист, один из основоположников научной микроскопии, А. ван Ле-венгук, открывший в 1674 г. одноклеточные организмы — инфузории, амебы, бактерии. Он также впервые наблюдал животные клетки — эритроциты крови и сперматозоиды.
Дальнейшее усовершенствование микроскопа и интенсивные микроскопические исследования привели к установлению французским ученым Ш. Бриссо-Мирбе (1802, 1808) того факта, что все растительные организмы образованы тканями, которые состоят из клеток. Еще дальше в обобщениях пошел Ж. Б. Ламарк (1809), который распространил идею Бриссо-Мирбе о клеточном строении и на животные организмы.
В начале XIX в. предпринимаются попытки изучения внутреннего содержимого клетки. В 1825 г. чешский ученый Я. Пуркине открыл ядро в яйцеклетке птиц. В 1831 г. английский ботаник Р. Броун впервые описал ядро в клетках растений, а в 1833 г. он пришел к выводу, что ядро является обязательной частью растительной клетки. Таким образом, в это время меняется представление о строении клетки: главным в ее организации стали считать не клеточную стенку, а содержимое.
Наиболее близко к формулировке клеточной теории подошел немецкий ботаник М. Шлейден, который установил, что тело растений состоит из клеток.
Многочисленные наблюдения относительно строения клетки, обобщение накопленных данных позволили Т. Шванну в 1839 г. сделать ряд выводов, которые впоследствии назвали клеточной теорией. Ученый показал, что все живые организмы состоят из клеток, что клетки растений и животных принципиально схожи между собой.
Клеточная теория получила дальнейшее развитие в работах немецкого ученого Р. Вирхова (1858), который предположил, что клетки образуются из предшествующих материнских клеток. В 1874 г. русским ботаником И. Д. Чистяковым, а в 1875 г. польским ботаником Э. Страсбургером было открыто деление клетки — митоз, и, таким образом, подтвердилось предположение Р. Вирхова.
Создание клеточной теории стало важнейшим событием в биологии, одним из решающих доказательств единства живой природы. Клеточная теория оказала значительное влияние на развитие биологии как науки, послужила фундаментом для развития таких дисциплин, как эмбриология, гистология и физиология. Она позволила создать основы для понимания жизни, индивидуального развития организмов, для объяснения эволюционной связи между ними. Основные положения клеточной теории сохранили свое значение и сегодня, хотя более чем за сто пятьдесят лет были получены новые сведения о структуре, жизнедеятельности и развитии клетки.
Клеточная теория включает следующие основные положения:
Клетка — элементарная единица живого, способная к самообновлению, саморегуляции и самовоспроизведению й являющаяся единицей строения, функционирования и развития всех живых организмов.
Клетки всех живых организмов сходны по строению, химическому составу и основным проявлениям жизнедеятельности.
Размножение клеток происходит путем деления исходной материнской клетки.
В многоклеточном организме клетки специализируются по функциям и образуют ткани, из которых построены органы и их системы, связанные между собой межклеточными, гуморальными и нервными формами регуляции
Белки
Аминокислоты — структурные компоненты белков.Белки, или протеины (греч. protos — первостепенный), — это биологические гетерополимеры, мономерами которых являются аминокислоты.
Аминокислоты представляют собой низкомолекулярные органические соединения, содержащие карбоксильную (-СООН) и аминную (-NH2) группы, которые связаны с одним и тем же атомом углерода. К атому углерода присоединяется боковая цепь — какой-либо радикал, придающий каждой аминокислоте определенные свойства. Общая формула аминокислот имеет вид:
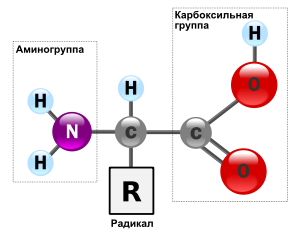
У большей части аминокислот имеется одна карбоксильная группа и одна аминогруппа; эти аминокислоты называютсянейтральными. Существуют, однако, и основные аминокислоты — с более чем одной аминогруппой, а также кислые аминокислоты — с более чем одной карбоксильной группой.
Известно около 200 аминокислот, встречающихся в живых организмах, однако только 20 из них входят в состав белков. Это так называемые основные, или белокобразующие (протеиногенные), аминокислоты.
В зависимости от вида радикала основные аминокислоты делят на три группы: 1) неполярные (аланин, метионин, валин, про-лин, лейцин, изолейцин, триптофан, фенилаланин); 2) полярные незаряженные (аспарагин, глутамин, серии, глицин, тирозин, треонин, цистеин); 3) полярные заряженные (аргинин, гистидин, лизин — положительно; аспарагиновая и глутаминовая кислоты — отрицательно).
Боковые цепи аминокислот (радикал) могут быть гидрофобными или гидрофильными, что придает белкам соответствующие свойства, которые проявляются при образовании вторичной, третичной и четвертичной структур белка.
У растений все необходимые аминокислоты синтезируются из первичных продуктов фотосинтеза. Человек и животные не способны синтезировать ряд протеиногенных аминокислот и должны получать их в готовом виде вместе с пищей. Такие аминокислоты называются незаменимыми. К ним относятся лизин, валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, метионин; атакже аргинин и гистидин — незаменимые для детей,
В растворе аминокислоты могут выступать в роли как кислот, так и оснований, т. е. они являются амфотерными соединениями. Карбоксильная группа -СООН способна отдавать протон, функционируя как кислота, а аминная - NH2 — принимать протон, проявляя таким образом свойства основания.
Пептиды. Аминогруппа одной аминокислоты способна вступать в реакцию с карбоксильной группой другой аминокислоты.
Образующаяся при этом молекула представляет собой дипептид, а связь -CO-NH- называется пептидной связью:
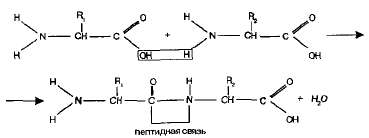
На одном конце молекулы дипептида находится свободная аминогруппа, а на другом — свободная карбоксильная группа. Благодаря этому дипептид может присоединять к себе другие аминокислоты, образуя олигопептиды. Если таким образом соединяется много аминокислот (более десяти), то получается полипептид.
Пептиды играют важную роль в организме. Многие олиго- и полипептиды являются гормонами, антибиотиками, токсинами.
К олигопептидам относятся окситоцин, вазопрессин, тиреотропин, а также брадикинин (пептид боли) и некоторые опиаты («естественные наркотики» человека), выполняющие функцию обезболивания. Принятие наркотиков разрушает опиатную систему организма, поэтому наркоман без дозы наркотиков испытывает сильную боль — «ломку», которая в норме снимается опиатами. К олигопептидам относятся и некоторые антибиотики (например, грамицидин S).
Многие гормоны (инсулин, адренокортикотропный гормон и др,), антибиотики (например, грамицидин А), токсины (например, дифтерийный токсин) являются полипептидами.
Белки представляют собой полипептиды, в молекулу которых входит от пятидесяти до нескольких тысяч аминокислот с относительной молекулярной массой свыше 10 000.
Структура белков. Каждому белку в определенной среде свойственна особая пространственная структура. При характеристике пространственной (трехмерной) структуры выделяют четыре уровня организации молекул белков (рис. 1,1).
лиэ—глу—тре—ала—ала—ала—лиз—фен—глу—арг—глн—гиc—мет—асп—сер— сер—тре—сер—ала—ала—сер—сер—сер—асн—тир—цис—асн—глу—мет—мет— лиз—сер—арг—асн—лей—тре—лиз—асп—арг—цис—лиз—про—вал—асн—тре— фен-—вал—гис—глу—сер—лей—ала—асп—вал—глн—ала—вал—цис—сер—глн— лиз—асн—вал—ала—цис—лиз—асн—гли—глн—тре—асн—цис—три—глн—сер— три—сер—тре—мет—сер—иле—тре—асп—цис—арг—глу—тре—гли—сер—сер- лиэ—тир—про—асн—цис—ала—тир—лиэ—тре—тре—глн—ала—асн—лиз—гис— иле—иле—вал—ала—цис—глу—гли—асн—про—тир—вал—про—вал—гис—фен— асп—ала—сер—вал |
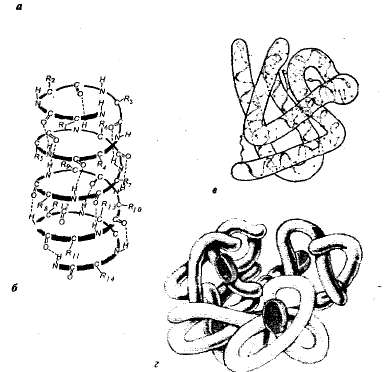
Рис. 1.1. Уровни структурной организации белка: а — первичная структура — аминокислотная последовательность белкарибонуклеазы (124 аминокислотных звена); б — вторичная структура — пояипептидная цепь закручена в виде спирали; в— третичная структура белка миоглобина; г — четвертичная структура гемоглобина.
Первичная структура — последовательность аминокислот в полипептидной цепи. Такая структура специфична для каждого белка и определяется генетической информацией, т. е. зависит от последовательности нуклеотидов в участке молекулы ДНК, кодирующем данный белок. От первичной структуры зависят все свойства и функции белков. Замена одной-единственной аминокислоты в составе молекул белка или нарушение порядка в их расположении обычно влечет за собой изменение функции белка.
Учитывая, что в состав белков входит 20 видов аминокислот, число вариантов их комбинаций в полипептидной цепи поистине безгранично, что обеспечивает огромное количество видов белков в живых клетках. Например, в организме человека обнаружено более 10 тыс. различных белков, и все они построены из одних и тех же 20 основных аминокислот.
В живых клетках молекулы белков или отдельные их участки представляют собой не вытянутую цепь, а скручены в спираль, напоминающую растянутую пружину (это так называемая а-спираль), или сложены в складчатый слой (р-слой). Такие а-спирали и р-слои являются вторичной структурой. Она возникает в результате образования водородных связей внутри одной полипептидной цепи (спиральная конфигурация) или между двумя полипептидными цепями (складчатые слои).
Полностью a-спиральную конфигурацию имеет белок кератин. Это структурный белок волос, ногтей, когтей, клюва, перьев и рогов; он входит в состав наружного слоя кожи позвоночных.
У большинства белков спиральные и неспиральные участки полипептидной цепи складываются в трехмерное образование шаровидной формы — глобулу (характерна для глобулярных белков). Глобула определенной конфигурации является третичной структурой белка. Такая структура стабилизируется ионными, водородными, ковалентными дисульфидными связями (образуются между атомами серы, входящими в состав цистеи-на, цистина и мегионина), а также гидрофобными взаимодействиями. Наиболее важными в возникновении третичной структуры являются гидрофобные взаимодействия; белок при этом свертывается таким образом, что его гидрофобные боковые цепи скрыты внутри молекулы, т. е. защищены от соприкосновения с водой, а гидрофильные боковые цепи, наоборот, выставлены наружу.
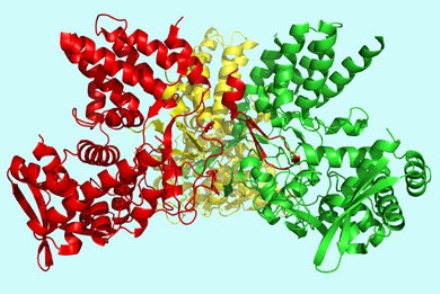
Многие белки с особо сложным строением состоят из нескольких полипептидных цепей (субъединиц), образуя четвертичную структуру белковой молекулы. Такая структура имеется, например, у глобулярного белка гемоглобина. Его молекула состоит из четырех отдельных полипептидных субъединиц (протомеров), находящихся в третичной структуре, и небелковой части — гема.
Только в такой структуре гемоглобин способен выполнять свою транспортную функцию.
Под влиянием различных химических и физических факторов (обработка спиртом, ацетоном, кислотами, щелочами, высокой температурой, облучением, высоким давлением и т. д.) происходит изменение вторичной, третичной и четвертичной структур белка вследствие разрыва водородных и ионных связей. Процесс нарушения нативной (естественной) структуры белка называетсяденатурацией. При этом наблюдается уменьшение растворимости белка, изменение формы и размеров молекул, потеря ферментативной активности и т. д. Процесс денатурации может быть полным или частичным. В некоторых случаях переход к нормальным условиям среды сопровождается самопроизвольным восстановлением естественной структуры белка. Такой процесс называется ренатурацией.
Простые и сложные белки. По химическому составу выделяют белки простые и сложные. К простьм относятся белки, состоящие только из аминокислот, а к сложный — белки, содержащие белковую часть и небелковую (простетическую); простетическую группу могут образовывать ионы металлов, остаток фосфорной кислоты, углеводы, липиды и др. Простыми белками являются сывороточный альбумин крови, фибрин, некоторые ферменты (трипсин) и др. К сложным белкам относятся все протеолипиды и гликопротеины; сложными белками являются, например, иммуноглобулины (антитела), гемоглобин, большинство ферментов и т. д.
Функции белков.
Структурная. Белки входят в состав клеточных мембран и матрикса органелл клетки. Стенки кровеносных сосудов, хрящи, сухожилия, волосы, ногти, когти у высших животных состоят преимущественно из белков.
Каталитическая (ферментативная). Белки-ферменты катализируют протекание всех химических реакций в организме. Они обеспечивают расщепление питательных веществ в пищеварительном тракте, фиксацию углерода при фотосинтезе и т. д.
Транспортная. Некоторые белки способны присоединять и переносить различные вещества. Альбумины крови транспортируют жирные кислоты, глобулины -— ионы металлов и гормоны, гемоглобин — кислород и углекислый газ. Молекулы белков, входящие в состав плазматической мембраны, принимают участие в транспортировке веществ в клетку.
Защитная. Ее выполняют иммуноглобулины (антитела) крови, обеспечивающие иммунную защиту организма. Фибриноген и тромбин участвуют в свертывании крови и предотвращают кровотечение.
Сократительная. Благодаря скольжению относительно друг друга актиновых и миозиновых протофибрилл происходит сокращение мышц, а также немышечные внутриклеточные сокращения. Движение ресничек и жгутиков связано со скольжением относительно друг друга микротрубочек, имеющих белковую природу.
Регуляторная. Многие гормоны являются олигопептидами или бедками (например, инсулин, глюкагон [антагонист инсулина], адренокортикотропный гормон и др.).
Рецепторная. Некоторые белки, встроенные в клеточную мембрану, способны изменять свою структуру под воздействием внешней среды. Так происходит прием сигналов извне и передача информации в клетку. Примером может служить фито-хром —- светочувствительный белок, регулирующий фотопериодическую реакцию растений, и опсин — составная часть родопсина,пигмента, находящегося в клетках сетчатки глаза.
Энергетическая. Белки могут служить источником энергии в клетке (после их гидролиза). Обычно белки расходуются на энергетические нужды в крайних случаях, когда исчерпаны запасы углеводов и жиров.
Ферменты (энзимы). Это специфические белки, которые присутствуют во всех живых организмах и играют роль биологических катализаторов.
Химические реакции в живой клетке протекают при определенной температуре, нормальном давлении и соответствующей кислотности среды. В таких условиях реакции синтеза или распада веществ протекали бы в клетке очень медленно, если бы они не подвергались воздействиям ферментов. Ферменты ускоряют реакцию без изменения ее общего результата за счет сниженияэнергии активации, т. е. при их присутствии требуется значительно меньше энергии для придания реакционной способности молекулам, которые вступают в реакцию, или реакция идет по другому пути с меньшим энергетическим барьером.
Все процессы в живом организме прямо или косвенно осуществляются с участием ферментов. Например, под их действием составные компоненты пищи (белки, углеводы, липиды и др.) расщепляются до более простых соединений, а из них уже затем синтезируются новые, свойственные данному виду макромолекулы. Поэтому нарушения образования и активности ферментов нередко ведут к возникновению тяжелых болезней.
По пространственной организации ферменты состоят из нескольких пол и пептидных цепей и обычно обладают четвертичной структурой. Кроме того, ферменты могут включать и небелковые структуры. Белковая часть носит название апофермент, а небелковая — кофактор (если это катионы или анионы неорганических веществ, например, Zn2- Мп2+и т. д.) или кофермент (коэнзим) (если это низкомолекулярное органическое вещество).
Предшественниками или составными частями Многих кофер-ментов являются витамины. Так, пантотеновая кислота — составная часть коэнзима А, никотиновая кислота (витамин РР) — предшественник НАД и НАДФ и т. д.
Ферментативный катализ подчиняется тем же законам, что и неферментативный катализ в химической промышленности, однако в отличие от него характеризуется необычайно высокой степенью специфичности (фермент катализирует только одну реакцию или действует только на один тип связи). Этим обеспечивается тонкая регуляция всех жизненно важных процессов (дыхание, пищеварение, фотосинтез и др.), протекающих в клетке и организме. Например, фермент уреаза катализирует расщепление лишь одного вещества — мочевины (H2N-CO-NH2 + Н2 О —> —» 2NH 3 + СО2), не оказывая каталитического действия на структурно-родственные соединения.
Для понимания механизма действия ферментов, обладающих высокой специфичностью, очень важна теория активного центра.Согласно ей, в молекуле каждого фермента имеется одни участок или более, в которых происходит катализ за счет тесного (во многих точках) контакта между молекулами фермента и специфического вещества (субстрата). Активным центром выступает или функциональная группа (например, ОН-группа серина), или отдельная аминокислота. Обычно же для каталитического действия необходимо сочетание нескольких (в среднем от 3 до 12) расположенных в определенном порядке аминокислотных остатков. Активный центр также формируется связанными с ферментом ионами металлов, витаминами и другими соединениями небелковой природы — коферментами, или кофакторами. Причем форма и химическое строение активного центра таковы, что с ним могут связываться только определенные субстраты в силу их идеального соответствия (взаимодополняемости или. комплементарности) друг другу. Роль остальных аминокислотных остатков в крупной молекуле фермента состоит в том, чтобы обеспечить его молекуле соответствующую глобулярную форму, которая нужна для эффективной работы активного центра. Кроме того, вокруг крупной молекулы фермента возникает сильное электрическое поле. В таком поле становится возможной ориентация молекул субстрата и приобретение ими асимметричной формы. Это приводит к ослаблению химических связей, и катализируемая реакция происходит с меньшей начальной затратой энергии, а следовательно, с намного большей скоростью. Например, одна молекула фермента каталазы может расщепить за 1 мин более 5 млн. молекул пероксида водорода (Н202), который возникает при окислении в организме различных соединений.
У некоторых ферментов в присутствии субстрата конфигурация активного центра претерпевает изменения, т. е. фермент ориентирует свои функциональные группы таким образом, чтобы обеспечить наибольшую каталитическую активность.
На заключительном этапе химической реакции фермент-субстратный комплекс разъединяется с образованием конечных продуктов и свободного фермента. Освободившийся при этом активный центр может принимать новые молекулы субстрата.
Скорость ферментативных реакций зависит от многих факторов: природы и концентрации фермента и субстрата, температуры, давления, кислотности среды, наличия ингибиторов и т. д. Например, при температурах, близких к нулю, скорость биохимических реакций замедляется до минимума. Это свойство широко используется в различных отраслях народного хозяйства, особен-но в сельском хозяйстве и медицине. В частности, консервация различных органов (почек, сердца, селезенки, печени) перед их пересадкой больному происходит при охлаждении с целью снижения интенсивности биохимических реакций и продления времени жизни органов. Быстрое замораживание пищевых продуктов предотвращает рост и размножение микроорганизмов (бактерий, грибов и др.), атакже инактивирует их пищеварительные ферменты, так что они оказываются уже не в состоянии вызвать разложение пищевых продуктов.
Химический состав клеток
Макроэлементы, их роль в клетке. В клетках разных организмов обнаружено около 70 элементов периодической системы элементов Д. И. Менделеева, но лишь 24 из них имеют вполне установленное значение и встречаются постоянно во всех типах клегок.
Наибольший удельный вес в элементном составе клетки приходится на кислород, углерод, водород и азот. Это так называемые основные, или биогенные, элементы. Атомы этих элементов образуют молекулы всех органических веществ клеток; на их долю приходится более 95% массы клеток, причем относительное содержание элементов в живом веществе намного выше, чем в земной коре. К главным элементам органических молекул относятся также фосфор и сера.
Жизненно важными являются, кроме того, кальций, магний, калий, натрий и хлор (в клетках животных), входящие в состав клетки в виде ионов. Их содержание в клетке исчисляется десятыми и сотыми долями процента. Перечисленные элементы составляютгруппу макроэлементов.
Ионы кальция принимают участие в регуляции ряда клеточных процессов, в том числе мышечного сокращения и других двигательных функций, а также в свертывании крови. Нерастворимые соли кальция участвуют в формировании костей и зубов, карбонат кальция — в образовании раковин моллюсков, укреплении оболочек клеток некоторых видов растений. Концентрация ионов магния важна для поддержания целостности и функционирования рибосом. Кроме того, магний входит в состав хлорофилла и поддерживает нормальную работу митохондрий.
Ионы калия и натрия участвуют в поддержании определенной ионной силы и создании буферной среды, регулируют осмотическое давление в клетке, обусловливают нормальный ритм сердечной деятельности, обеспечивают передачу нервного импульса. Хлор в виде анионов участвует в создании солевой среды животных организмов (для растений хлор является микроэлементом) и, кроме того, иногда входит в состав органических соединений.
Микроэлементы, их роль в клетке. Другие химические элементы — медь, марганец, железо, кобальт, цинк, а также (для некоторых организмов) бор, фтор, хром, селен, алюминий, кремний, молибден и иод —- содержатся в небольших количествах (не более 0,01% массы клеток). Они относятся к группе микроэлементов.
Процентное содержание в организме того или иного элемента никоим образом не характеризует степень его важности и необходимости в организме. Кобальт, например, входит в состав витамина В12, иод — в состав гормонов тироксина и тиронина, а медь — в состав ферментов, катализирующих окислительно-восстановительные процессы; кроме того, медь участвует в переносе кислорода в тканях моллюсков. Железо является составной частью комплексов, выполняющих ряд жизненно важных функций. К ним относятся, например, гем гемоглобина, некоторые ферменты и переносчики электронов (цитохром С).
Значительное число ферментов с разнообразным механизмом действия содержат ионы цинка, марганца, кобальта и молибдена.
Кремний встречается у диатомовых водорослей, хвощей, губок и моллюсков. В хрящах и связках позвоночных животных его содержание может достигать нескольких сотых долей процента.
Бор влияет на рост растений, фтор входит в состав эмали зубов и костей.