
- •Методическое пособие Самостоятельная внеаудиторная работа по дисциплине «Химия» для технических специальностей
- •Раздел 1 общая и неорганическая химия Тема 1.1 Основные понятия и законы химии
- •Задание №1. Составьте схему электронного строения, электронную и графическую формулы атомов следующих элементов:
- •Тема 1.3 Строение вещества
- •Тема 1.4 Вода. Растворы. Электролитическая диссоциация
- •Тема 1.5 Классификация неорганических соединений и их свойства
- •Классификация солей
- •Тема 1.6 Химические реакции
- •Правило смещения химического равновесия под влиянием внешних условий Ле Шателье (1884 г.)
- •Задание №2. При повышении температуры на 10ºС скорость химической реакции возрастает в 2 раза. При 20ºС она равна 0,04 . Какова будет скорость этой реакции при: а) 40ºС, б) 10ºС, в) 0ºС, г) 20ºС?
- •Задание №5. Напишите электронные уравнения, расставьте коэффициенты и укажите восстановитель и окислитель в следующих реакциях:
- •Тема 1.7 Металлы и неметаллы
- •1) Металлы реагируют с простыми веществами:
- •Положение в периодической системе
- •1) Взаимодействие неметаллов с простыми веществами
- •2) Взаимодействие со сложными веществами:
- •Задание №1. Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:
- •Задание №2.Составьте уравнение овр с участием галогенов:
- •Задание №3.Напишите уравнения реакций, с помощью которых можно осуществить цепь следующих превращений:
- •Раздел 2 органическая химия
- •Тема 2.1 Основные понятия органической химии и теория строения органических соединений
- •Тема 2.2 Углеводороды и их природные источники
- •Тема 2.3 Кислородосодержащие органические соединения
- •Тема 2.4 Азотсодержащие органические соединения. Полимеры
- •Раздел 1 «Общая и неорганическая химия»
- •1 Семестр
- •1 Семестр
- •Раздел 2 «Органическая химия»
- •2 Семестр
- •2 Семестр
- •Список использованных источников
Задание №5. Напишите электронные уравнения, расставьте коэффициенты и укажите восстановитель и окислитель в следующих реакциях:
а) Mg+H2SO4=MgSO4+H2, б) Zn+CuCl2=ZnCl2+Cu,
в) H2+J2=HJ, г) O2+Na2SO3=Na2SO4.
Задание №6. Методом электронного баланса подберите коэффициенты в схемах ОВР:
а) FeCl3+KJ=FeCl2+J2+KCl,
б) S+KOH=K2S+K2SO3+H2O,
в) MnS+НNО3=MnSO4+NO2+H2O
Тема 1.7 Металлы и неметаллы
Металлы – это химические элементы, атомы которых отдают электроны внешнего (некоторые – и предвнешнего) электронного слоя, превращаясь в положительные ионы – катионы. Металлы легко отдают валентные электроны, т.е. обладают восстановительными свойствами. Восстановительная способность – мера их химической активности.
Химические свойства металлов:
1) Металлы реагируют с простыми веществами:
а) с галогенами (элементы VII группы)
2Na+J2 ® 2NaJ – йодид натрия
б) с элементами VI группы
2Mg+O2 ® 2MgO – оксид магния
Ca+S ® CaS – сульфид кальция
в) с элементами V группы
3Ca+2P
®
![]() - фосфид
кальция
- фосфид
кальция
3Ca+N2
®
3![]() - нитрид
кальция
- нитрид
кальция
г) с элементами IV группы
Са+2С ® СаС2 – карбид кальция
д) щелочные и щелочно-земельные металлы реагируют с водородом
2Na+H2
![]() 2NaH
– гидрид
натрия
2NaH
– гидрид
натрия
2) металлы реагируют со сложными веществами:
а) металлы вытесняют Н из разбавленных кислот (кроме HNO3)
Ba+2HCl ® BaCl2 + H2
разб.
Fe + H2SO4 ® FeSO4 + H2
разб.
C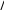 u+HCl
®
u+HCl
®
б) с водой (с образованием гидроксидов)
2Na+2H2O ® 2NaOH+H2 (при обычной температуре только щелочные и щелочно-земельные металлы)
Zn+H2O ZnO+ H2
в) с солями
Fe+CuSO4 ® FeSО4+Cu¯
Zn+Pb(NO3)2 ® Pb¯+Zn(NO3)2.
Неметаллы – это химические элементы для атомов, которых характерна способность принимать электроны до завершения внешнего энергетического уровня, так как:
- на внешнем электронном слое от 4 до 8 ē,
- малый радиус атомов в сравнении с атомами металлов.
Всего известно 22 неметалла.
Исключение:
элементы 8 главной группы – инертные
газы. Они относятся к неметаллам по
физическим свойствам. Их инертность
относительна:
![]() ,
,
![]() .
Неметаллы обладают высокими значениями
ЭО.
.
Неметаллы обладают высокими значениями
ЭО.
Положение в периодической системе
1 2 3 4 5 6 7 8 группа
1 Н Не
Н Не

2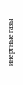 В С N O F Ne
В С N O F Ne
3 Si P S Cl Ar
4 As Se Br Kr
5 Te J Xe
неметаллы -
6 p элементы At Rn
кроме: Н, Не – S-элементы
Химические свойства неметаллов:
1) Взаимодействие неметаллов с простыми веществами



 -2e
+2e
-2e
+2e
1) S
+ Cl2
®
![]() 1)
S0
+ H2
®
1)
S0
+ H2
®
![]()
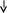 с галогенами с
водородом
с галогенами с
водородом
-4e +2e
2) S
+ O2
®
![]() 2)
S0
+ Ca0
®
2)
S0
+ Ca0
®
![]()
с кислородом с Ме

Неметаллы могут проявлять как окислительные, так и восстановительные свойства.
2) Взаимодействие со сложными веществами:
1) Cl2 + CO ® COCl2
2) C + 2CuO ® CO2 + 2Cu¯
3) Cl2 + 2NaJ ® 2NaCl + J2
4) 2F2 + 2H2O ® 2HF + O2
5) 4NH3 + 5O2 ® 4NO + 6H2O
Восстановительные свойства не присущи только фтору.
Задание №1. Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:
а) MnO2→MnCl2→Mn→MnSO4→Mn(OH)2 ,
б) Cu(OH)2→CuO→Cu(NO3)2→CuS,
↓
Cu(OH)2
в) Ni→NiSO4→Ni(NO3)2→Ni(OH)2 ,
↓
Ni
