
- •Методическое пособие Самостоятельная внеаудиторная работа по дисциплине «Химия» для технических специальностей
- •Раздел 1 общая и неорганическая химия Тема 1.1 Основные понятия и законы химии
- •Задание №1. Составьте схему электронного строения, электронную и графическую формулы атомов следующих элементов:
- •Тема 1.3 Строение вещества
- •Тема 1.4 Вода. Растворы. Электролитическая диссоциация
- •Тема 1.5 Классификация неорганических соединений и их свойства
- •Классификация солей
- •Тема 1.6 Химические реакции
- •Правило смещения химического равновесия под влиянием внешних условий Ле Шателье (1884 г.)
- •Задание №2. При повышении температуры на 10ºС скорость химической реакции возрастает в 2 раза. При 20ºС она равна 0,04 . Какова будет скорость этой реакции при: а) 40ºС, б) 10ºС, в) 0ºС, г) 20ºС?
- •Задание №5. Напишите электронные уравнения, расставьте коэффициенты и укажите восстановитель и окислитель в следующих реакциях:
- •Тема 1.7 Металлы и неметаллы
- •1) Металлы реагируют с простыми веществами:
- •Положение в периодической системе
- •1) Взаимодействие неметаллов с простыми веществами
- •2) Взаимодействие со сложными веществами:
- •Задание №1. Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:
- •Задание №2.Составьте уравнение овр с участием галогенов:
- •Задание №3.Напишите уравнения реакций, с помощью которых можно осуществить цепь следующих превращений:
- •Раздел 2 органическая химия
- •Тема 2.1 Основные понятия органической химии и теория строения органических соединений
- •Тема 2.2 Углеводороды и их природные источники
- •Тема 2.3 Кислородосодержащие органические соединения
- •Тема 2.4 Азотсодержащие органические соединения. Полимеры
- •Раздел 1 «Общая и неорганическая химия»
- •1 Семестр
- •1 Семестр
- •Раздел 2 «Органическая химия»
- •2 Семестр
- •2 Семестр
- •Список использованных источников
Задание №1. Составьте схему электронного строения, электронную и графическую формулы атомов следующих элементов:
а) неон, б) цинк, в) магний, г) кальций, д) аргон, е) алюминий.
Задание №2. Напишите электронные формулы:
а) калия, б) селена, в) скандия, г) кремния, д) ванадия, е) хрома.
Задание №3. Дайте характеристику химического элемента:
а) № 11, б) № 14, в) № 13, г) № 17, д) № 16, е) № 12.
При характеристике химического элемента следует придерживаться следующего плана:
1. Положение элемента в ПСХЭ Д.И.Менделеева и строение его атома.
2. Характер простого вещества – металл, неметалл или переходный металл.
3. Сравнение свойств заданного простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами.
4. Сравнение свойств заданного простого вещества со свойствами простых веществ, образованных соседними по периоду элементами.
5. Состав высшего оксида, его характер (основный, кислотный, амфотерный).
6. Состав высшего гидроксида, его характер (кислота, основание, амфотерный гидроксид).
Тема 1.3 Строение вещества
Химическая связь – взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. Химическая связь может быть внутримолекулярной и межмолекулярной.

Ковалентная химическая связь (1916 г., Льюис) – связь, образующаяся между атомами за счет образования общих электронных пар, это двухэлектронная связь, принадлежащая одновременно ядрам двух атомов.
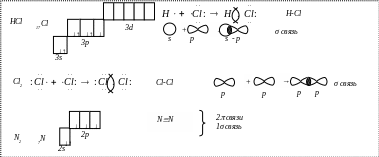
σ-связь – сигма - связь, при которой перекрывание электронных облаков происходит вдоль прямой, соединяющей центры взаимодействующих атомов.
В молекуле азота общая электронная пара образуется за счет σ-связи, а 2 общие электронные пары за счет π-связи.
π-связь – пи – связь, боковое перекрывание двух р - орбиталей в двух областях с образованием двух максимумов электронной плотности по обе стороны от плоскости образования сигма - связи.
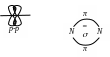
Неполярная ковалентная связь – связь, образующаяся между атомами неметаллов с одинаковой электроотрицательностью (в молекулах простых веществ).
Полярная ковалентная связь – связь между атомами, электроотрицательность которых не сильно различается, при этом происходит смещение общей электронной пары к наиболее электроотрицательному атому (между атомами различных неметаллов).
Ионная химическая связь – связь, образовавшаяся за счет электростатического притяжения катионов к анионам. Она образуется между ионами, электроотрицательность которых сильно отличается друг от друга.
Металлическая химическая связь – связь в металлах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке. Она основана на обобществлении валентных электронов, принадлежащих всем атомам в кристалле.
Водородной связью называют химическую связь, образованную атомом водорода, связанным с атомом другого более электроотрицательного элемента (О, F, N, Сl). Эта связь обусловлена электростатическим притяжением, которому способствуют малые размеры атома водорода. Водородная связь может быть межмолекулярной и внутримолекулярной.
Степень окисления – это условный заряд атома в молекуле, вычисленный согласно предположению о том, что молекула состоит только из ионов.
Правила нахождения степени окисления
Алгебраическая сумма степеней окисления атомов в молекуле любого вещества равна нулю,
Степень окисления элемента в простом веществе равна нулю,
Степень окисления атомов в молекуле сложного вещества может быть выражена отрицательным или положительным числом,
Алгебраическая сумма степеней окисления атомов в сложном ионе равна его заряду,
Элементы с постоянной степенью окисления:
Н +1(кроме гидридов),
О –2 (кроме пероксидов) и ОF2
элементы главной подгруппы 1 группы +1,
все элементы 2 группы, кроме Hg +2,
алюминий АI +3,
фтор F – 1.
Задание №1. Составьте структурные и электронные формулы соединений с водородом следующих элементов: а) кремния, б) фосфора, в) брома, г) углерода.
Задание №2. Определите степени окисления элементов в следующих веществах: а) MgCl2, б) Na2SO4, в) KHSO4, г) NH3, д) KNO2, е) Na2Cr2O7, ж) NaSbO3, з) KMnO4.
Задание №3. Составьте структурные и электронные формулы следующих веществ: а) MgCl2, б) Н2S, в) F2, г) NH3, д) O2, е) CO2 .
Определите виды химической связи в данных соединениях.
