
- •Глава 1 коррозионная характеристика металлов и сплавов
- •Конструкционные материалы на основе железа
- •1.1.1 Стали и чугуны
- •1.1.2 Легирование сталей как способ повышения коррозионной стойкости
- •Жаростойкие сплавы на основе железа
- •В зависимости от содержания хрома в сплаве
- •1.1.4 Современные коррозионно-стойкие сплавы и стали
- •1.2 Конструкционные материалы на основе цветных металлов
- •1.2.1 Алюминий и его сплавы
- •1.2.2 Магний и его сплавы
- •1.2.3 Медь и медные сплавы
- •Методические рекомендации к главе 1
- •Вопросы для самопроверки
- •Задания для самостоятельных и контрольных работ.
- •Глава 2 Защита металла от коррозии поверхностными тонкослойными покрытиями
- •2.1 Фосфатные и оксидные защитные пленки
- •2.1.1 Фосфатирование
- •2.1.2 Оксидирование
- •2.1.3 Пассивирование
- •2.1.4 Анодирование
- •2.2 Гальванические покрытия
- •2.2.1 Цинкование и кадмирование
- •2.2.2 Покрытия из олова и свинца
- •2.2.3 Никелевые покрытия
- •2.2.4 Хромирование
- •2.3 Жаростойкие защитные покрытия
- •2.3.1 Термодиффузионный метод покрытия
- •2.3.2 Горячий метод или метод погружения в расплавленный металл
- •2.3.3 Металлизация напылением
- •2.3.4 Плакирование — термомеханический способ
- •2.4 Лакокрасочные защитные покрытия
- •Методические рекомендации к главе 2 Вопросы для самопроверки
- •Темы для самостоятельных и контрольных работ
- •Глава 3 локальные виды коррозии. Методы испытания материалов на стойкость против коррозии
- •3.1 Локальные виды коррозии
- •3.1.1 Питтинговая коррозия
- •3.1.2 Язвенная коррозия
- •3.1.3 Щелевая коррозия и влияние на конструктивных факторов
- •3.1.4 Межкристаллитная коррозия
- •3.1.5 Селективное вытравливание
- •3.1.6 Контактная коррозия
- •Коррозионно-механическое разрушение металлов
- •3.2.1 Коррозионное растрескивание металлов
- •Температура 320˚с, х900
- •3.2.2 Коррозионная усталость металла
- •Трубке из латуни л63
- •3.2.3 Фреттинг-коррозия
- •3.2.4 Кавитационная эрозия
- •Методы испытаний металлических материалов
- •3.3.1 Основные методы испытаний материалов
- •3.3.2 Испытания материалов на прочность против локальных видов коррозии
- •3.3.3 Испытания материалов на прочность при коррозионно-механических воздействиях
- •3.3.4 Коррозионный мониторинг
- •Методические рекомендации к главе 3 Вопросы для самопроверки
- •Задания для самостоятельных и контрольных работ
Введение
Настоящее учебное пособие предназначено для магистрантов высших учебных заведений, изучающих дисциплины коррозии, введенные в Государственные образовательные стандарты по направлениям «Металлургия».
Основная цель курса — формирование у магистрантов системы знаний по обоснованию и реализации ресурсосберегающих решений при выборе конструкционных материалов и защите их от коррозии во всех сферах природной и производственной деятельности.
Несмотря на очевидную дифференциацию природных и промышленных условий, разнохарактерность организационно-управленческих структур, различие в специфике трудовых процессов, необходима разработка единой научной методологии, объединяющей следующие основополагающие направления инженерного противокоррозионного обеспечения:
анализ обратимых и необратимых деградационных процессов, протекающих в материалах при различных условиях их эксплуатации;
количественная оценка общих и локальных потерь; нормирование способов, средств и критериев получения информации о состоянии объектов;
создание и выбор коррозионностойких материалов;
разработка комплекса мероприятий по защите металлов от коррозии.
Курс «Защита металлов и методы коррозионных испытаний» является комплексной дисциплиной и базируется на знаниях, полученных при изучении фундаментальных химических и общеинженерных дисциплин.
В результате изучения дисциплины» магистранты должны знать:
основы теории коррозионных процессов в газовых и жидких электропроводящих средах;
общие сведения о состоянии и изменении свойств конструкционных материалов под влиянием техногенных и антропогенных факторов;
основные источники коррозионного воздействия на конструкционные материалы при строительной и производственной деятельности, их качественные и количественные характеристики, методы и способы прогнозирования надежности оборудования и последствий коррозионного воздействия;
комплексного обеспечения защиты материалов от коррозии.
Используя эти знания, магистранты должны уметь:
оценить характер влияния окружающей или производственной среды на закономерности течения коррозионных процессов;
выбрать конструкционный материал;
обосновать конструкцию аппарата и комплекс мероприятий по защите оборудования и транспортных коммуникаций от коррозионного воздействия окружающей среды.
Глава 1 коррозионная характеристика металлов и сплавов
Конструкционные материалы на основе железа
Конструкционные материалы на основе железа — чугуны и стали — являются самыми распространенными конструкционными материалами как по объему их производства, так и по частоте использования.
Железо существует в двух аллотропических формах, α и γ. α - железо называется ферритом, оно магнитно, имеет ОЦК решетку и стабильно при Т < 910 °С и Т > 1401 °С. Устойчивая при высоких температурах форма феррита называется δ-феррит. γ -железо имеет ГЦК решетку, не обладает магнитными свойствами и называется аустенитом. ПДК в воде — 0,1 мг/л. Железо (так же, как хром и марганец) относится к черным металлам. В природе оно всегда существует в окисленной форме (в виде руд), содержащей в своем составе также С, О, S, Mn, Cr, Ni и другие элементы.
Стандартный потенциал для реакции Fe2+ + 2е = Fe равен - 0,44 В, а для
реакции Fe3+ + 3е =Fe равен - 0,036 В. Однако реально измеряемый на практике потенциал значительно отличается от равновесного.
В присутствии кислорода или других окислителей железо пассивируется и его стационарный потенциал приближается к +0,1 В. Если в растворе находится ион водорода или галоидные ионы, потенциал железа сдвигается в отрицательную сторону и может достигать значений - 0,6 В.
В большинстве сред, за исключением растворов минеральных кислот, при коррозии железа образуются нерастворимые продукты коррозии — ржавчина.
Первичный анодный процесс приводит к образованию ионов двухвалентного железа Fe2+. В нейтральных растворах образуется гидроксид Fe(II)-Fe(OH)2, растворимость которого равна 1,64*10-3 г/л. При наличии в растворе О2 протекает дальнейшая реакция — образование гидроксида трехвалентного железа Fe(OH)3:
4Fe(OH)2 + О2 + 2Н2О = 4Fe(OH)3
Последний имеет растворимость ≈ 4,8 ∙10-8 г/л, т.е. значительно меньше, чем Fe(OH)2.
Образование ржавчины происходит в растворе в непосредственной близости от корродирующей поверхности. Ржавчина покрывает металл рыхлым слоем. Она обладает плохим сцеплением с металлической поверхностью и поэтому плохо защищает железо от коррозии. Состав ржавчины может быть переменным и его выражают общей формулой:
nFe(OH)2 ∙ mFe(OH)3 ∙ qH2О,
где n,m,q — целые числа.
Железо не является коррозионно-стойким материалом. В атмосферных условиях скорость его коррозии в 5-10 раз превышает скорость коррозии цинка, никеля, меди [1].
Практически все конструкционные материалы на основе железа в тех или иных количествах содержат в своем составе углерод. Рассмотрим диаграмму фазового равновесия Fe-C. Первым исследователем указанной диаграммы был Д. К. Чернов, который обнаружил так называемые «критические точки» (температуры): 770°С - магнитное превращение (точка Кюри); 910 °С - превращение α→γ; 1401 °С - превращение γ→α(δ); 1534°С - плавление; 3200 °С - кипение. Однако поскольку растворимость самого углерода в железе низка и при превышении предела его растворимости выделяется карбид железа—цементит (Fе3С), то, как правило, рассматривают не стабильную диаграмму состояний Fe-C, а метастабильную Fe-Fe3C (рисунок 1.1). На диаграмме соответственно сплошными и пунктирными линиями обозначено метастабильное и стабильное равновесие. Линии АВ, ВС, CD являются линиями солидус, линии АН, HN, JE — ликвидус. Линии NH, NJ, ES, EISI, GO, GS, GP, OS, PK, P'K', PQ, МО, очерчивают области равновесий, имеющих место в твердой фазе. Линии HJB, E'C'F, ECF являются линиями эвтектического, а линии P'S'K' и PSK — эвтектоидного равновесия. Указанным линиям соответствуют следующие температуры (таблица 1.1.)
Таблица 1.1 - Температуры, соответствующие линиям эвтектического и эвтектоидного равновесия в системе Fe-Fe3С
Температура |
Линия на диаграмме Fe-Fe 3С |
||||
|
HJB |
E'C'F |
CF |
P'S'K' |
PSK |
t,°С |
1493 |
1153 |
1147 |
738 |
723 |
Содержания углерода, соответствующие основным точкам на диаграмме Fe-Fe3C, приведены в таблице 1.2.
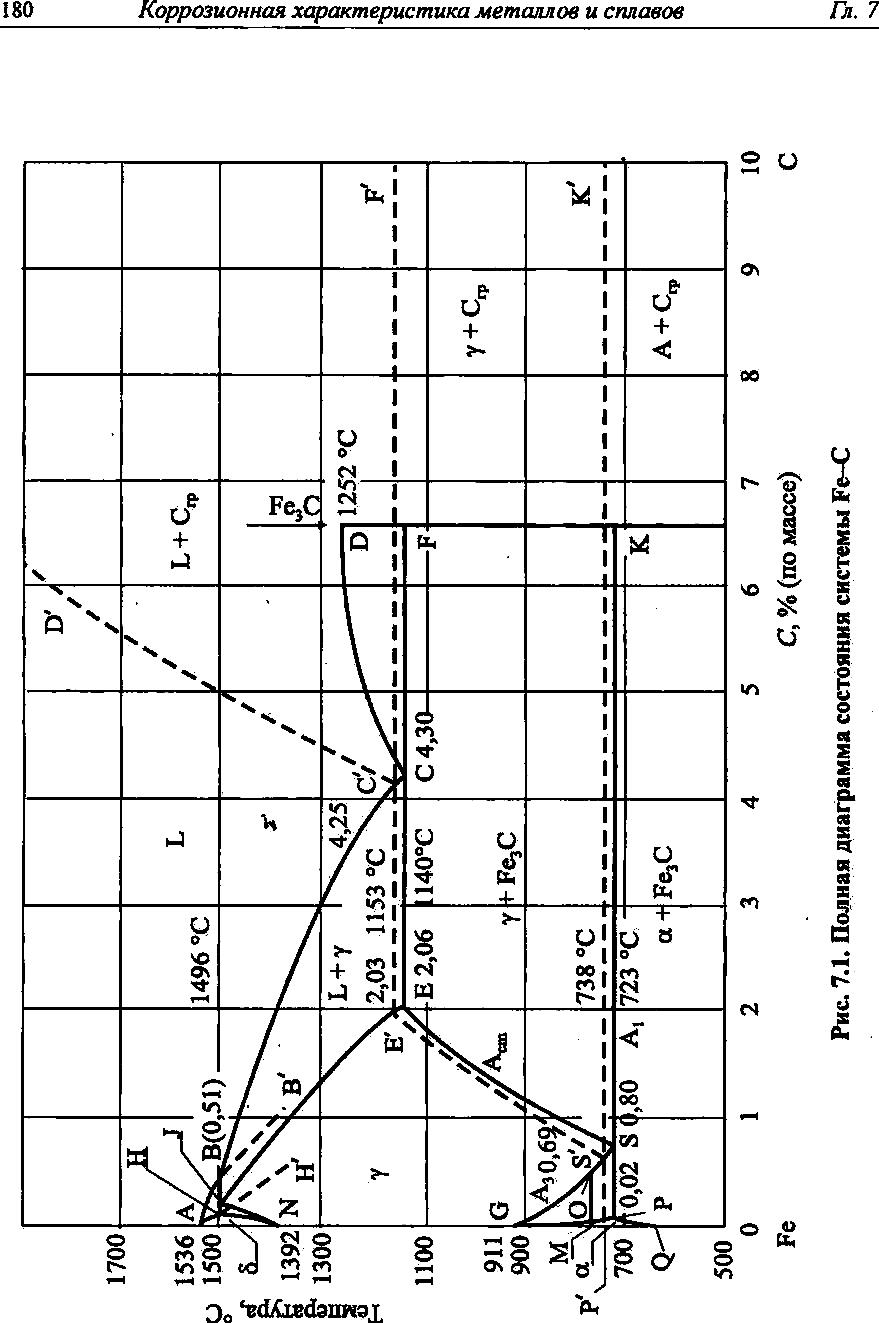
Рисунок 1.1 - Полная диаграмма состояния системы Fe-C
Таблица 1.2 - cодержание углерода, отвечающее характерным точкам на диаграмме Fe-Fe3C
Концентрация |
Точка на диаграмме Fe-Fe3C |
|||||||||||
В
|
С |
CI |
Н |
J |
Е |
Е' |
S |
S' |
Р |
Q |
О |
|
С, масс.% |
0,53 |
4,30
|
4,25 |
0,10 |
0,16 |
2,06 |
2,03 |
0,80 |
0,69 |
0,025 |
0,006 |
0,50 |
