
- •Позааудиторна самостійна робота №1
- •Методичні рекомендації
- •Позааудиторна самостійна робота № 2
- •Методичні рекомендації
- •І рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 3
- •Методичні рекомендації
- •І рівень
- •І рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота №5
- •Значення рН деяких фізіологічних рідин організму
- •Теорії кислот та основ.
- •Методичні рекомендації
- •Рівень і
- •Рівень іі
- •Рівень ііі
- •Позааудиторна самостійна робота № 6
- •Методичні рекомендації
- •І рівень
- •Іі рівень
- •Позааудиторна самостійна робота № 7
- •Хід роботи
- •Індивідуальний добовий харчовий раціон
- •Дані про хімічний склад та енергетичну цінність харчових продуктів
- •Методичні рекомендації
- •Тести для самоконтролю і рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 8
- •Застосування ферментних препаратів у медицині
- •Методичні рекомендації
- •Рівень і
- •Рівень іі
- •Рівень ііі
- •Позааудиторна самостійна робота № 9
- •Йонний склад нервової клітини
- •Позааудиторна самостійна робота № 10
- •Позааудиторна самостійна робота № 11
- •Тести для самоконтролю і рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 12
- •Тести для самоконтролю і рівень
- •Позааудиторна самостійна робота № 13
- •Способи одержання аерозолів.
- •Методи визначення типу емульсій
- •І рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 14
- •Тести для самоперевірки і рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 15
- •Електронна конфігурація атома Карбону
- •Будова молекули метану
- •-Електронна хмара зв’язку Геометрія молекули
- •Будова молекул альдегідів
- •Будова молекул карбонових кислот
- •І рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 16
- •Методичні рекомендації
- •І рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота №17
- •Методичні рекомендації
- •Тести для самоконтролю і рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 18
- •Методичні рекомендації
- •Тести для самоконтролю і рівень
- •Тести для самоконтролю і рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 20
- •Типи зв’язків у білкових молекулах
- •Ковалентні зв’язки
- •Тести для самоконтролю і рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 21
- •Тести для самоконтролю і рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 22
- •П’ятичленні гетероцикли з одним гетероатомом
- •П’ятичленні гетероцикли з двома гетероатомами
- •Шестичленні гетероцикли
- •Тести для самоконтролю і рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 23
- •Мал.20.Схема подвійної спіралі днк та її реплікації. Методичні рекомендації
- •Тести для самоконтролю і рівень
- •Іі рівень
- •Ііі рівень
Методичні рекомендації
Скласти опорний конспект опрацьованого матеріалу, що висвітлює перше питання.
При розгляді другого питання звернути увагу на будову комплексонів.
Розглядаючи третє питання,звернути увагу на застосування даного виду КС у медицині.
Завдання для самоконтролю:
1.Що таке метало – лігандний гомеостаз? Для яких біометалів він детально вивчений?
2. Скільки зв’язків утворює катіон Кальцію з комплексоном Б у молекулі тетацину?
Тести для самоконтролю:
І рівень
1.Який з чинників не є причиною порушення метало – лігандного гомеостазу:
а) нестача вітамінів;
б) надходження ксенобіотиків;
в) дефіцит біоелементів;
г) надлишок біоелементів.
2. Вказати формулу трилону Б:
а) NaЕДТА; б) Na2ЕДТА; в) Na2НТА; г) Сa2ЕДТА.
3.Яка з комплексних сполук платини використовується у медицині як протипухлинний засіб:
а) Cs2[Pt(CN)4F2]; б) Pt(NH3)2Br2; в) K[PtCl3(C2H4)]; г) Pt(NH3)2Cl2
ІІ рівень
4. Вказати назву сполуки, яка використовується при отруєннях солями Кальцію:
а) тетацин; б) комплексон Б; в) унітіол; г) хризолан.
5.Природні сполуки, які здатні утворювати комплекси з катіонами лужних і лужноземельних металів, називаються:
а) криптандами; б) «коронами»; в) кластерами; г) йонофорами.
ІІІ рівень
6. Які з представників КС можуть утворювати халатні сполуки з радіонуклідом Стронцію:
а) йонофори; б) криптанди; в) «корони»; г) аміакати.
7.Які з КС належать до комплексонів:
а) ЕДТА; б) НТА; в) СаNa3ДТПА; г) карбоніли.
Позааудиторна самостійна робота № 4
Тема: Розчини. Фізіологічні розчини, їх склад та застосування.
План
1.Роль води та розчинів в біології та медицині.
2.Осмос і осмотичний тиск, його біологічне значення.
3.Поняття про фізіологічні розчини та їх застосування..
Час виконання: 2 години
Мета роботи : ознайомитися з роллю розчинів у біології та медицині, розглянути склад і застосування фізіологічних розчинів.
Водні розчини – це найпоширеніші системи у живій і неживій природі. Оскільки вода є універсальним розчинником твердих, рідких і газоподібних речовин. Розчини відіграють винятково важливу роль у життєдіяльності будь – яких організмів. Саме у водному середовищі відбувається більшість хімічних реакцій, у тому числі й складні фізіологічні та біохімічні процеси (травлення їжі, всмоктування в кров поживних речовин та виведення з організму продуктів обміну тощо). Основні біологічні системи - плазма крові, лімфа, сеча, спинномозкова рідина – містять різні неорганічні та органічні речовини у розчиненому стані.
Добова потреба дорослої людини у воді становить в середньому 2,5 дм3 , причому в організмі людини відбувається постійний обмін води і розчинених у ній речовин. Основна частина води організму (70%) міститься всередині клітин разом з катіонами Калію і фосфат – йонами; 23% - у міжклітинній рідині з йонами Натрію, хлорид – і гідрогенкарбонат – йонами; 7% - усередині кровоносних судин і плазми крові.
Дифузія – це самочинний процес вирівнювання концентрації речовини у всьому об’єму розчину, зумовлений тепловим рухом частинок розчиненої речовини і розчинника. Дифузія відбувається з розчину більшої концентрації розчиненої речовини у розчин з меншою концентрацією цієї речовини.
Розглянемо процес дифузії, коли між розчином і розчинником, або на межі двох розчинів різної концентрації, помістити напівпроникну мембрану. Напівпроникними є перегородки, крізь пори яких проходять тільки молекули розчинника і затримуються частинки розчиненої речовини. Такі властивості характерні для стінок клітин живих і рослинних організмів (стінок кишок, сечового міхура, шкіри, протоплазми), і штучно виготовлених органічних мембран (плівок з колодію, желатини, целофану). За наявності напівпроникної мембрани відбувається проникнення молекул розчинника у більш концентрований розчин. Односторонню дифузію молекул розчинника крізь напівпроникну мембрану з розчину з меншою концентрацією в розчин з більшою концентрацією, називають осмосом.
Осмос можна спостерігати у приладі, який називають осмометром. (рис. 1)
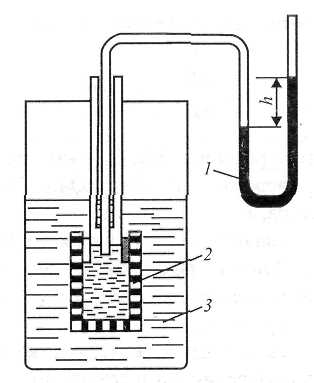 Рис.
1. Схема
осмометра:
1 – манометр;
2 – посудина з розчином; 3 – посудина
з розчинником.
Рис.
1. Схема
осмометра:
1 – манометр;
2 – посудина з розчином; 3 – посудина
з розчинником.
Для цього у посудину (2) з напівпроникною мембраною наливають розчин і закривають корком, у який вставлена трубка, з’єднана з манометром (1). Осмометр занурюють у посудину з розчинником (3). У результаті дифузії розчинника із зовнішньої посудини всередину осмометра, рівень рідини в трубці буде підніматись, що створить надлишковий гідростатичний тиск р, який обчислюють за формулою
p
= h![]() g,
g,
де h -надлишковий стовп рідини; - густина рідини; g – прискорення сили земного тяжіння.
Поступово швидкість дифузії і гідростатичний тиск досягнуть таких величин, за яких кількість молекул розчинника, що переміщуються крізь мембрану в посудину (2) та із посудини (2) у посудину (3), вирівняються. Тобто настане осмотична рівновага. Надлишковий гідростатичний тиск у посудині з розчином, при якому встановлюється осмотична рівновага, називають осмотичним тиском. Величина осмотичного тиску визначається тим зовнішнім тиском, який треба прикласти до розчину, щоб осмос припинився.
Голландський хімік Я. Вант – Гофф (1887) запропонував для обчислення осмотичного тиску застосовувати газові закони: осмотичний тиск розчину дорівнює тому тиску, який учинила б розчинена речовина, перебуваючи за тієї ж температури у газоподібному стані і займаючи об’єм, однаковий з об’ємом розчину. Використовуючи об’єднане рівняння газового стану Менделєєва – Клапейрона:
pV
=
![]() RT
=
RT
=
![]() ,
,
Вант
– Гофф вивів рівняння для визначення
осмотичного тиску
![]() :
:
=
![]() = CMRT,
= CMRT,
де -осмотичний тиск розчину, кПа; СМ – молярна концентрація розчину, моль/л; R –універсальна газова стала (8,314 Дж/(моль*К); T- абсолютна температура, К.
Наведене вище рівняння є математичним виразом закону осмотичного тиску Вант – Гоффа, який формулюють так: осмотичний тиск розчину прямо пропорційний його молярній концентрації та абсолютній температурі.
Відомо, що всі біологічні рідини є водними розчинами багатьох мінеральних і органічних речовин. Вони мають певний осмотичний тиск, який підтримується на відносно сталому рівні. Так, для плазми крові людини цей показник дорівнює 770-821 кПа (7,6-8,1 атм). На відміну від крові, осмотичний тиск сечі і поту коливається у ширших межах. Близько 60 % осмотичного тиску крові створюють наявні у ній йони Nа+ і СІ-, а значно меншу його частину зумовлюють білки. Тиск, що створюється високомолекулярними біологічно активними сполуками, називають онкотичним тиском. Він становить менше 0,5 % від загального осмотичного тиску (3,04-4,05 кПа або 0,03-0,04 атм) і на 80 % визначається альбумінами. Онкотичному тиску належить основна роль у механізмі надходження води у кров із тканинної рідини, тому що низькомолекулярні речовини плазми без перешкод проникають крізь стінки кровоносних капілярів і їх концентрація у крові і тканинній рідині практично однакова. Оскільки онкотичний тиск крові становить близько 4 кПа, а тканинної рідини та лімфи - приблизно 1,33 кПа, то за рахунок цієї різниці тисків вода надходить із лімфи у кров.
Завдяки тому, що стінки клітин мають властивості мембран, розподіл води в тканинах залежить від осмотичного тиску. Зокрема, стан осмотичної напруженості клітини, зумовлений підвищеним осмотичним тиском, називають тургором. Він забезпечує пружність та еластичність тканин. У рослин засушливих місцевостей осмотичний тиск високий, а у болотних рослин - порівняно низький.
Вода проникатиме у клітину доти, поки різниця осмотичного тиску між клітиною та середовищем не стане рівна нулю, або поки гідростатичний тиск у клітині, який збільшується в результаті набрякання клітини і розтягнення її оболонки, не зрівноважить осмотичного тиску.
У процесі регуляції осмотичного тиску беруть участь органи виділення, головним чином нирки і потові залози. Завдяки їм вода, що надходить в організм, і продукти метаболізму виводяться із сечею та потом, не спричинюючи суттєвих змін осмотичного тиску.
Розчини з однаковим осмотичний тиском називають ізотонічними. Якщо осмотичний тиск одного розчину більший, ніж іншого, то перший розчин с гіпертонічним, а коли навпаки - то гіпотонічним.
Ізотонічність - це одна із вимог, що ставляться до інфузійних розчинів, очних крапель та ін. У клінічній практиці ізотонічними є розчини, осмотичний тиск яких дорівнює осмотичному тиску плазми крові, тобто 7,7-8,1 атм. Це розчини з масовою часткою натрій хлориду 0,85-0,9 % або глюкози - 4,5-5,0 %. Крім того, використовують різні багатокомпонентні фізіологічні розчини, зокрема Рінгера, Рінгера - Локка, Тироде та ін., які за своїм хімічним складом наближаються до плазми крові (містять йони Натрію, Калію, Кальцію, Магнію, Хлору, гідрогенкарбонат-іони, дигідрогенфосфат-іони, глюкозу). Такі розчини можна вводити внутрішньовенно у досить великих кількостях при втратах крові і плазми. Цікаво, що їх склад подібний до складу морської води.
Зміна осмотичного тиску рідини, що оточує клітину, призводить до порушення в ній водного обміну. У гіпотонічних розчинах спостерігається явище лізису, тобто клітини набрякають і руйнуються. Наприклад, якщо еритроцити вмістити в розчин з меншим осмотичним тиском, ніж всередині еритроцита, то вода проникатиме всередину еритроцита і останній набрякає, збільшується в об'ємі і руйнується. Явище руйнування оболонки еритроцитів при введенні у плазму крові гіпотонічних розчинів, що супроводжується виходом гемоглобіну в плазму, називають гемолізом (утворюється "лакова" кров) (див. рис. 2).
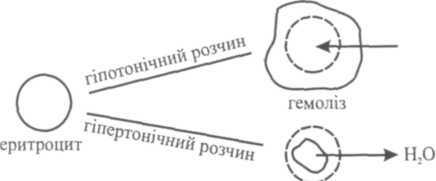
Н2О
плазмоліз
Рис. 2. Гемоліз і плазмоліз еритроцитів
Якщо еритроцити вмістити у розчин з більшим осмотичним тиском, ніж всередині еритроцитів, тобто у гіпертонічний розчин, то вони втрачають воду, різко зменшуються в об'ємі і зморщуються. Явище зморщування еритроцитів при введенні у плазму крові гіпертонічних розчинів називають плазмолізом.
Щоб не порушити осмотичної рівноваги крові, гіпертонічні розчини глюкози (з масовою часткою 20 %, 40 %) вводять у кров внутрішньовенно і дуже повільно, найчастіше крапельним шляхом.
Гіпертонічний розчин натрій хлориду (5-10%) застосовують у хірургії зовнішньо для очищення гнійних ран. При накладанні марлевих пов'язок, змочених таким розчином, рідина із рани рухається у напрямку розчину з більшим осмотичним тиском і це сприяє очищенню її від гною, мікроорганізмів тощо. Гіпертонічні розчини гіркої солі МgSО4 · 7 H2O, або глауберової солі Na2SО4 · 10H2O застосовують як послаблюючі засоби, тому що внаслідок осмосу відбувається перехід великої кількості води із слизової оболонки у просвіт кишок.
Методичні рекомендації
1.При вивченні першого питання скласти опорний конспект.
2.При вивченні другого питання розглянути процес осмосу за малюнком 1, записати математичний вираз закону осмотичного тиску Вант – Гоффа. Скористатися пам’яткою №2. Записати визначення онкотичного тиску та тургору.
3.Розглядаючи третє питання, з’ясувати, які процеси відбуваються при введенні в кров гіпо- та гіпертонічних розчинів.
Запитання для самоперевірки:
Яке явище називають осмосом? Що таке осмотичний тиск? Сформулювати закон Вант – Гоффа і написати його математичний вираз для розведених розчинів електролітів і неелектролітів.
Що таке онкотичний тиск?
Які розчини називають: а) ізотонічними; б) гіпотонічними; в) гіпертонічними? Навести приклади ізотонічних та гіпертонічних розчинів, які використовуються в медичній практиці. У якому з цих розчинів відбувається гемоліз, а в якому – плазмоліз еритроцитів?
Тести для самоконтролю
