
- •Позааудиторна самостійна робота №1
- •Методичні рекомендації
- •Позааудиторна самостійна робота № 2
- •Методичні рекомендації
- •І рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 3
- •Методичні рекомендації
- •І рівень
- •І рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота №5
- •Значення рН деяких фізіологічних рідин організму
- •Теорії кислот та основ.
- •Методичні рекомендації
- •Рівень і
- •Рівень іі
- •Рівень ііі
- •Позааудиторна самостійна робота № 6
- •Методичні рекомендації
- •І рівень
- •Іі рівень
- •Позааудиторна самостійна робота № 7
- •Хід роботи
- •Індивідуальний добовий харчовий раціон
- •Дані про хімічний склад та енергетичну цінність харчових продуктів
- •Методичні рекомендації
- •Тести для самоконтролю і рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 8
- •Застосування ферментних препаратів у медицині
- •Методичні рекомендації
- •Рівень і
- •Рівень іі
- •Рівень ііі
- •Позааудиторна самостійна робота № 9
- •Йонний склад нервової клітини
- •Позааудиторна самостійна робота № 10
- •Позааудиторна самостійна робота № 11
- •Тести для самоконтролю і рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 12
- •Тести для самоконтролю і рівень
- •Позааудиторна самостійна робота № 13
- •Способи одержання аерозолів.
- •Методи визначення типу емульсій
- •І рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 14
- •Тести для самоперевірки і рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 15
- •Електронна конфігурація атома Карбону
- •Будова молекули метану
- •-Електронна хмара зв’язку Геометрія молекули
- •Будова молекул альдегідів
- •Будова молекул карбонових кислот
- •І рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 16
- •Методичні рекомендації
- •І рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота №17
- •Методичні рекомендації
- •Тести для самоконтролю і рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 18
- •Методичні рекомендації
- •Тести для самоконтролю і рівень
- •Тести для самоконтролю і рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 20
- •Типи зв’язків у білкових молекулах
- •Ковалентні зв’язки
- •Тести для самоконтролю і рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 21
- •Тести для самоконтролю і рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 22
- •П’ятичленні гетероцикли з одним гетероатомом
- •П’ятичленні гетероцикли з двома гетероатомами
- •Шестичленні гетероцикли
- •Тести для самоконтролю і рівень
- •Іі рівень
- •Ііі рівень
- •Позааудиторна самостійна робота № 23
- •Мал.20.Схема подвійної спіралі днк та її реплікації. Методичні рекомендації
- •Тести для самоконтролю і рівень
- •Іі рівень
- •Ііі рівень
Методи визначення типу емульсій
Тип емульсії можна визначити різними методами. Найчастіше використовують кондуктометричний метод. Як відомо, питома електрична провідність води та її розчинів набагато вища від електричної провідності нерозчинних у ній органічних рідин. Тому, якщо електрична провідність емульсії достатньо висока, то це емульсія типу О/В, у випадку низької електричної провідності навпаки - В/О. Цей метод зручний для визначення типу емульсії, взятої у малих кількостях.
Тип емульсії можна встановити, використовуючи метод флуоресценції. Емульсії В/О під дією ультрафіолетового випромінювання набувають забарвлення, видимого в темній камері, на відміну від емульсій О/В, які звичайно не флуоресціюють.
Широко розповсюджений метод забарвлення емульсій. Його суть полягає у додаванні до емульсії барвника, який розчиняється тільки в одній з рідин, тобто у воді або олії. Після перемішування краплину емульсії розглядають під мікроскопом. Залежно від того, чи забарвлене поле зору (дисперсійне середовище), чи тільки краплинки дисперсної фази, можна зробити висновок про тип емульсії.
Щоб визначити тип емульсії, інколи використовують метод розбавлення. Якщо емульсія розбавляється водою, то вона є дисперсійним середовищем і ми маємо емульсію типу О/В, і відповідно - типу В/О, якщо вона добре розбавляється олією.
Є ще один простий метод встановлення типу емульсії - змочування фільтрувального паперу. Якщо при нанесенні краплини емульсії на фільтрувальний папір вона швидко розпливається по його поверхні, а в центрі залишається невелика краплинка, то у більшості випадків це емульсія О/В.
Емульгатори та механізм їх дії .
Оскільки емульсії є гетерогенними системами з великою питомою поверхнею поділу, то вони термодинамічно нестійкі. У них самочинно відбувається процес злиття краплинок дисперсної фази, який зумовлює розшарування емульсій. Таке явище називають коалесценцією.
Стійкість емульсій проти коалесценції тісно пов'язана з концентрацією дисперсної фази та ступенем дисперсності. Розбавлені високодисперсні емульсії досить стійкі, а для одержання стійких концентрованих емульсій вже необхідне застосування емульгаторів.
Емульгатори - це розчинні колоїдні ПАР, ВМС або нерозчинні порошкоподібні речовини, які сприяють процесу емульгування та надають емульсіям стійкості.
За своєю природою емульгатори поділяють на гідрофільні та гідрофобні (табл.4.). Природа емульгатора визначає не тільки стійкість, але й тип емульсії. Згідно з правилом Банкрофта, дисперсійним середовищем в емульсії буде та рідина, до якої емульгатор має спорідненість. Це означає, що гідрофільні емульгатори, які краще розчиняються у воді, ніж у неполярних рідинах, сприяють утворенню емульсій типу О/В. Гідрофобні емульгатори, які не розчиняються у воді і мають спорідненість до олії, стабілізують емульсію типу В/О.
Таблиця 4.
Класифікація емульгаторів |
||
Ступінь дисперсності емульгатора |
Природа емульгатора |
|
гідрофільні |
гідрофобні |
|
Грубодисперсні (порошки) |
СаСОз, СаSО4, Fе2О3, глина |
НgI2, РЬО, сажа |
Колоїдно-дисперсні (ВМС) |
Желатин, казеїн, альбумін, крохмаль, декстрин, гуміарабік |
Смоли, каучук, холестерин |
|
||
Молекулярно -йонні (ПАР) |
Мила лужних металів, барвники |
Мила багатовалент-них металів |
Емульсії обох типів одержують за наявності твердих емульгаторів -тонко подрібнених порошків солей металів, оксидів, різних видів глин тощо. Тип емульсії залежить від властивостей поверхні емульгатора. Механізм стабілізуючої дії цих емульгаторів полягає в утворенні на краплинках дисперсної фази структурно-механічного бар'єру з частинок емульгатора, який запобігає коалесценції.
Колоїдні поверхнево-активні емульгатори добре стабілізують як емульсії О/В, так і емульсії В/О. їх дія залежить від співвідношення полярних гідрофільних ділянок молекули і неполярних вуглеводневих залишків (ліпофільних ділянок), так званого гідрофільно-ліпофільного балансу (ГЛБ). Якщо величина ГЛБ знаходиться в межах 3-6, то такі емульгатори стабілізують емульсію В/О, якщо в межах 8-20, то - емульсію О/В.
Для одержання емульсій медичного призначення широко застосовують оксиетильовані неіоногенні ПАР - плюроніки та твіни. За допомогою плюроніків стабілізують дисперсії лікарських препаратів, які вводять у систему кровообігу. Вони були використані для емульгування перфлуоровуглеводнів у процесі виготовлення "штучної крові". Твіни найчастіше застосовують для одержання лікарських емульсій зовнішнього вживання.
Розглянемо ще природні емульгатори - лецитин та холестерин, які можуть одночасно знаходитись у біологічних об'єктах. Лецитин - це добрий емульгатор емульсій О/В, холестерин - емульсій В/О. Коли вони знаходяться разом, тип стійкої емульсії залежить від їх співвідношення. Якщо співідношення кількості лецитину до кількості холестерину більше восьми, утворюється емульсія О/В, якщо менше - емульсія В/О. Це явище відіграє велику роль у біологічних процесах.
Серед інших природних емульгаторів добре вивчені сапоніни та білки - альбуміни, казеїн тощо. Вони стабілізують пряму емульсію. Стабілізуюча дія білків пояснюється їх адсорбцією на межі поділу фаз, що призводить до утворення на поверхні краплинок міцного захисного шару та заряду внаслідок йонізації груп -СООН та –NН2. Як стабілізатор емульсій В/О застосовують високомолекулярні сполуки, розчинні в олійній фазі, наприклад, каучук. У харчовій та фармацевтичній промисловостях з цією метою використовують стеарат та пальмітат сахарози, а також поліоксиетильовані етери.
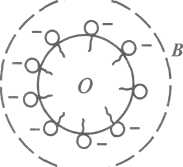
Емульгуючі властивості мають і деякі низькомолекулярні ПАР. Найбільшу емульгуючу дію мають такі, молекули яких містять полярну йоногенну групу та вуглеводневий залишок з 12-18 атомами Карбону. Представником таких емульгаторів є мила- солі вищих жирних кислот. Мила лужних металів як сполуки, розчинні у воді, стабілізують пряму емульсію; мила лужноземельних та багатовалентних металів є стабілізаторами зворотних емульсій. Молекули лужного мила, адсорбуючись на краплинках олії, утворюють на їх зовнішній поверхні відносно товстий адсорбційно-сольватний шар, який перешкоджає зіткненню та злиттю краплинок олії. При цьому на їх поверхні розташовані полярні гідрофільні групи -СООNа, які у воді йонізують і надають краплинкам олії негативного заряду. Однойменний заряд усіх крапель, у свою чергу, сприяє збільшенню стійкості емульсії (рис.17, а). Крім того, мила знижують міжфазовий поверхневий натяг, полегшуючи процес емульгування.
а
 б
б
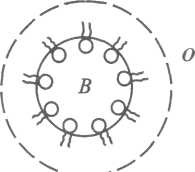
Рис. 17.Схема стабілізації емульсії О/В милом лужного металу (а) і емульсії В/О - милом лужноземельного металу (б)
Мила лужноземельних металів, розчиняючись в олії, утворюють адсорбційно - сольватний шар вже на зовнішній поверхні краплин води, захищаючи їх від коалесценції (рис.17, б).
Отже, стабілізуюча дія поверхнево-активних емульгаторів зумовлена тим, що вони:
1) знижують міжфазовий поверхневий натяг;
2) утворюють навколо краплин дисперсної фази захисну оболонку;
3) надають краплинам емульсії однойменного заряду.
Специфічною властивістю більшості емульсій є їх здатність перетворюватись на емульсію протилежного типу, при цьому дисперсна фаза першої емульсії стає дисперсійним середовищем другої, і навпаки. Цей процес називають "оберненням фаз емульсії", який можна викликати додаванням емульгатора, що стабілізує протилежний тип емульсії. Так, якщо до емульсії О/В додати кальцій олеат - нерозчинне у воді мило, то ця емульсія перетвориться на емульсію води в олії. Обернення фаз емульсії може відбуватися також при збільшенні концентрації дисперсної фази, зміні температури, а також тривалій механічній дії.
Способи одержання та руйнування емульсій
У більшості випадків емульсії одержують диспергуванням, що досягається інтенсивним збовтуванням або перемішуванням рідин за наявності вибраного емульгатора. Часто емульсії одержують у спеціальних апаратах, протискуючи рідини крізь сито з дуже маленькими отворами чи крізь вузькі щілини. Стійку емульсію отримують, використовуючи колоїдні млинки, а також за допомогою ультразвукового диспергування.
Для приготування високодисперсних емульсій застосовують метод гомогенізації, або вторинного зменшення розмірів краплин емульсії. Цей процес здійснюють, протискуючи вихідну емульсію крізь невеликі отвори під дуже високим тиском. При цьому ступінь дисперсності можна збільшити у кілька десятків разів. Апарат, в якому він відбувається, називають гомогенізатором.
Одержання емульсій методом конденсації застосовують рідше. Так, емульсію олії у воді отримують при пропусканні її пари крізь воду. Охолоджуючись і конденсуючись, краплинки олії утворюють дисперсну фазу.
За певних умов може відбуватися процес самочинного емульгування. У цьому випадку емульсія утворюється без зовнішнього перемішування. Самочинне емульгування спостерігається, коли міжфазовий поверхневий натяг на межі вода - олія знижений до дуже малої величини введенням емульгатора. Наприклад, жири, що потрапляють до організму з їжею, емульгуються в кишках солями жовчних кислот і у вигляді високодисперсної емульсії типу О/В всмоктуються їх стінками. Жовчні кислоти, зменшуючи поверхневий натяг до 1∙ 10-3 Н/м, сприяють самочинному диспергуванню.
На практиці часто виникає необхідність зруйнувати емульсію і виділити її складові частини. Одним із найпростіших методів є механічне деемульгування. Його суть полягає у руйнуванні адсорбційних оболонок на частинках дисперсної фази під час розмішування, збовтування чи центрифугування.
Розведені емульсії, стабільність яких зумовлена наявністю на частинках дисперсної фази подвійного електричного шару, можуть бути деемульговані додаванням електролітів, наприклад, кислот, які його руйнують. Додавання речовин з поверхневою активністю, більшою від застосованого емульгатора, які не мають емульгуючих властивостей, призводить до витіснення емульгатора з поверхні краплинок дисперсної фази та руйнування емульсії.
Деякі емульсії можна зруйнувати заморожуванням, нагріванням або накладанням електричного поля високої напруги.
Практичне значення емульсій
Емульсії використовують у найрізноманітніших галузях науки і народного господарства. Вони мають велике практичне значення у будівництві, текстильній, шкіряній, харчовій, хімічній промисловостях, їх широко застосовують у медицині, фармації та парфумерії. До емульсій належать молоко, вершки, майонез, маргарин, яєчний жовток, латекси,бітумні емульсії, препарати для жирування шкір тощо. В організмі жири і ліпіди переносяться кров'ю у вигляді емульсій і комплексів з -глобуліном, забезпечуючи жирове живлення. В медицині багато лікарських речовин застосовують у вигляді емульсій, причому емульсії О/В використовують для внутрішнього вживання та для ін'єкцій, а емульсії В/О - у більшості випадків як зовнішні засоби. Інколи емульгуванням вдається замаскувати неприємний смак масел, олій та смол, наприклад, риб'ячого жиру, рицинової олії тощо.
..
Методичні рекомендації
При розгляді першого питання звернути увагу на професійні хвороби, які зумовлюють аерозолі.
Розглядаючи друге питання, скласти схему, яка ілюструє способи одержання аерозолів.
При вивченні третього питання звернути увагу на відмінність суспензій від колоїдних розчинів.
При опрацюванні четвертого питання звернути увагу на методи класифікації емульсій та визначення їх типу.
При розгляді п’ятого питання скласти опорний конспект, у якому схематично відобразити способи одержання емульсій та їх значення.
Запитання для самоперевірки:
1.Як класифікують аерозолі за агрегатним станом дисперсної фази? Що таке смог?
2. Які переваги аерозольної лікарської форми?
3. Наведіть класифікацію емульсій. Чим відрізняються розбавлені емульсії від концентрованих і висококонцентрованих?
4. Як класифікують емульгатори?
5. Як визначити тип емульсії?
Тести для самоконтролю
