
3.1 Общие указания
Перед выполнением лабораторной работы изучите настоящие методические указания, соответствующие разделы работ [3,4], подготовьте ответы на контрольные вопросы и заготовьте бланк отчета.
Для выполнения настоящей работы необходимо знать следующие основные положения:
1 Термодинамический процесс, в котором к системе не подводится и от системы не отводится теплота (без теплообмена с окружающей средой) называют адиабатным (dq = 0). Термодинамическая система, в которой протекает адиабатный процесс, представляет собой систему, ограниченную оболочкой, снабженной идеальной теплоизоляцией. В реальных условиях процесс является адиабатным в тех случаях, когда система снабжена хорошей теплоизоляцией с низкой теплопроводностью, или процесс изменения состояния рабочего тела (газа) происходит настолько быстро, что практически не успевает осуществляться теплообмен между рабочим телом и окружающей средой, т.е. этот теплообмен пренебрежительно мал.
![]() 2
Запомните, что для обратимого адиабатного
процесса справедливо равенство
2
Запомните, что для обратимого адиабатного
процесса справедливо равенство
т.е. обратимый адиабатный процесс является в то же время изоэнтропным процессом. Для необратимого адиабатного процесса имеет место неравенство
![]()
![]() т.е.
необратимый адиабатный процесс не
является изоэнтропным. Уравнение
адиабатного процесса можно получить
из уравнения первого закона термодинамики,
принимая при этом dq = 0. Уравнение
адиабатного процесса имеет вид
(уравнение Пуассона)
т.е.
необратимый адиабатный процесс не
является изоэнтропным. Уравнение
адиабатного процесса можно получить
из уравнения первого закона термодинамики,
принимая при этом dq = 0. Уравнение
адиабатного процесса имеет вид
(уравнение Пуассона)
(3.1)
где Р- давление, Па (Н/м2);
υ - удельный объем, м3 / кг;
К-показатель адиабаты.
Имейте в виду, что соотношение (1) справедливо для любого состояния (газа, жидкости и твердого тела). Величина показателя адиабаты существенно различна в различных фазовых состояниях вещества. Для твердых тел и жидкостей величина К весьма велика, причем заметно изменяется с температурой. Для газов и паров величина К меняется в зависимости от температуры относительно слабо, для большинства газов значение К лежит в интервале 1.3 ... 1.7.
3 Воздух при относительно невысоких давлениях можно рассматривать как идеальный газ. Для идеального газа показатель адиабаты определяется как отношение изобарной теплоемкости к изохорной теплоемкости
(3.2)![]()
Используя уравнение Манера СР = Сv + R, можно получить следующее уравнение для определения К
(3.3)
где R - газовая постоянная, кДж/(кгК)
![]()
CV - изохорная теплоемкость.
В общем случае показатель адиабаты может измениться, тогда в уравнение адиабаты необходимо подставлять среднее значение КСР?
![]()
Показатель адиабаты идеальных газов зависит от атомности газов (число атомов в молекулах) и от температуры Как известно, теплоемкость идеальных газов (воздуха) мало меняется с температурой, поэтому величину К можно рассчитать по уравнению (3.3) при известных значениях R и Cv или по уравнению (3.2) при известных СР и Cv .
Показатель адиабаты можно определить также из уравнения адиабаты, если известны начальные и конечные параметры рабочего тела: Р1, υ1, Р2, υ2, по следующей формуле:
(3.5)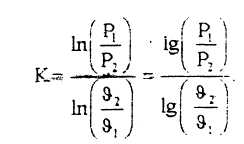
3.2 Методика проведения эксперимента
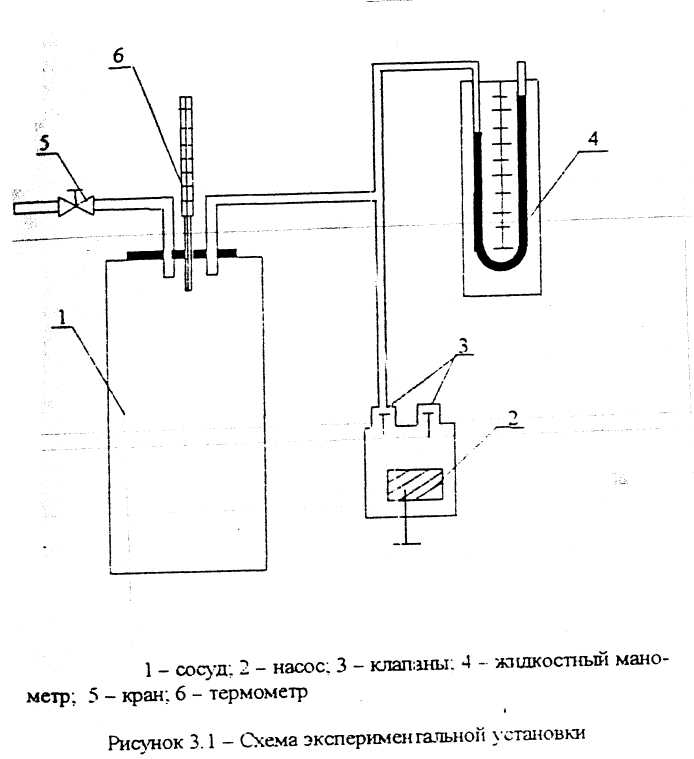
Опыты проводите на установке, принципиальная схема которой приведена на рисунке 3.1, в такой последовательности:
закройте кран о и насосом 2 поднимите давление в сосуде 1 до определенного давления ( по указанию преподавателя), давление при этом контролируйте по жидкостному манометру 4;
после охлаждения воздуха в сосуде до температуры окружающей среды (когда показание манометра не будет изменяться) запишите избыточное давление в сосуде ( Р1, изб);
- откройте кран 5 и выпустите воздух из сосуда, когда давление в сосуде 1 снизится до атмосферного (как только уровни жидкости в правом и левом коленах U - образного манометра сравниваются Р1, изб = 0), быстро закройте кран 5;
процесс расширения воздуха считайте адиабатным ввиду его быстротечности, в результате адиабатного расширения температура воздуха в сосуде 1 уменьшается, т.е. становится ниже температуры окружающей среды, поэтому после закрытия крана 5 начинается процесс изохорного нагрева воздуха в сосуде за счет тепла окружающей среды и давление в сосуде начинает повышаться,
когда температура в сосуде сравняется с температурой окружающей среды (перестанет изменяться давление в сосуде по показанию манометра), запишите величину давления Р3, изб ;
опыт повторите несколько раз при других значениях Р1 (количество опытов по указанию преподавателя);
- результаты опытных данных занесите в таблицу и изобразите процессы на диаграмме Рυ - диаграмме (см. рисунок 3.2).
З.3 Методика обработки опытных данных
Определение показателя адиабаты по формуле (3.5) вызывает определенные трудности ввиду трудоемкости экспериментального определения удельного объема в конце процесса, поэтому этот параметр необходимо исключить из формулы. Для этого после адиабатного расширения воздуха произведите изохорный нагрев до температуры окружающей среды. Итак, Т1 = Т3 = Тос , т.е. процесс 1 - 3 изотермический ( условно показан пунктиром). Из закона Бойля - Мариотта следует P1 / Р3 = υ3 / υ1, т.к. процесс 2 - 3 изохорный (υ2 = υ3), то можно записать P1 / Р3 = υ2 / υ1 , откуда
υ2 = υ1(P1 / Р3 ), и после подстановки вместо υ 2 в уравнение (3.5) получим следующее выражение для определения показателя адиабаты:

В уравнение (3.6) следует подставлять абсолютные значения P1 , Р2 и Р3 в Па (Н/м2), для этого экспериментальные значения P1 , Р2 и Р3 сначала рассчитайте в Па, а затем определите абсолютные давления P1 , Р2 и Р3 Данные занесите в таблицу'. После определения показателя в каждом отдельном эксперименте подсчитайте среднее его значение КсР и определите ошибку эксперимента. Сопоставьте экспериментальные данные из литературных источников и сделайте выводы о работе.
Таблица 3.1 – результаты измерений и расчетных данных

Имейте в виду, что 1 мм. вод. ст = 1/0,102 Па, а 1 мм.рт.ст. = 103/7,5 Па.
3.4 Требования к отчету
Отчет должен содержать:
Титульный лист по установленной форме.
Название и цель работы
Краткую теоретическую часть.
Схему опытной установки и краткое ее описание.
Основные расчетные формулы, результаты измерений и расчетных данных ( сводную таблицу').
Выводы о работе.
Контрольные вопросы
1 Дайте определение основных термодинамических процессов и изобразите эти процессы на диаграммах Р υ и TS .
2 Напишите уравнение адиабатного процесса и объясните, как это уравнение получается.
3 Напишите соотношение между основными термодинамическими параметрами состояния в адиабатном процессе, уравнение первого закона термодинамики для адиабатного процесса.
4 Как определяются в адиабатном процессе работа изменения объема, располагаемая работа, количество теплоты, изменение внутренней энергии, энтальпии и энтропии?
5 Что такое показатель адиабаты, как он определяется и от каких факторов он зависит?
6 Какая связь между показателем адиабаты, газовой постоянной, изобарной и изохорной теплоемкостями?
7 Как зависит показатель адиабаты для идеальных газов от температуры и атомности газов?
8 От каких факторов зависит показатель адиабаты для реальных газов?
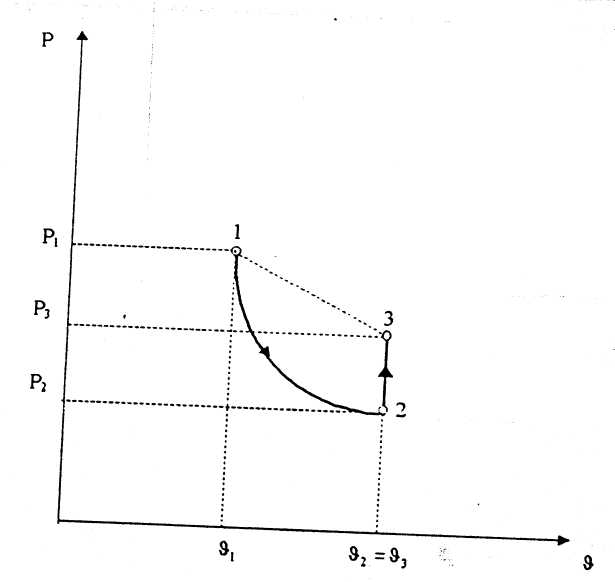
1- 2—адиабатное расширение;
2- 3 - изохорный нагрев.
Рисунок3.2 - Pυ -диаграмма процессов
ЛАБОРАТОРНАЯ РАБОТА 4
ОПРЕДЕЛЕНИЕ СТЕПЕНИ СУХОСТИ ВЛАЖНОГО НАСЫЩЕННОГО
ПАРА
Цель - выработать навыки экспериментального определения степени сухости влажного водяного пара методом конденсации и теплового баланса.
