
- •В каждом периоде Периодической системы электроотрицательность элементов увеличивается при возрастании порядкового номера (слева направо).
- •10 Главная причина образования химической связи – выделение энергии и повышение устойчивости системы.
- •4. Чем меньше запас энергии атома, тем более он устойчив в химическом отношении и его состояние наиболее энергетически выгодное.
- •15. Валентные возможности атомов химических элементов
- •Следствия из закона Гесса:
- •Если в результате последовательных химических реакций система приходит в состояние, полностью совпадающее с исходным (круговой процесс), то сумма тепловых эффектов этих реакций будет равна нулю.
- •Тепловой эффект реакций (δНх.Р.) равен сумме теплот образования (или δНобр.) конечных веществ (δНконеч. В-в) за вычетом суммы теплот образования исходных веществ (δНисх. В-в):
- •19)А) л. Больцман определил энтропию как термодинамическую вероятность состояния (беспорядок) системы w. Энтропия связана с термодинамической вероятностью соотношением:
- •1. Наибольший интерес представляют реакции, протекающие в однородной (гомогенной) среде.
- •2. Для гетерогенной реакции, скорость реакции определяется числом молей веществ, вступивших в или образующихся в результате реакции в единицу времени на единице поверхности:
- •21) А) Факторы, влияющие на скорость химических реакций.
- •1. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое - эндотермическому.
- •3. Влияние концентрации. Влияние концентрации на состояние равновесия подчиняется следующим правилам:
- •24) А)Раствор – гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения её свойств.
- •33.. Равновесия в водных растворах солей, содержащих многозарядные катионы металлов. Вычисление рН (приведите примеры).
- •1) При непосредственном контакте окислителя и восстановителя.
- •2) В Гальваническом элементе:
- •36.Реакции самоокисления - самовосстановления (диспропорционирования). Внутримолекулярные окислительно-восстановительные процессы.
- •37. Уравнение Нернста. Влияние кислотности раствора на величину окислительно-восстановительного потенциала. Выбор среды для проведения окислительно-восстановительного процесса.
- •38. Координационные соединения. Центральный атом и лиганды, внутренняя и внешняя сферы комплексных соединений, координационное число.
- •1) «Простые»
- •2) Комплексные (кристаллогидраты, аммиакаты, двойные соли)
- •39. Строение координационных соединений, гибридизация орбиталей центрального атома.
- •41. Равновесия в растворах комплексных соединений.
1. Наибольший интерес представляют реакции, протекающие в однородной (гомогенной) среде.
Гомогенные системы (однородные) – газ/газ, жидкость/жидкость – реакции идут во всём объёме.
Математически скорость химической гомогенной реакции можно представить с помощью формулы:
2. Для гетерогенной реакции, скорость реакции определяется числом молей веществ, вступивших в или образующихся в результате реакции в единицу времени на единице поверхности:
 Гетерогенные
(неоднородные) системы –
твёрдое/жидкость, газ/твёрдое,
жидкость/газ – реакции
идут на поверхности раздела фаз.Таким
образом, скорость химической реакции
показывает изменение количества вещества
в единицу времени, в единице объема или
на единице поверхности раздела фаз.
Гетерогенные
(неоднородные) системы –
твёрдое/жидкость, газ/твёрдое,
жидкость/газ – реакции
идут на поверхности раздела фаз.Таким
образом, скорость химической реакции
показывает изменение количества вещества
в единицу времени, в единице объема или
на единице поверхности раздела фаз.
в) Закон действующих масс - скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.Для одностадийной гомогенной реакции типа А+В продукты реакции этот закон выражается уравнением: v = k cA cB, где v - скорость реакции; cA и cB - концентрации веществ А и В, моль/л; k - коэффициент пропорциональности, называемый константой скорости реакции. Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или их произведение равно единице. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
21) А) Факторы, влияющие на скорость химических реакций.
1) Природа реагирующих веществ. Большую роль играет характер химических связей и строение молекул реагентов. Реакции протекают в направлении разрушения менее прочных связей и образования веществ с более прочными связями. Так, для разрыва связей в молекулах H2 и N2 требуются высокие энергии; такие молекулы мало реакционноспособны. Для разрыва связей в сильнополярных молекулах (HCl, H2O) требуется меньше энергии, и скорость реакции значительно выше. Реакции между ионами в растворах электролитов протекают практически мгновенно. Примеры: Фтор с водородом реагирует со взрывом при комнатной температуре, бром с водородом взаимодействует медленно и при нагревании.Оксид кальция вступает в реакцию с водой энергично, с выделением тепла; оксид меди - не реагирует.2.) Концентрация. С увеличением концентрации (числа частиц в единице объема) чаще происходят столкновения молекул реагирующих веществ - скорость реакции возрастает. б) Энергия активации в элементарных реакциях, минимальная энергия реагентов (атомов, молекул и других частиц), достаточная для того, чтобы они вступили в хим. реакцию, т. е. для преодоления барьера на поверхности потенциальной энергии, отделяющего реагенты от продуктов реакции.
Потенциальный
барьер - максимум потенциальной энергии,
через который должна пройти система в
ходе элементарного акта химического
превращения. Высота потенциального
барьера для любого пути, проходящего
через переходное состояние, равна
потенциальной энергии в переходном
состоянии. Если в сложной реакции,
состоящей из последовательных и
параллельных элементарных реакций,
имеется лимитирующая элементарная
реакция (реакция с максимальным
характерным временем), то ее энергия
активации является и энергией активации
сложной реакции. В макроскопической
химической кинетике энергия активации
- энергетический параметр Еа, входящий
в <i.Аррениуса
уравнение.
![]() где к
– константа
скорости. А -
предэкспоненциальный множитель
(постоянная или слабо зависящая от
температуры величина); k
- константа
Больцмана; Т
- абсолютная
температура. График зависимости lnk от
1/kT (аррениусов
график) - прямая линия. Наблюдаемая
энергия активации вычисляется из
тангенса угла наклона этой прямой. В
общем случае сложных реакций параметр Еа в
уравнении Аррениуса является функцией
энергии активации отдельных стадий, и
определяемая энергия активации называется
эффективной (эмпирической, кажущейся).
где к
– константа
скорости. А -
предэкспоненциальный множитель
(постоянная или слабо зависящая от
температуры величина); k
- константа
Больцмана; Т
- абсолютная
температура. График зависимости lnk от
1/kT (аррениусов
график) - прямая линия. Наблюдаемая
энергия активации вычисляется из
тангенса угла наклона этой прямой. В
общем случае сложных реакций параметр Еа в
уравнении Аррениуса является функцией
энергии активации отдельных стадий, и
определяемая энергия активации называется
эффективной (эмпирической, кажущейся).
Любой
процесс, сопровождающийся каким-либо
изменением энергии, является экзотермическим
в одном направлении и эндотермическим
в другом. Энергия активации экзотермического
и эндотермического направлений реакции,
обозначаемые соотв. ![]() и
и ![]() ,
связаны соотношением:
,
связаны соотношением: ![]()
где Q - .теплота реакции при Т= 0. Качественная одномерная геометрическая иллюстрация связи энергии активации с высотой потенциального барьера и теплотой реакции представлена на рис., где q -координата реакции ; Е1 и Е2 -уровни энергии соответственно основного состояния реагентов и продуктов реакции.
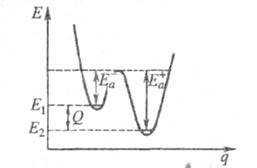
Энергетич. схема элементарной реакции.
Для
реакций рекомбтнации свободных
радикалов (в том числе и атомов), а также
для широкого класса экзотермических
ионно-молекулярных реакций энергия
активации равна нулю или очень мала по
сравнению с типичными значениями энергий
хим. связей Есв.
Для реакций, сопровождающихся одновременно
разрывом одних и образованием других
химических связей, ![]() составляет
обычно от сотых до десятых долей Есв,
если среди реагентов есть свободные
радикалы, и сравнима с Есв , если
реагенты - химически насыщенные
молекулы.
составляет
обычно от сотых до десятых долей Есв,
если среди реагентов есть свободные
радикалы, и сравнима с Есв , если
реагенты - химически насыщенные
молекулы. ![]() может
быть аномально большой (например, больше
энергии возбуждения атома Е*)
в реакциях тушения электронного
возбуждения при столкновениях атомов:
А + А
может
быть аномально большой (например, больше
энергии возбуждения атома Е*)
в реакциях тушения электронного
возбуждения при столкновениях атомов:
А + А ![]() А
+ А, если точка пересечения термов
реагентов и продуктов реакции расположена
высоко по сравнению с Е* или
термы не пересекаются.
А
+ А, если точка пересечения термов
реагентов и продуктов реакции расположена
высоко по сравнению с Е* или
термы не пересекаются.
22)а) Химическое равновесие - состояние системы, в котором скорость прямой реакции равна скорости обратной реакции. Концентрации всех веществ в состоянии равновесия (равновесные концентрации) постоянны. Химическое равновесие имеет динамический характер. Это значит, что и прямая и обратная реакции при равновесии не прекращаются. Для одностадийной обратимой реакции
![]()
при равновесии выражения для скоростей прямой V1 и обратной реакций V2 имеют вид:
![]()
где [A], [B], [C] и [D] - равновесные молярные концентрации веществ A, B, C и D; a,b,c и d - соответствующие стехиометрические коэффициенты (при условии, что реакция идет в одну стадию); k1 и k2 -коэффициенты пропорциональности, называемые константами скоростей.
Из условия равновесия V1=V2 следует:
![]()
Отсюда получаем выражение для константы равновесия Kp:
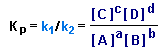
Чем выше величина Kp, тем больше в равновесной смеси продуктов прямой реакции.
Смещение равновесия в нужном направлении достигается изменением условий реакции (прицип Ле-Шателье).
23)
ПРИНЦИП ЛЕ-ШАТЕЛЬЕ.СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ.
Положение химического равновесия зависит от следующих парамктров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1884 году французским ученым Ле-Шателье. Современная формулировка принципа Ле-Шателье такова:
Если на систему,находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние так, чтобы уменьшить эффект внешнего воздействия. |
