- •В каждом периоде Периодической системы электроотрицательность элементов увеличивается при возрастании порядкового номера (слева направо).
- •10 Главная причина образования химической связи – выделение энергии и повышение устойчивости системы.
- •4. Чем меньше запас энергии атома, тем более он устойчив в химическом отношении и его состояние наиболее энергетически выгодное.
- •15. Валентные возможности атомов химических элементов
- •Следствия из закона Гесса:
- •Если в результате последовательных химических реакций система приходит в состояние, полностью совпадающее с исходным (круговой процесс), то сумма тепловых эффектов этих реакций будет равна нулю.
- •Тепловой эффект реакций (δНх.Р.) равен сумме теплот образования (или δНобр.) конечных веществ (δНконеч. В-в) за вычетом суммы теплот образования исходных веществ (δНисх. В-в):
- •19)А) л. Больцман определил энтропию как термодинамическую вероятность состояния (беспорядок) системы w. Энтропия связана с термодинамической вероятностью соотношением:
- •1. Наибольший интерес представляют реакции, протекающие в однородной (гомогенной) среде.
- •2. Для гетерогенной реакции, скорость реакции определяется числом молей веществ, вступивших в или образующихся в результате реакции в единицу времени на единице поверхности:
- •21) А) Факторы, влияющие на скорость химических реакций.
- •1. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое - эндотермическому.
- •3. Влияние концентрации. Влияние концентрации на состояние равновесия подчиняется следующим правилам:
- •24) А)Раствор – гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения её свойств.
- •33.. Равновесия в водных растворах солей, содержащих многозарядные катионы металлов. Вычисление рН (приведите примеры).
- •1) При непосредственном контакте окислителя и восстановителя.
- •2) В Гальваническом элементе:
- •36.Реакции самоокисления - самовосстановления (диспропорционирования). Внутримолекулярные окислительно-восстановительные процессы.
- •37. Уравнение Нернста. Влияние кислотности раствора на величину окислительно-восстановительного потенциала. Выбор среды для проведения окислительно-восстановительного процесса.
- •38. Координационные соединения. Центральный атом и лиганды, внутренняя и внешняя сферы комплексных соединений, координационное число.
- •1) «Простые»
- •2) Комплексные (кристаллогидраты, аммиакаты, двойные соли)
- •39. Строение координационных соединений, гибридизация орбиталей центрального атома.
- •41. Равновесия в растворах комплексных соединений.
Следствия из закона Гесса:
Если в результате последовательных химических реакций система приходит в состояние, полностью совпадающее с исходным (круговой процесс), то сумма тепловых эффектов этих реакций будет равна нулю.
Тепловой эффект реакций (δНх.Р.) равен сумме теплот образования (или δНобр.) конечных веществ (δНконеч. В-в) за вычетом суммы теплот образования исходных веществ (δНисх. В-в):
ΔНх.р. = Σ ΔНпрод. р-ции – Σ ΔНисх. в-в.
б)
Наиболее важное для практики следствие
закона Гесса: - энтальпия
химической реакции равна разности между
суммой энтальпий образования продуктов
реакции минус и суммой энтальпийи
образования исходных веществ
(реагентов).![]() (2.6)
(2.6)
Например,
значение энтальпии реакции между
растворами сильной кислоты и сильного
основания может быть получено по
табличным данным энтальпий образования
исходных веществ., если представить эту
реакцию:, например HCl(р-р) +
NaOH(р-р) =
NaCl(р-р) +
Н2Ож
может быть получено по
табулированным энтальпиям образования
в виде реакций между ионами, поскольку
эта реакция в действительности является
реакцией между ионами H+ и
OH–:
H+(р-р) +
OH–(р-р) =
Н2Ож (2.7)
Уравнение (2.7) - это уравнение
реакции нейтрализации. Оно справедливо
для всех реакций между сильной кислотой
и сильным основанием, а следовательно
и энтальпия этих реакцийодно и тоже для
будет одна и та же.Табличные значения
энтальпий образования (![]() )
ионов Н+ и
ОН– и
молекулы Н2Ож известны
и соответственно равны 0, –229,94 и –285,84
кДж/моль, соответственно. Тогда, по
формуле (2.6) тепловой эффект реакции
нейтрализации:
)
ионов Н+ и
ОН– и
молекулы Н2Ож известны
и соответственно равны 0, –229,94 и –285,84
кДж/моль, соответственно. Тогда, по
формуле (2.6) тепловой эффект реакции
нейтрализации:
![]() rHо =
fH(H2Oж )
–
fH(H+р-р)
–
fH(OH–р-р )
=–285,84 – (–229,94) = –55,9 кДж/моль
rHо =
fH(H2Oж )
–
fH(H+р-р)
–
fH(OH–р-р )
=–285,84 – (–229,94) = –55,9 кДж/моль
19)А) л. Больцман определил энтропию как термодинамическую вероятность состояния (беспорядок) системы w. Энтропия связана с термодинамической вероятностью соотношением:
|
|
|
Размерность энтропии 1 моля вещества совпадает с размерностью газовой постоянной R и равна Дж∙моль–1∙K–1. Изменение энтропии *) в необратимых и обратимых процессах передается соотношениями ΔS > Q / T и ΔS = Q / T. Например, изменение энтропии плавления равно теплоте (энтальпии) плавления ΔSпл = ΔHпл/Tпл. Для химической реакции изменение энтропии аналогично изменению энтальпии
|
|
|
*) термин энтропия был введен Клаузиусом (1865 г.) через отношение Q / T (приведенное тепло).
Здесь ΔS° соответствует энтропии стандартного состояния. Стандартные энтропии простых веществ не равны нулю. В отличие от других термодинамических функций энтропия идеально кристаллического тела при абсолютном нуле равна нулю (постулат Планка), поскольку W = 1.
Энтропия вещества или системы тел при определенной температуре является абсолютной величиной. В табл. 4.1 приведены стандартные энтропии S° некоторых веществ.
|
Из табл. следует, что энтропия зависит от:
агрегатного состояния вещества. Энтропия увеличивается при переходе от твердого к жидкому и особенно к газообразному состоянию (вода, лед, пар).
изотопного состава (H2O и D2O).
молекулярной массы однотипных соединений (CH4, C2H6, н-C4H10).
строения молекулы (н-C4H10, изо-C4H10).
кристаллической структуры (аллотропии) – алмаз, графит.
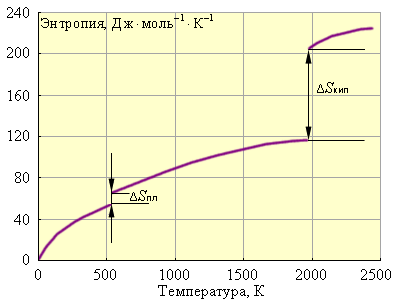
Наконец, рис. 4.3 иллюстрирует зависимость энтропии от температуры.
|
Зависимость энтропии от температуры для свинца:ΔSпл = 8 Дж·моль–1·К–1; Tпл = 600,5 К;ΔSкип = 88 Дж·моль–1·К–1; Tкип = 2013 К |
Следовательно, стремление системы к беспорядку проявляется тем больше, чем выше температура. Произведение изменения энтропии системы на температуру T ΔSколичественно оценивает эту тендецию и называется энтропийным фактором.
б) Для реакции, протекающей в изобарно-изотермических условиях, в некотором неравновесном исходном состоянии энергии Гиббса или химические потенциалы реагирующих веществ и продуктов реакции в общем случае не одинаковы, их разность (ΔGT) может быть рассчитана по уравнению:
![]()
где ![]() —
отношение парциальных давлений участников
реакции в исходном состоянии в степенях,
равных их стехиометрическим коэффициентам;
R —универсальная
газовая постоянная.
—
отношение парциальных давлений участников
реакции в исходном состоянии в степенях,
равных их стехиометрическим коэффициентам;
R —универсальная
газовая постоянная.
Это уравнение называют уравнением изотермы химической реакции. Оно позволяет рассчитать изменение энергии Гиббса при протекании процесса и определить направление протекания реакции:
при ![]()
![]() —
реакция идёт в прямом направлении, слева
направо;
—
реакция идёт в прямом направлении, слева
направо;
при ![]()
![]() —
реакция достигла равновесного состояния;
—
реакция достигла равновесного состояния;
при ![]()
![]() —
реакция идёт в обратном направлении.
—
реакция идёт в обратном направлении.
Стандартная константа равновесия связана со стандартной энергией Гиббса реакции соотношением:
![]()
Стандартная энергия Гиббса реакции в газовой смеси — энергия Гиббса реакции при стандартных парциальных давлениях всех компонентов, равных 0,1013 МПа (1 атм).
Стандартная
энергия Гиббса реакции в растворе —
энергия Гиббса при стандартном
состоянии раствора,
за которое принимают гипотетический раствор
со свойствами предельно
разбавленного раствора,
но с концентрацией всех реагентов,
равной единице. Величина стандартной
энергии Гиббса реакции может быть
использована для приближенной оценки
термодинамической возможности протекания
реакции в данном направлении, если
начальные условия не сильно отличаются
от стандартных. Кроме того, сравнивая
величины стандартной энергии Гиббса
нескольких реакций, можно выбрать
наиболее предпочтительные, для
которых ![]() имеет
наибольшую по модулю отрицательную величину.
имеет
наибольшую по модулю отрицательную величину.
20)а)Скорость химической реакции – это величина, показывающая как изменяются концентрации исходных веществ или продуктов реакции за единицу времени.б) Для оценки скорости необходимо изменение концентрации одного из веществ.