
- •Задание 1 по теме: Термодинамическая характеристика химической реакции Примеры решения задач
- •S характеризует неупорядоченность системы (мера беспорядка).
- •Прод – продукты реакции; исх – исходные вещества;
- •Многовариантные задания
- •Примеры решения задач
- •Окислительно-восстановительные реакции (овр) – химические реакции, в которых происходит изменение степени окисления атомов элементов, входящих в состав реагирующих веществ
- •Окислительно-восстановительная реакция возможна между веществами, одно из которых содержит атом элемента, способный повысить степень окисления, а другое – понизить степень окисления
- •Число электронов, отданных восстановителем, равно числу электронов, принятых окислителем
- •В электронных уравнениях процессов знак стрелки →
- •Многовариантные задания
- •Примеры решения задач
- •Электродом называют систему, состоящую из электронного проводника (металл, графит и др.), находящегося в контакте с ионным проводником (раствор электролита)
- •Металл с меньшим значением электродного потенциала (более активный) способен вытеснять металл с большим значением электродного потенциала (менее активный) из раствора его соли
- •Металл с отрицательным значением стандартного электродного потенциала способен вытеснять водород из кислот, окисляющих катионом водорода (практически все кислоты, кроме н2so4 (конц), нno3)
- •В схеме гальванического элемента слева помещают анод, справа катод
- •Токообразующая реакция суммарная химическая окислительно-восстановительная реакция, протекающая в гальваническом элементе
- •Многовариантные задания
- •Примеры решения задач
- •1) Анионы бескислородных кислот (кроме f −)I−, Br−, s−2, ci−;
- •Анионы движутся к аноду, катионы – к катоду
- •Многовариантные задания
- •Термодинамические свойства некоторых веществ. Приложение 1
- •Стандартные электродные потенциалы металлов
Многовариантные задания
Задание 1 Дайте термодинамическую характеристику реакции (варианты задания в табл. 1.1) на основании количественных расчётов , , .
1.1. Выпишите из справочных таблиц (прил. 1) стандартные термодинамические свойства: (298), S0(298), (298) всех веществ, участвующих в реакции.
1.2. Охарактеризуйте процесс по величине стандартной энтальпии химической реакции :
− Рассчитайте стандартную энтальпию химической реакции .
− Определите, является реакция экзо- или эндотермической, выделяется или поглощается теплота в результате протекания реакции.
1.3. Охарактеризуйте процесс по величине стандартной энтропии химической реакции :
− Рассчитайте стандартную энтропию химической реакции по
абсолютным стандартным энтропиям веществ S0(298).
− Объясните изменение энтропии (< 0; > 0; = 0), проведя анализ агрегатного состояния всех участвующих в реакции веществ и сравнив число газообразных молекул исходных веществ и продуктов реакции.
1.4. Охарактеризуйте процесс по величине энергии Гиббса химической реакции :
− Рассчитайте стандартную энергию Гиббса :
а) по стандартным энергиям Гиббса образования веществ (298);
б) по уравнению Гиббса G = H – TS.
Сравните полученные величины. Укажите направление протекания реакции при 298 К. Определите знаки энергии Гиббса химической реакции и
направление протекания реакции (прямая или обратная) при низких
температурах ( ) и при высоких температурах ( ). Для этого
проведите анализ уравнения Гиббса, допуская, что и не зависят от температуры.
1.5. Сделайте вывод об обратимости процесса. Для обратимой реакции рассчитайте равновесную температуру Тр.
1.6.
Изобразите схематически график
зависимости
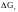 от температуры, используя результаты
анализа уравнения Гиббса.
от температуры, используя результаты
анализа уравнения Гиббса.
1.7. Укажите для обратимой реакции при каких температурах, больших или меньших равновесной Тр, самопроизвольно протекает прямая реакция, а при каких – обратная.
1.8
.Рассчитайте, как изменится (во сколько
раз увеличится или уменьшится ) скорость
реакции, протекающей самопроизвольно
при стандартных условиях, при увеличении
температуры на
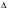 Т
К при заданном «»
Т
К при заданном «»
Варианты заданий Таблица 1.1
Вариант |
Реакция : aА + вВ = сС + dD |
Т, К |
|
1 |
4HCl(г) + O2(г) = 2H2O(г) + 2Cl2(г) |
20 |
4,0 |
2 |
NH4Cl(к) = NH3(г) + HCl(г) |
30 |
3,5 |
3 |
CO2(г) + 3H2(г) = CH3OH(г) + H2O(г) |
30 |
4,0 |
4 |
Mg(OH)2(к) = MgO(к) + H2О (г) |
50 |
2,5 |
5 |
CaCO3(к) = CaO(к) + CO2(г) |
20 |
3,4 |
6 |
S2(г) + 4H2O(г) = 2SO2(г) + 4H2(г) |
50 |
2,2 |
7 |
SO2(г) + Cl2(г) = SO2Cl2(г) |
60 |
2,0 |
8 |
CO(г) + 3H2(г) = CH4(г) + H2O(г) |
40 |
3,0 |
9 |
COCl2(г) = CO(г) + Cl2(г) |
50 |
2,1 |
10 |
CO2(г) + H2(г) = CO(г) + H2O(ж) |
60 |
2,0 |
11 |
CO2(г) + 4H2(г) = CH4(г) + 2H2O(г) |
20 |
3,9 |
12 |
2CO2(г) = 2CO(г) + O2(г) |
30 |
2,3 |
13 |
C2H6(г) = C2H4(г) + H2(г) |
40 |
3,3 |
14 |
C6H6(г) + 3H2(г) = C6H12(г) |
20 |
3,0 |
15 |
C2H2(г) + 2H2(г) = C2H6(г) |
40 |
2,6 |
16 |
C(графит) + CO2(г) = 2CO(г) |
50 |
2,2 |
17 |
C2H5OH(ж) = C2H4(г) + H2O(г) |
30 |
2,1 |
18 |
2N2O4(г) + O2(г) = 2N2O5(г) |
20 |
3,3 |
19 |
3C2H4(г) = C6H6(г) + 3H2(г) |
40 |
2,5 |
20 |
2ZnS(к) + 3O2(г) = 2ZnO(к) + 2SO2(г) |
50 |
2,0 |
21 |
Al2(SO4)3(к) = Al2O3(к) + 3SO3(г) |
20 |
4,0 |
22 |
H2(г) + Br2(ж) = 2HBr(г) |
20 |
3,8 |
23 |
CuCl2(к) +H2O(г) = CuO(к) + 2HCl(г) |
30 |
4,0 |
24 |
MgCO3(к) = MgO(к) + CO2(г) |
40 |
3,6 |
25 |
MnO2(к) + 2C(графит) = 2CO(г) + Mn(к) |
40 |
2,0 |
26 |
2K(к) + 2H2O(ж) = 2KOH(к) + H2(г) |
50 |
2,2 |
27 |
2SO2(г) + O2(г) = 2SO3(г) |
30 |
3,6 |
28 |
2NaNO3(к) = 2NaNO2(к) + O2(г) |
60 |
2,0 |
29 |
PCl5(к) + H2O(г) = POCl3(ж) + 2HCl(г) |
20 |
3,7 |
30 |
2NO2(г) + O3(г) = O2(г) + N2O5(г) |
20 |
3,9 |
31 |
2CO(г) + SO2(г) = S(ромб) + 2CO2(г) |
30 |
2,3 |
32 |
NH4NO3(к) = N2O(г) + 2H2O(г) |
40 |
3,3 |
33 |
H2S(г) + СО2(г) = H2O(ж) + СOS(г) |
30 |
2,8 |
34 |
CS2(ж) + 3O2(г) = CO2(г) + 2SO2(г) |
40 |
2,6 |
35 |
2N2O4(г) + O2(г) = 2N2O5(г) |
30 |
2,1 |
36 |
2Fe(OH)3(к) = Fe2O3(к) + 3H2O(г) |
20 |
3,3 |
37 |
2NO(г) + Cl2(г) = 2NOCl(г) |
20 |
3,6 |
38 |
2H2O(г) + C(графит) = CO2(г) + 2H2(г) |
30 |
2,4 |
39 |
C(графит) + H2O(г) = CO(г) + H2(г) |
30 |
3,2 |
40 |
CH4(г) + 2H2S(г) = CS2(ж) + 4H2(г) |
20 |
3,4 |
Задание 2 и 3 Окислительно-восстановительные реакции
